Определение
Под токсической зернистостью нейтрофилов понимаются изменения, всегда связанные с процессом человеческого токсикоза. Патология получила такое название потому, что впервые она была выявлена у пациентов, страдающих от сепсиса, спровоцированного грамотрицательными микроорганизмами. Но это не значит, что такие организмы токсически воздействуют на нейтрофилы.
Когда речь идет о подобном состоянии, как правило, подразумеваются особые нарушения в морфологическом строении клеток при условии стимуляции ускорения их созревания и возникновения в костном мозге. Подобное нарушение отражает рассинхронизацию процессов созревания цитоплазмы и ядра кровяных клеток.
При указанных патологических изменениях лейкоцитов в цитоплазме клетки формируются специфические вкрапления и большие гранулы. Развивается такое нарушение вследствие изменения структуры белков. Не исключено также формирование специфических вакуолей и телец Деле.
Токсогенная зернистость
Токсогенная зернистость нейтрофилов отличается от токсической тем, что зернистость развивается в связке с другими, более серьезными отклонениями. Сюда относятся базофилии, тельца Князькова-Деле, структуры, светло-синие окрашенные участки. Токсогенная зернистость не может игнорироваться даже в небольших объемах (в отличие от токсической), так как является серьезным симптомом действительно тяжелых процессов, связанных с инфекциями, вирусами. Лейкоцитоз, который развивается на фоне токсогенности, в итоге может привести даже к летальному исходу.
Причины токсической зернистости нейтрофилов
Специалисты выделяют возникновение такого недуга из-за:
- Радиационного поражения организма.
- Раковых образований, находящихся на стадии распада.
- Патологий, которые сопровождаются сильным ухудшением общего состояния больного.
- Явлений воспалительной природы и гнойного характера.
Помимо этого, изменения нейтрофилов могут крыться в следующих состояниях:
- Возникновение рассасывающегося инфильтрата.
- Флегмона.
- Перитонит.
- Крупозная пневмония.
Проявления у детей
Если у ребенка обнаруживается токсическая зернистость нейтрофилов, то, как правило, она является следствием недавно перенесенного заболевания, сопровождающегося сильным повышением температуры, ознобом, продолжительной сильной лихорадкой, выделением больших количеств гноя. Среди таких патологий:
- Кожные заболевания, сопровождающиеся выраженным процессом отделения гноя (к примеру, флегмона).
- Все болезни, которые включены в группу «острого живота».
- Начавшиеся внезапно патологии в абдоминальной полости.
- Скарлатина, корь.
Каковы еще могут быть причины токсической зернистости нейтрофилов у ребенка?
В отдельных случаях патология у малышей проявляется синдромом Чедиака-Хигаси. Такое состояние является врожденным и очень редким нарушением, при котором поражению подвергаются все лейкоцитарные клетки. У таких детей в первую очередь возникает выраженная иммунная недостаточность.
Кроме того, дети часто подвержены гнойничковым и инфекционным патологиям, сильно склонны к злокачественным геморрагиям. К сожалению, такое заболевание часто имеет неблагоприятный прогноз.
Причины изменений
Основные причины этого явления могут быть следующими:
- инфекционные (вирусные и бактериальные) и воспалительные процессы;
- воздействие токсинов;
- тяжелые гнойно-септические процессы;
- распад опухоли под действием облучения.
Токсигенная зернистость особенно сильно выражена при таких заболеваниях:
- скарлатина;
- крупозное воспаление легких;
- перитонит;
- рассасывание инфильтрата;
- флегмона.
Так выглядит токсическая зернистость лейкоцитов в мазке крови
Зернистость токсическая является важным диагностическим признаком при так называемом остром животе, когда уровень лейкоцитов в норме и температура тела повышена незначительно. В качестве примера можно привести гангренозный аппендицит. Токсогенная грануляция может отмечаться во время беременности при отсутствии каких-либо патологий. Качественное изменение всех лейкоцитов, в том числе токсогенная зернистость нейтрофилов, наблюдается у ребенка с редким генетическим заболеванием Чедиака-Хигаси.
Показатели нормы клеточных структур
Нормальным показателем токсической зернистости считается 0 %. Но существуют и условные показатели, когда содержание аномальных клеток незначительное, и врачебное наблюдение не требуется. К таким состояниям относятся:
- Беременность.
- Восстановительный период после перенесенной инфекции.
- Постоперационный период.
Важно помнить, что даже незначительное превышение нормального показателя указывает на присутствие в организме патологического процесса. При терапии специалист отслеживает количество аномальных клеток с целью оценки эффективности назначенного лечебного воздействия и возможной его корректировки.
Подробное описание
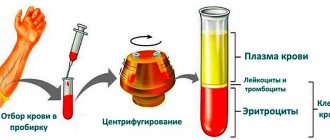
Токсическую зернистость нейтрофилов можно обнаружить при окраске мазков обычным способом. Однако, даже при качественной окраске, пылевидная токсогенная зернистость может быть не видна, а при перекрашивании мазка (даже незначительном) за токсогенную можно принять специфическую зернистость нейтрофильных гранулоцитов. Поэтому для выявления токсической зернистости нейтрофилов предложены специальные методы окраски, из которых наиболее распространенным и доступным является метод Фрейфельд
Метод Фрейфельд
Для окраски мазка используют следующие красители: -1 г основного фуксина растворяют при слабом нагревании в 15 г этилового спирта (96), охлаждают и добавляют 100 мл 5% раствора карболовой кислоты; -1% водный раствор метиленового синего.
Рабочую смесь готовят непосредственно перед окраской, так как она непригодна для хранения. К 20 мл водопроводной воды приливают 7 капель первой краски, смешивают, прибавляют 5 капель второй краски и снова перемешивают.
Мазки крови, фиксированные в течение 3 минут метиловым спиртом, красят в течение 1 часа приготовленной рабочей смесью красителя, а затем смывают водой и высушивают. Препарат, уже окрашенный по Романовскому, может быть окрашен этим способом без предварительного обесцвечивания.
В результате такой окраски в цитоплазме нейтрофилов выявляется синеватая зернистость различного размера (от пылевидной до хлопьевидной) в зависимости от тяжести патологического процесса. Подсчитывают количество клеток с токсической зернистостью в процентах (на 100 нейтрофильных гранулоцитов). В анализе указывают также величину зернистости (пылевидная, мелкая, средняя, крупная, хлопьевидная).
Источник
Разновидности изменений
Данную патологию можно обнаружить при окраске мазков обычным способом. Однако даже при качественной окраске пылевидная токсогенная зернистость может быть не видна. Поэтому для выявления недуга предложены специальные методы, из которых наиболее распространенным и доступным является метод Фрейфельд.
Для характеристики тяжести токсической зернистости нейтрофилов используется специальная классификация. Врачи для этого разработали так называемую систему плюсов. При классификации поражений производят оценку гранул, которые образовались в пораженных клетках, а также процентное содержание больных клеток:
- Зернистость +. В данном случае обнаруживаются мелкие зерна.
- Зернистость ++. Диагностируется при средних размерах, а около половины всех клеток являются патологическими.
- Зернистость +++. Отмечено поражение около 75 % всех клеток, в которых обнаруживаются измененные зерна крупного размера.
- Зернистость ++++. Наблюдается патология кровяных клеток, угрожающая жизни. Цитоплазма в этом случае разреженная, в ней присутствуют гранулы крупного размера.
Образование дегенеративных изменений
Токсическая зернистость нейтрофилов, что это означает и какая причина. В норме клетка нейтрофила в крови содержит мельчайшие включения – зернышки. При наличии сильного воспалительного процесса, сопровождающегося выделением гнойного экссудата, в клетках тканей происходят изменения. Под воздействием инфекционного агента происходят физико-химические реакции, приводящие к сворачиванию белка в крови и присоединению его к естественным зернам клетки.
Таким образом, с одной стороны, нарастает калибр деформированной зернистости и количество, с другой – происходит разряжение цитоплазмы, т.е. цитоплазма клетки нейтрофила теряет свою насыщенность из-за коагуляции белка.
Дегенеративные изменения чаще появляются раньше ядерного сдвига и могут служить предупреждением ухудшения состояния и угрозы развития негативных последствий.
Необходимые для обнаружения зернистости анализы
Важнейшее исследование, позволяющее уточнить диагноз, анализ изменений в лейкоцитарном ряде. Данное исследование очень значимо для дифференциации заболеваний. К примеру, любые патологические изменения в легких вызывают нейтрофильный сдвиг влево, в то время как изменения онкологического характера дегенеративной зернистости не дают. Любые же воспалительные процессы, наоборот, всегда вызывают такое состояние клеток.
Чтобы обнаружить токсическую зернистость нейтрофилов у ребенка и взрослого проводят специальное лабораторное исследование образца крови с использованием метиленового синего и фуксина. Готовят последний следующим образом:
- При помощи нагревания в 15 граммах 96 % этанола растворяется один грамм красителя.
- После этого к полученной смеси добавляется 5 % раствор карболки в количестве 100 граммов.
- Затем в 20 мл воды добавляется 7 капель полученного окрашивающего раствора и 1 % метиленовый синий в количестве 5 капель. Полученный раствор тщательно разбавляют, затем им окрашивают мазки в течение одного часа. После этого их смывают и просушивают. Такой метод позволяет рассмотреть под микроскопом зернистость (хлопья, пыль).
Введение
Синдром токсического шока (СТШ) представляет собой острое полисистемное заболевание, развивающееся на фоне гипоперфузии тканей в результате инфицирования организма штаммами бактерий, способных к продукции высокотоксичных веществ. Клинико-лабораторные признаки СТШ, как правило, включают интоксикацию, кожные проявления в виде скарлатиноподобной сыпи с последующей десквамацией на ладонях и подошвах через 1–2 нед., рвоту, диарею, выраженную гуморальную активность в крови, развитие тканевой гипоперфузии вследствие стойкой артериальной гипотонии, синдром полиорганной недостаточности (СПОН) различной степени выраженности [1, 2]. Наиболее частыми бактериальными патогенами, ассоциированными с СТШ, традиционно являются Staphylococcus aureus
и стрептококки группы А. В настоящее время широкое распространение
S. aureus
, массивная контаминация кожного покрова данным бактериальным агентом, а также устойчивый рост числа мультирезистентных форм позволяют считать
S. aureus
одной из ведущих причин развития бактериальных инфекций у человека, в том числе и таких тяжелых, как СТШ [3].
Синдром токсического шока, связанный с S. aureus
, был впервые описан в серии педиатрических случаев в 1978 г. [4, 5]. Заболеваемость резко возросла в 1980 г.: было зарегистрировано более 800 случаев СТШ, связанных с менструацией, в основном среди молодых женщин европеоидной расы [6, 7]. Клиническое заболевание возникало во время менструации и было связано с использованием абсорбирующих тампонов [5, 8]. Заболеваемость СТШ резко снизилась после отказа от некоторых марок тампонов. В настоящее время стафилококковый СТШ принято делить на менструальный и неменструальный. В то время как доля менструального СТШ продолжает снижаться, частота СТШ, не связанного с менструацией, увеличивается в структуре данной патологии и составляет до 50% случаев [9].
Пусковым моментом развития СТШ является образование S. aureus
специфических супертоксинов (TSST-1, реже — энтеротоксинов В и С). Входными воротами для инфекции при менструальном СТШ может служить слизистая наружных половых органов, при неменструальном СТШ — места повреждения кожи, возможно распространение возбудителя из других очагов стафилококковой инфекции в организме. В клинической практике описаны примеры ожогового, раневого, посттравматического, а также послеродового неменструального СТШ [10–12].
Патогенез развития стафилококкового СТШ обусловлен действием фактора вирулентности S. aureus
— токсина TSST-1, который способен взаимодействовать с CD40-клетками или другими неопределенными рецепторами эпителиальных клеток. В результате такого взаимодействия происходит гиперпродукция провоспалительных хемокинов: IL-8/СХCL8, CCL20, которые рекрутируют нейтрофилы и дендритные клетки. Содействие TSST-1
S. aureus
в процессе активации CD4+ Т-лимфоцитов приводит к продукции широкого спектра цитокинов: IL-1β, IL-2, IL-6, IFN-γ, TNF-α, причем не только местно, но и на системном уровне. Так, было показано, что TSST-1 способствует продукции IL-2 Т-клетками не только в очаге поражения, но и в селезенке [13]. Таким образом, можно сделать вывод, что в ответ на действие TSST-1
S. aureus
первично активируются CD4+ Т-клетки, которые в последующем способствуют усилению секреции IL-6, IFN-γ, TNF-α макрофагами и дендритными клетками. В результате происходит массированный выброс в ткани провоспалительных цитокинов, формирующих системный воспалительный ответ [14]. Бурная реакция со стороны практически всех органов и систем на токсины получила определение «цитокинового шторма». Именно он рассматривается многими исследователями в качестве основной причины возникновения СТШ [15–17].
Как уже было сказано ранее, для развития СТШ необходимы первичный очаг (входные ворота) и условия для распространения токсинов и возбудителей инфекции из очага («факторы прорыва»). Входными воротами могут служить мочевые пути (восходящий пиелонефрит), желчевыводящие пути (холангит, холецистит), брюшина (гнойный перитонит), стенки кишечника (псевдомембранозный энтероколит), трахеобронхиальное дерево (пневмония, абсцессы), кожный покров и подкожная жировая клетчатка (флегмона, ожоговая поверхность кожи, раны кожного покрова и др.), гениталии (септический аборт, хориоамнионит, ретроплацентарная гематома и др.), катетеризация вены (периферической или центральной), особенно при длительном нахождении катетера, трансфузия бактериально загрязненных жидкостей и др. [18]. Однако на современном этапе главными входными воротами для S. aureus
, особенно в педиатрической практике, является кожный покров [19]. Это обусловлено высокой контаминацией кожного покрова данным возбудителем. «Факторы прорыва» (вторичная обработка гнойной раны протеолитическими ферментами, отсутствие первичной хирургической обработки и адекватного ухода за раневой поверхностью и др.) вызывают повреждение биологических барьеров, локализующих инфекцию в первичном очаге.
Клиническая картина СТШ обычно характеризуется выраженной интоксикацией, лихорадкой, прогрессирующей гипотензией, развитием СПОН: клинико-лабораторной картины острого почечного повреждения (олигоанурия, повышение уровня в крови креатинина и мочевины, гемоглобинурия), острого респираторного дистресс-синдрома, развития энцефалопатии (нарушение сознания разной степени выраженности, возможны проявления агрессивности), клиники отека и набухания головного мозга, прогрессирующего ДВС-синдрома. При стафилококковом СТШ прогноз серьезный: летальность колеблется от 3% до 22% [20–22]. Применение высокоэффективных методов этиопатогенетического лечения, включая антибактериальные препараты и инфузионную терапию, позволило снизить летальность и частоту данного состояния, однако значительно снизило настороженность практикующих врачей относительно возможности развития СТШ.
Представляем клиническое наблюдение развития стафилококкового СТШ у пациентки 5 лет.
Клиническое наблюдение
Пациентка В., 5 лет. Анамнез заболевания: известно, что 30.10.2020 битым стеклом был поврежден кожный покров голени. В связи с этим 30.10.2020 осмотрена хирургом: был проведен первичный туалет раны, рекомендованы ежедневные перевязки с антисептическими препаратами. Однако рекомендации хирурга не выполнялись, туалет раны и перевязки не проводились. Началом заболевания считают 04.11.2020, когда появилась рвота до 4 раз, храп во сне, температура тела повысилась до 38,4 °С. К 05.11.2020: максимальное повышение температуры тела до 37,9 °С, жидкий стул трехкратно, появление сыпи и яркой гиперемии вокруг раны. 06.11.2020 температура повысилась до 39,0 °С, отмечалась выраженная слабость, за сутки практически не вставала, аппетит резко снижен, от воды отказывалась. Участковым врачом-педиатром было принято решение о направлении на госпитализацию в стационар бригадой скорой медицинской помощи. В приемный покой ГБУЗ НСО «ДГКБ № 3» девочка была доставлена 06.11.2020.
Объективно при осмотре в приемном покое: частота дыхательных движений 26 в минуту, ЧСС 120 в минуту, АД 85/55 мм рт. ст. Состояние тяжелое. Ребенок вялый, лежит, не встает, к осмотру относится негативно. Лицо одутловато, склеры гиперемированы, инъецированы, губы яркие с выраженной сухостью, покрыты геморрагическими корочками, в углах рта — заеды (рис. 1А). Кожа сухая, по всей поверхности тела визуализируется обильная мелкоточечная сыпь с концентрацией в естественных складках (рис. 1В). В области переднебоковой поверхности правой голени — резаная рана длиной около 4 см, заживающая вторичным натяжением, с образованием геморрагической корочки. Вокруг раны определяется зона яркой гиперемии диаметром около 7 см (рис. 1С). При осмотре зева определяется ярчайшая гиперемия дужки, uvule
с обеих сторон, гипертрофия миндалин 2-й степени с очагами обильного гнойного налета, исходящего из лакун, размерами до 5 мм. Язык яркий, выраженная гипертрофия сосочков языка. Аускультативно определялось жесткое дыхание, хрипы не выслушивались. При исследовании сердечно-сосудистой системы определялся негрубый систолический шум на верхушке. Тоны сердца несколько приглушены. Пульс частый, слабого наполнения. Симптом бледного пятна исчезает за 4 с. Живот при пальпации мягкий, умеренно болезненный в параумбиликальной области. Печень выступает из-под края реберной дуги на 2,5 см, селезенка — на 1,5 см. Диурез снижен, за прошедшие сутки составил 0,8 мл/кг/ч. Моча концентрированная. Лабораторные показатели пациентки В. при поступлении в стационар, а также их динамика представлены в таблице 1.
Указанная клиническая картина требовала проведения дифференциальной диагностики СТШ с генерализованной стрептококковой и иерсиниозной инфекциями (смешанные и генерализованные формы псевдотуберкулеза и кишечного иерсиниоза). Учитывая данные анамнеза и объективного осмотра, тяжесть состояния, проявления инфекционно-токсического шока 1-й степени и данные лабораторных методов исследования, начали интенсивную терапию: антибактериальные препараты цефалоспоринового и аминогликозидового ряда (цефотаксим + амикацин) в возрастных дозировках; массивную инфузионную терапию глюкозо-солевыми растворами в объеме, равном физиологической потребности; однократное введение глюкокортикостероидов в шоковой дозировке. Учитывая признаки гипокоагуляции, в терапию добавили препараты витамина К. Симптоматическая терапия включала местную обработку входных ворот антисептическими веществами, десенсибилизирующую и местную гемостатическую терапию. Осуществляли мониторинг жизненно важных показателей, в том числе АД и сатурацию кислорода. Отмечалось появление симптомов повышенной ломкости сосудов в виде положительных проб щипка, жгута (рис. 2). На фоне интенсивной терапии к 09.11.2020 удалось окончательно купировать гипотонию со стойким достижением целевого возрастного АД, что позволило отказаться от дальнейшей массивной инфузионной терапии. Отмечалось несколько эпизодов носового кровотечения, которые были купированы тампонадой с местными гемостатиками. Клиническое состояние пациентки 09.11.2020 с некоторой положительной динамикой: появился аппетит, выросла толерантность к физической нагрузке. Однако сохранялась лихорадочная реакция в виде периодических подъемов температуры тела до фебрильных цифр, в связи с чем была проведена коррекция антибактериальной терапии с назначением цефалоспорина IV поколения (цефепим). Посев на S. aureus
с раневой поверхности, миндалин (от 07.11.2020), кала (от 08.11.2020) подтвердил стафилококковую этиологию заболевания. Посевы мочи (от 08.11.2020) и крови (от 09.11.2020) роста микрофлоры не выявили. Отрицательный уровень антистрептолизина-О, а также отсутствие нарастания титра в дальнейшем позволили исключить стрептококковую природу инфекционного процесса.
Данные инструментальных методов обследования: УЗИ органов брюшной полости от 11.11.2020 — признаки гепатоспленомегалии и пиелоэктазии на фоне умеренно наполненного мочевого пузыря; ЭхоКГ от 15.11.2020 — без существенных патологических изменений.
К 12.11.2020 на фоне проводимой терапии отмечалась стабилизация состояния. Состояние средней степени тяжести. Лихорадочная реакция купирована. Кожный синдром в динамике претерпел стереотипные изменения: мелкоточечные элементы разрешились, отмечалось формирование средне- и крупнопятнистых элементов, в местах крупных складок сливные эритематозные элементы, с единичными проявлениями эпидермолиза (в паховых складках) (рис. 3). В дистальных отделах конечностей отмечалось необильное отрубевидное шелушение с последующим усилением процесса. На миндалинах сохранялись точечные гнойные налеты, исходящие из лакун. Активность пациентки с выраженным улучшением, встает, ходит по палате. Аппетит восстановлен.
В дальнейшем отмечалась положительная динамика клинических и лабораторных показателей. К 19.11.2020 состояние ребенка расценено как удовлетворительное, наблюдалось полное разрешение клинических проявлений, нормализация лабораторных параметров. Сохранялось выраженное пластинчатое шелушение дистальных отделов конечностей. 20.11.2020 пациентка выписана с рекомендациями на амбулаторный этап, под дальнейшее наблюдение участкового педиатра, с консультацией узких специалистов по показаниям. Заключительный диагноз: Генерализованная бактериальная инфекция, вызванная S. aureus
(посевы на микрофлору из раны, кала, с миндалин — рост
S. aureus
): инфицированная рана правой голени, тонзиллит, гастроэнтерит, гепатит, нефрит. Синдром стафилококкового токсического шока. Острое почечное повреждение I стадии. Анемия легкой степени тяжести.
Симптоматика и последствия
Если нормальные показатели токсической зернистости превышены, человеческий организм на болезненные процессы начинает отвечать определенными сложными реакциями.
Чаще всего выраженная токсическая зернистость нейтрофилов представляет собой симптом развития патологии, при которой наблюдается увеличение количества гранулоцитов в крови. Также это может указывать на сдвиг лейкоцитарной формулы влево.
При росте деградирующих нейтрофилов у пациента начинается развитие бактериемии и происходит генерализация инфекционного процесса. Если же количество нейтрофилов с патологическими изменениями превышает 50 % при септических или гнойных заболеваниях, или данный показатель растет, то прогноз становится неблагоприятным.
У пациента отмечается симптоматика того заболевания, которое стало причиной нарушения – крупозной пневмонии, радиационного отравления и иного. Озноб и токсическая зернистость нейтрофилов часто сопровождают друг друга.
Врач должен принимать во внимание динамику изменений показателей крови пациента, корректировать лечение при необходимости, назначать определенные препараты. Стремительное повышение концентрации нейтрофилов представляет собой не очень хороший знак.
Терапия токсической зернистости напрямую зависит от успешности лечения основной патологии, спровоцировавшей изменения в клетках крови, так как токсигенные изменения – это не более, чем ее последствия. Врачу в данном случае остается лишь наблюдать за лейкоцитарной формулой.
Причины токсигенной зернистости
Уже из названия становится понятно, что зернистость нейтрофилов имеет токсическую причину своего появления. Причем интоксикация в этом случае может быть не только инфекционной природы.
Наиболее частые причины токсической зернистости нейтрофилов:
- Сепсис
- Перитонит
- Обширные гнойные процессы, флегмоны
- Крупозная пневмония
- Казеозная пневмония и другие обширные формы туберкулеза
- Грипп, ОРВИ с тяжелым течением
- Распад опухоли
- Скарлатина
- Флегмона
- Гангренозный аппендицит
- Облучение (лучевая терапия или радиация)
- Химиотерапия
- Отравление
- Тяжелое течение коронавирусной инфекции, в том числе Covid-19 (SARS-CoV-2)
ТЗН при Ковид-19 и гриппе
Токсическая зернистость нейтрофилов для вирусных инфекций менее характерна, чем для бактериальных, что обусловленно несколько иным иммунным ответом.
Но тем не менее, при тяжелом течении таких вирусных заболеваний, как грипп и коронавирусная инфекция, ТЗН в анализе крови встречается довольно часто. Связано это с тем, что из-за снижения иммунитета на фоне тяжелого протекания вирусной инфекции, зачастую присоединяется и бактериальная инфекция в виде пневмонии или генерализованной бактериальной инфекции, что и приводит к появлению токсогенной зернистости.