Апластическая анемия
(АА) или
гипопластическая анемия
(синоним, хотя при ГА костномозговое кроветворение угнетено не столь глубоко) представляет собой такое
патологическое (угнетенное) состояние костного мозга (КМ), когда «он отказывается» воспроизводить клетки всех линий
при отсутствии признаков опухолевого процесса (гемобластоза). Прекращение производства клеток всех ростков в костном мозге – на периферии дает катастрофическое падение численности циркулирующих форменных элементов крови (эритроцитов, лейкоцитов, тромбоцитов), что, естественно, угрожает не только здоровью, но и жизни пациента.
Апластическая анемия – состояние сложное и тяжелое, плохо отзывающееся на лечение, поэтому многие больные умирают в течение нескольких недель. Особенно, это касается идиопатической апластической анемии, которая протекает в острой сверхтяжелой форме
.
Анемия – апластическая и гипопластическая
Апластические анемии чаще всего формируются на каком-то этапе жизни и составляют первую группу данных патологических состояний (приобретенная АА), причем конкретная причина развития болезни называется редко (идиопатическая апластическая анемия), в большинстве случаев она остается только предполагаемой (см. ниже). Вторую группу АА представляет врожденная и наследственная патология, которая также будет описана ниже.
Что касается различий между двумя понятиями «апластическая»
и «
гипопластическая анемия»
, то они все-таки есть, однако, не глядя на это, диагноз в случае «гипо» формулируется как «апластическая анемия».
Суть неполного сходства состоит в том, что эти патологические состояния отличаются:
- Происхождением (АА – ведущим звеном выступает дефект стволовой клетки, ГА – аутоиммунный компонент);
- Степенью поражения гемопоэза (АА – аплазия костного мозга, он ничего не может производить, ГА – гипоплазия, при которой угнетение кроветворения не столь ярко выражено);
- Механизмом развития болезни (патогенозом);
- Эффективностью лечебных мероприятий (правильно подобранная терапия при гипопластической анемии может обеспечивать длительную ремиссию, которую при АА достигнуть очень сложно);
- Прогнозом на будущую жизнь (в случае АА он, конечно, менее обнадеживающий).
Раньше эти два состояния (апластическая и гипопластическая анемия) считали разными стадиями одного процесса,
однако дифференцировать их – дело специалистов, поэтому в дальнейшем описании патологии читатель будет встречать и тот, и другой термин.
Лечение АА сложно и, к сожалению, не всегда успешно. Ведущими направлениями лечебной тактики выступают: пересадка костного мозга и применение иммуносупрессоров
. Но обо всем по порядку…
Классификация патологии
В зависимости от причины возникновения различают следующие виды гипопластической анемии:
- Врожденная. Формируется на фоне генетической мутации ДНК вследствие нарушений внутриутробного развития плода под действием провоцирующих факторов. Аномалии способствует генетическая предрасположенность, когда подобным заболеваниям страдают близкие родственники.
- Приобретенная. Может сформироваться в разном возрасте под действием вредных факторов, вызывающих угнетение кроветворной функции.
По этиологическим признакам существует идеопатическая форма, когда причина развития остается невыясненной, а также миелотоксическая, формирование которой происходит из-за действия токсических веществ.
В зависимости от локализации повреждений в кроветворной системе выделяют:
- Эритроцитопению (угнетение выработки эритроцитов).
- Тромбоцитопению (снижение продукции эритроцитов одновременно с тромбоцитами).
- Панцитопению (дисфункцию всех ростков кроветворения).
Классификация апластических анемий
Болезнь, описанная еще в конце 19 века, не хочет сбавлять обороты, ведь стремительное движение человечества к новым познаниям и изобретениям подталкивает людей к очень тесному контакту с факторами, способными привести к аномальному состоянию стволовой клетки. В итоге – частота заболеваемости только растет, смертность от данной патологии хоть и падает, благодаря развитию трансплантологии и лечению новейшими иммуносупрессивными препаратами, но не в той мере, как хотелось бы.
В настоящее время выделено два типа АА, содержащие по несколько видов, каждый из которых имеет свои подвиды, исходя из причин и клинических проявлений. Следует отметить, что классификация в разных источниках, хоть и не существенно, но отличается, к тому же классификация, используемая для установления диагноза и лечения взрослых, не совсем подходит для детского и подросткового периода (например, у детей часто встречается такая форма, как транзиторная АА – о ней также будет упомянуто ниже).
Итак, выделяют:
а) Приобретенные формы:
- Истинная
АА, которая ≈ в 50% случаев представлена идиопатической апластической анемией (для нее характерно подавление всех линий кроветворения без видимых причин), имеет три формы течения:- острую
, которая продолжается до 2 месяцев и заканчивается 100-процентной гибелью больных; - подострую
(гипо- и апластическая анемия с кратковременной стабилизацией при АА и с чередованием ремиссий и обострений при ГА, длительность болезни от 2 месяцев и дольше); - хроническую
гипо- и апластическую анемию, имеющую относительно спокойное течение, страдания костного мозга и организма больного продолжаются от года до 3 – 5 лет, иногда процесс затягивается до 10 лет и более и в отдельных случаях приводит к выздоровлению. - Парциальная красноклеточная аплазия костного мозга
(ПККА) – анемия аутоиммунного характера, обусловленная воздействием аутоантител на антигены эритрокариоцитов КМ, в результате чего сильно угнетается продукция красных клеток крови. Наиболее часто встречаемая форма – идиопатическая, иногда развитие ПККА обусловлено формированием опухоли вилочковой железы (тимомы). Отдельные авторы напоминают о существовании еще одного вида такой анемии, которая проявляется у детей старшего возраста –
подростковой ПККА
, имеющей благоприятное течение; - Гипопластическая анемия с гемолитическим компонентом
– в отношении этой формы существуют постоянные разногласия, поскольку отдельные авторы утверждают, что данная патология выступает в качестве определенной стадии пароксизмальной ночной гемоглобинурии. Хроническая гипопластическая анемия с гемолитическим компонентом при рецидивах болезни сопровождается
гемолитическими кризами
, что является ее особенностью.
б) Врожденные и наследственные формы:
- Конституциальная анемия Фанкони
(аутосомно-рецессивный тип наследования, проявляется у гомозигот в возрасте 4-10 лет), представлена двумя типами: 1) анемия с грубыми аномалиями развития органов, 2) анемия с малыми (незначительными) дефектами развития; - Анемия Джозефа-Даймонда-Блекфена
(красноклеточная аплазия КМ, тип наследования – не выяснен, предположительно – аутосомно-доминантный, но другие утверждают, что аутосомно-рецессивный), болезнь проявляет себя очень рано, уже к 4 месяцам у 2/3 детей дебютируют первые признаки, у остальной трети они появятся к году. Анемия Даймонда-Блекфена имеет две разновидности: 1) анемия с аномалиями развития органов, 2) анемия без аномалий; - Семейная гипопластическая анемия Эстрена-Дамешека
(семейная гипопластическая анемия у детей, которая характеризуется общим поражением кроветворения при отсутствии дефектов развития).
Поскольку гипопластическая анемия в случае врожденных форм выступает, как один из симптомов основной патологии, к тому же, болезнь становится видимой с раннего детства, нет смысла останавливаться на ней в данной работе. Читателей, скорее всего, больше волнует та форма, которая в течение жизни может настигнуть любого человека, даже если он родился вполне себе здоровым.
Публикации в СМИ
Апластические анемии — группа патологических состояний, характеризующихся панцитопенией в периферической крови вследствие угнетения кроветворной функции костного мозга.
Классификация • Врождённые (анемия Фанкони, Дайемонда–Блекфэна) • Приобретённые (результат воздействия химических, лекарственных, инфекционных агентов и ионизирующего излучения) • Идиопатические (причина заболевания неясна).
Этиология • Приобретённые анемии •• Инфекции (вирусные гепатиты, инфекционный мононуклеоз, ЦМВ, парвовирусная, грипп) •• Лимфопролиферативные нарушения (тимома, лимфома, хронический лимфобластный лейкоз) •• Ионизирующее излучение •• Токсины и химические вещества (бензол, инсектициды, соединения свинца и пр.) •• ЛС, например цитостатики, препараты золота, НПВС, противосудорожные препараты, антибиотики • Врождённые анемии (анемия Фанкони). Существует 4 группы комплементации, т.е. не менее 4 генов, мутация любого из которых ведёт к развитию апластической панцитопении 4 типов (все r) •• Группа А (тип 1 анемии Фанкони, *227650, 20q13.2–q13.3, дефекты генов FA1, FA, F, r) •• Группа В (тип 2, *227660, дефект гена FA2, r) •• Группа С (тип 3, *227645, 9q22.3, дефект гена FACC, r) •• Группа D (тип 4, *227646, дефект гена FA4, r).
Патогенез апластических анемий • Внутренний дефект гемопоэтических стволовых клеток • Иммунная реакция на гемопоэтическую ткань • Нарушение поддерживающей функции стромального окружения в костном мозге
Клиническая картина
• Характерные черты апластических анемий •• Общие признаки (одышка, бледность кожных покровов и слизистых оболочек, тахикардия, слабость, систолический шум на верхушке сердца, снижение массы тела) •• Частое присоединение инфекционно-воспалительных и гнойно-некротических процессов различной локализации вследствие лейкопении (нейтропении) •• Геморрагический синдром: крупные и мелкие кровоизлияния (в т.ч. в сетчатку глаза), кровотечения различной локализации (меноррагия, мелена, носовые кровотечения), обусловленные тромбоцитопенией. Особенности у детей • Преобладающий возраст — 14–16 лет • Анемии обычно предшествует перенесённое инфекционное заболевание (ветряная оспа, краснуха, вирусные гепатиты) • Заболевание развивается очень быстро • В 70% случаев при лечении циклоспорином удаётся достичь полной клинико-гематологической ремиссии.
• Анемия Фанкони. Существует 2 типа •• Классический (тип I) ••• Низкий рост ••• Микроцефалия ••• Деформации скелета (отсутствие или гипоплазия первой пястной или лучевой кости) ••• Аномалии почек и сердца ••• Гипоспадия ••• Гиперпигментация кожи ••• Глухота •• Тип 2 характеризуется наличием малых аномалий развития.
• Врождённая апластическая анемия (синдром Дайемонда–Блекфэна) — аллельный вариант анемии Фанкони (*205900, r). От анемии Фанкони её отличают раннее появление анемии (как правило, в первые месяцы жизни), отсутствие нейтропении и тромбоцитопении.
По тяжести различают нетяжёлую (гранулоциты меньше 1,5´109/л, тромбоциты 100´109/л, мегакариоциты меньше 80´109/л) и тяжёлую (в периферической крови гранулоциты менее 0,5´109/л, тромбоциты менее 20´109/л; в костной ткани преобладание фиброзной ткани более чем на 60%) формы.
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ
• Приобретённая анемия •• Панцитопения •• Нормохромные эритроциты •• Удлинённое время кровотечения •• Выраженное снижение содержания ретикулоцитов (арегенераторная анемия) •• Повышение концентрации железа в сыворотке крови (вследствие гемотрансфузий) •• Нормальные показатели общей железосвязывающей способности сыворотки (ОЖСС) •• Концентрация эритропоэтина сыворотки обычно увеличена пропорционально степени анемии •• Нарушение показателей функций печени.
• Анемия Фанкони •• Макроцитоз (в отличие от приобретённой апластической анемии) •• Повышение содержания HbF •• Отсутствие выраженной панцитопении до 3–8-летнего возраста •• Характерны ломкость хромосом, дефекты репарации, повышенная чувствительность хромосом к диэпоксибутану, митомицину и УФО.
• Анемия Дайемонда–Блекфэна: макроцитоз, ретикулоцитопения, повышенное содержание HbF.
Пункция костного мозга • Увеличенные запасы железа • Уменьшено количество клеток •• Уменьшение количества мегакариоцитов •• Уменьшение количества миелоцитов •• Уменьшение количества эритроидных предшественников •• Замещение нормальной кроветворной ткани на жировую и фиброзную • Анемия Фанкони — при пункции костного мозга часто не обнаруживают изменений.
Инструментальные исследования • КТ области тимуса при подозрении на тимому • Рентгенологическое исследование костей предплечья (возможно обнаружение аномалий развития лучевой кости) и больших пальцев кистей (конституциональная анемия) • УЗИ почек.
Дифференциальная диагностика • Транзиторная эритробластопения у детей • Миелодиспластический синдром • Пароксизмальная ночная гемоглобинурия • Острый лейкоз • Волосатоклеточный лейкоз • СКВ • Диссеминированная инфекция • Гиперспленизм • Анемии при гипотиреозе, гипопитуитаризме и заболеваниях печени.
ЛЕЧЕНИЕ
Тактика ведения • Стационарное лечение в гематологическом отделении. При нейтропении показана изоляция для предупреждения возможного инфицирования • Исключение причинных факторов • Исследование Аг системы HLA больных и членов их семей.
Трансплантация костного мозга пациентам с выраженной апластической анемией, особенно в возрасте до 30 лет — метод выбора (при наличии HLA-идентичного донора) • Трансплантация от неродственных доноров в случае неэффективности проводимого лечения.
Консервативное лечение
• Проводят при отсутствии донора для трансплантации костного мозга •• Глобулин антитимоцитарный. Для выявления повышенной чувствительности сначала необходимо проведение кожной пробы ••• Препарат выбора для лечения пациентов пожилого возраста или при отсутствии донора для трансплантации костного мозга ••• Курсовая доза 160 мг/кг, разделённая на 4 дозы, в течение первых 4 дней лечения ••• Необходимую дозу препарата растворяют в 500 мл 0,9% р-ра натрия хлорида и вводят в/в капельно в течение 4–6 ч ••• Развитие анафилактической реакции — абсолютное противопоказание к дальнейшему введению препарата •• Циклоспорин ••• Начальная доза — 5 мг/кг/сут внутрь или 3 мг/кг в/в. Далее дозы подбирают, исходя из концентрации циклоспорина в крови, определяемой ежедневно ••• При отсутствии эффекта в течение 120 дней препарат отменяют •• Метилпреднизолон — по 2 мг/кг/сут в/в с 1 по 14 день лечения, по 1 мг/кг — с 15 по 21 день •• Гранулоцитарный колониестимулирующий фактор (например, молграмостим) — при неэффективности тимоглобулина или циклоспорина ••• Начальная доза — 5 мкг/кг/сут п/к до увеличения количества гранулоцитов более 1 000/мкл ••• При отсутствии эффекта в течение 14 дней дозу удваивают •• Андрогены эффективны при некоторых вариантах анемии Фанкони, приобретённой апластической анемии, хотя случаи успешного лечения крайне редки. При отсутствии эффекта в течение 4–6 мес препарат отменяют постепенно.
• Поддерживающая терапия •• Оксигенотерапия •• Санация полости рта и других слизистых оболочек •• Переливание отмытых эритроцитов через лейкоцитарные фильтры; тромбоцитарной массы •• Антибактериальная терапия •• Гемостатики
• Осложнения терапии • Геморрагический синдром • Инфекционные осложнения • Гемосидероз при переливании крови • Сердечная недостаточность • Почечная недостаточность • Токсический гепатит • Анафилактический шок и сывороточная болезнь (при использовании антитимоцитарного глобулина) • Развитие острого лейкоза.
Оперативное лечение • Тимэктомия при тимоме.
Исходы лечения • Полная клинико-гематологическая ремиссия: концентрация Hb выше 110 г/л, тромбоцитов более 100´109/л, гранулоцитов более 1,5´109/л • Частичная клинико-гематологическая ремиссия: концентрация Hb 90–110 г/л, тромбоцитов 30–100´109/л, гранулоцитов 0,5–1,5´109/л • Минимальный гематологический ответ: уровень Hb 80–90 г/л, тромбоцитов более 10–30´109/л (без проведения трансфузий).
Течение и прогноз • Приобретённая анемия. Течение и прогноз прямо пропорциональны возрасту больного. При отсутствии своевременной и адекватной терапии 80% пациентов погибают в течение 3 мес от манифестации заболевания. С внедрением в клиническую практику циклоспорина шансы на продление жизни больного увеличились. При предполагаемой трансплантации костного мозга во избежание сенсибилизации в предоперационный период желательно избегать переливаний препаратов крови (в особенности от родственников) • Анемия Фанкони. Выживаемость не превышает 4 лет при изолированной заместительной терапии. Прогноз значительно благоприятнее при эффективности андрогенов или трансплантации костного мозга.
Синонимы: Для анемии Фанкони — синдром Фанкони.
МКБ-10 • D60 Приобретённая чистая красноклеточная аплазия [эритробластопения] • D61 Другие апластические анемии
Примечания • Аплазия костного мозга — врождённое или приобретённое тяжёлое состояние, проявляющееся панцитопенией. Врождённая форма сочетается с фенотипическими и цитогенетическими аномалиями, что облегчает диагностику • Панцитопения — снижение количества эритроцитов, лейкоцитов и тромбоцитов. Характерны бледность и сонливость, инфекции, обусловленные нейтропенией; геморрагический диатез вследствие тромбоцитопении. Для дифференциальной диагностики необходимо исследование костного мозга (аплазия [чаще гипоплазия] костного мозга, вытеснение ростков костного мозга бластными клетками, аутоиммунное разрушение клеток крови — синдром Эванса) • Конституциональными называют врождённые и иногда идиопатические типы анемий.
Приобретенная АА
Приобретенная апластическая анемия – такое состояние кроветворного органа, которое взялось как бы ниоткуда: семейный анамнез ничего плохого не предполагал, среди близких (да и дальних тоже) родственников больных нет, каких-то врожденных дефектов и аномалий у пациента не отмечается. Но в главном органе кроветворной системы производство клеток всех линий, циркулирующих в кровеносном русле и обеспечивающих нормальную жизнедеятельность организма, почему-то приостановилось. Возникшая в процессе жизни апластическая анемия, может быть представлена 4 видами:
- Идиопатическая апластическая анемия (причинные факторы, пусть при самом детальном обследовании, обозначить не представляется возможным) – составляет более 50% всех АА (по данным разных источников – от 50 до 80%);
- Вирусная АА (парвовирус В19, вирус Эпштейн-Барра, гепатитов);
- Аутоиммунная АА – болезнь обусловлена влиянием на кроветворные клетки аутоагрессивных (аутологичных) антител (аутоантитела – АТ, способные реагировать на собственные антигены);
- Транзиторная (временная) гипопластическая анемия – чаще всего отмечается у детей, дифференцируется с врожденной ГА и среди других костномозговых аплазий (у детей) занимает лидирующее положение, причина – временное (транзиторное) угнетение кроветворения в костном мозге, но на выздоровление при адекватном лечении можно рассчитывать через 1-2 месяца.
Для приобретенных АА также обозначены три формы течения с характерными для каждой из них четкими клинико-гематологическими особенностями:
- Сверхтяжелая форма (как правило, это острая апластическая анемия, которая развивается стремительно и дает практически 100% летальность);
- Тяжелая;
- Легкая форма, если можно так назвать, скорее, нетяжелая
, что несколько меняет смысл, подразумевая удовлетворительное состояние кроветворения и самочувствие пациента.
Приобретенные аномалии стволовых клеток, дающих жизнь всему сообществу форменных элементов, могут возникать по разным причинам, основные из которых будет нелишним рассмотреть.
Причины развития
Гипопластическая анемия может быть обусловлена негативным действием различных факторов, их совокупность способствует не только развитию болезни, но и приводит к усугублению течения патологического процесса.
Очень часто данный вид анемии возникает вследствие токсического действия некоторых медикаментов, способных спровоцировать нарушения в костном мозге с дальнейшей дисфункцией ростков кроветворения. Ее формирование не зависит от дозировки медикаментов и от длительности терапевтического курса.
К препаратам, способным вызвать нарушения в системе кроветворения, относят:
- сульфаниламиды,
- антибиотики,
- антигистаминные,
- тетрациклины.
Очень часто недуг определяют у лиц, длительно принимающих Левомицетин
Нарушение гемопоэза наблюдается после курса химиотерапии, так как токсическое действие препаратов разрушает не только патологические образования, но и здоровые клетки и ткани.
Причинами расстройства кроветворной функции также являются аутоиммунные болезни, при которых иммунный механизм направлен на угнетение не только патогенных микроорганизмов, но и на собственное повреждение элементов костного мозга.
Таким образом, различают три группы основных причин, вызывающих нарушение кроветворной функции костного мозга:
- Наследственная. Передача генетически модифицированных генов, проявляющаяся хромосомными аномалиями.
- Основная. Токсическое воздействие химиопрепаратов, радиационное излучение, отравление мышьяком и бензолом.
- Редкая. Формируется на фоне приема некоторых медикаментов, при инфицировании грибком.
Факторы, провоцирующие развитие заболевания:
- гепатит вирусного происхождения;
- вирус герпеса;
- цитомегаловирусная инфекция;
- ВИЧ-инфекция.
Ионизирующее излучение, применяющееся в ходе рентгенологического исследования, играет важную роль в механизме формирования анемии. Чаще всего данная патология встречается у работников рентгенологических кабинетов, а также у пациентов, прошедших курс радиоволновой терапии.
Причинные факторы
Приобретенную форму апластической и гипопластической анемии считают полифакторной (полиэтиологичной) болезнью, вызванной многими причинами (экзогенными и эндогенными факторами
). Это значит, что она могла возникнуть в силу любых обстоятельств, которые оказались для костного мозга неблагоприятными.
Экзогенные факторы:
- Любой инфекционный агент, начиная с детских инфекций и заканчивая теми, которые постоянно живут в человеке или окружают его даже от случая к случаю. Возбудители кори и краснухи, ветрянки, туберкулеза, скарлатины, эпидемического паротита, называемого в народе «свинкой», стафилококковая инфекция, вирус Эпштейн-Барра, гепатита, гриппа, герпеса, который носит около 90% населения земного шара, цитомегаловирус, парвовирус В19 – все эти инфекции являются потенциальными провокаторами запуска патологического процесса в костном мозге;
- Вакцинация, воздействие аллергенов и токсинов, случайно попавших в организм;
- Медикаментозные средства периодически или постоянно принимаемые пациентом для лечения хронических заболеваний (препараты золота, многие антибиотики, ненаркотические обезболивающие, в том числе, производные ацетилсалициловой кислоты, противотуберкулезные средства психотропные и успокаивающие лекарства, противоопухолевые препараты – цитостатики и многие другие);
- Химические вещества, используемые в производстве, сельском хозяйстве и выделяемые транспортом (легкие (бензин) и ароматические (бензол) углеводороды, инсекти- и пестициды, пары ртути и азотной кислоты, свинец и пр.);
- Ионизирующее излучение, которое нарушает пролиферацию и созревание клеток в КМ причем, частота заболеваемости коррелирует с полученной дозой облучения;
- В иных случаях – постоянная работа с вибрирующими приборами, в зоне высоких частот и при искусственном освещении;
- Тяжелые физические травмы (особенно, ЧМТ);
- Психотравмирующие ситуации (постоянные, характеризуемые как хронический стресс).
Эндогенные причины:
- Нарушение функции отдельных эндокринных желез («щитовидки», яичников, тимуса);
- Иммунопатологические процессы, затрагивающие соединительную ткань (системная красная волчанка – СКВ, синдром Шегрена, ревматоидный артрит);
- Иногда – беременность (правда, после родов обычно признаки болезни исчезают).
Кроме этого, уже имеются сведения о формировании костномозговой аплазии при грибковых поражениях и глистных инвазиях.
Основой патогенеза служат повреждения самой стволовой клетки (анатомические или функциональные, наследственные либо полученные под воздействием экзо- или эндогенных факторов), нарушения кроветворных ростовых факторов, аномалии стромального микроокружения, которые не позволяет клетке нормально жить и функционировать.
Причины
К экзогенным факторам, которые способны спровоцировать развитие заболевания, относят:
- Перенесенные человеком инфекции. Причем речь не идет о какой-либо конкретной болезни. Опасность представляют все инфекции, которые перенес человек, начиная с раннего детства. Сюда относятся: ветрянка, корь, краснуха, туберкулез, грипп, паротит, гепатит, герпес, парвовирус В19, цитомегаловирус, вирус Эпштейн-Барра и многие другие. Каждое заболевание может спровоцировать развитие апластической анемии.
- Постановка профилактических прививок.
- Воздействие на организм отравляющих веществ и аллергенов, которые попали в него из внешней среды.
- Препараты, которые человек принимает на постоянной основе, либо время от времени. Сюда относят: антибиотики, лекарственные средства на основе золота, препараты, содержащие ацетилсалициловую кислоту, лекарственные средства для лечения туберкулеза, анальгетики, цитостатики и пр.
- Воздействие на организм токсических химических веществ. Причем оказано патологическое влияние может быть в повседневной жизни. Опасность представляют такие вещества, как: бензин, бензол, пестициды, пары ртути, свинец, углеводороды и пр.
- Облучение ионизирующей радиацией может спровоцировать угнетение костного мозга.
- Трудовая деятельность в условиях повышенной вибрации, при искусственном освещении, в условиях воздействия высоких частот.
- Полученные травмы. Особую опасность представляют черепно-мозговые травмы.
- Частые стрессы и хроническое нервное перенапряжение.
Также спровоцировать развитие апластической анемии могут эндогенные факторы, среди которых:
- Заболевания щитовидной железы, яичников и тимуса.
- Системные заболевания соединительной ткани: системная красная волчанка, синдром Шегрена, ревматоидный артрит.
- Период вынашивания ребенка. Чаще всего симптомы заболевания будут купированы после его рождения.
Есть данные, что к развитию апластической анемии могут приводить паразитарные инвазии и микотические инфекции.
При апластической анемии повреждаются стволовые клетки, нарушаются ростовые факторы, страдает строма клеток костного мозга, что приводит к тому, что его корректная работа становится невозможной.
Симптомы
Угнетение костномозгового кроветворения, безусловно, изменит положение на периферии. Анализ крови будет показывать панцитопению (резкое снижение всех популяций форменных элементов), что, несомненно, рано или поздно скажется на самочувствии пациента. Идиопатическая апластическая анемия иной раз протекает в острой форме: болезнь начинается внезапно, стремительно прогрессирует и на лечение практически не реагирует. Но все же чаще она приходит мало-помалу, потихоньку меняя картину крови. Пациент долгое время ничего не замечает, поскольку процесс идет плавно, адаптируется к снижению клеток крови. Но до поры до времени, ведь когда-то наступает критический момент, заставляющий обратиться за помощью.
Когда панцитопения достигает большой глубины, оставшееся количество форменных элементов, которое еще продолжает циркулировать в крови, не может справляться с задачами нормального сообщества, депрессия гемопоэза начинает проявлять себя симптомами:
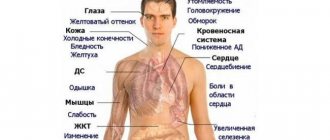
- Анемии, которая обусловлена не только нарушениями образования красных кровяных телец, но и кровотечениями, возникающими на почве уменьшения кровяных пластинок – тромбоцитов. Анемия проявляется гипоксией, бледностью кожи, головной болью, головокружением, одышкой, общей слабостью и недомоганием, воспалительными реакциями со стороны слизистых полости рта;
- Тромбоцитопении с клиническими признаками геморрагического синдрома (кожные высыпания, кровотечения из десен, носа, полости матки);
- Снижение клеток белой крови – нейтрофильных лейкоцитов, которое делает организм неспособным противостоять инфекциям. Нейтропения может быть достаточно тяжелой и стать причиной различных воспалительных заболеваний (отит, пневмония, нагноение гематом, сепсис и другие инфекционные осложнения, сопровождаемые лихорадкой);
- Нарушение сердечной деятельности при анемии проявит себя систолическим шумом, который врач отметит при аускультации;
- Сопутствующий гемолиз – он возникает у части больных (гипопластическая анемия с гемолитическим компонентом) вследствие ранней гибели эритроцитов, что свидетельствует не только о количественных аномалиях красных клеток на периферии, но и указывает на их качественные дефекты (причина гемолиза – особый синдром комбинации АА и пароксизмальной ночной гемоглобинурии – ПНГ). За счет повышения билирубина в крови, кожа пациента приобретает желтушный оттенок;
- признаки начальной стадии АА
Изменение размеров селезенки и печени на первых этапах незаметно, однако это происходит несколько позже, например, массивные трансфузии эритроцитарной массы вызовут гемосидероз и спленомегалию, а недостаточность кровообращения отразится на печени (она увеличится).
Острая анемия – это обычно приобретенный вариант болезни. Следует заметить, что острая сверхтяжелая форма быстро прогрессирует, бороться с ней трудно, в течение нескольких недель, не глядя на принятые интенсивные меры, больной погибает. Сверхтяжелая анемия нередко (в 10 раз чаще, чем у остальных) развивается у людей, которые лечились хлорамфениколом, известным под названием – левомицетин.
При врожденных и наследственных формах болезнь имеет преимущественно хроническое течение.
Хроническая анемия продолжается длительно – то затихая, то обостряясь, оставляя больному шансы на жизнь, поскольку все же иной раз приводит к полному избавлению от недуга, то есть, выздоровлению.
Патогенез заболевания
Апластическая анемия вызвана подавлением процесса производства кровяных телец в костном мозге. Возможен повышенный уровень разрушения и уничтожения клеток собственными антигенами. Изучается механизм апоптоза (самопроизвольного уничтожающего процесса эритроцитов). Его приравнивают к «запрограммированному суициду».
- Установлена повышенная активность ферментов деструктивного действия в крови, дефицит нуклеиновых кислот. Разрушение эритроцитов наблюдается внутри костного мозга на всех уровнях созревания. Снижается продолжительность жизни красных кровяных клеток. Поскольку утилизация железа нарушается, излишки откладываются в печени и селезенке. Образуется повышение уровня гормона эритропоэтина, но костный мозг не реагирует на его приказы.
- Со снижением гранулоцитов блокируется их функция по участию в иммунной защите организма. Соответственное проявление сниженной свертываемости происходит из-за тромбоцитопенического синдрома.
Количество лимфоцитов увеличено. Костный мозг становится «пустым» (панмиелофтиз). Выраженный недостаток кислорода в тканях вызывает дистрофические изменения во внутренних органах. Особенно страдают эндокринные железы.
Лечение
Лечение разных типов анемий, в принципе, не особо отличается. Однако, коль существует подозрение в отношении лекарственных средств и токсических агентов, то первым шагом терапии будет исключение всякого контакта с названными факторами. В противном случае – после дебюта аплазии последует второй приступ и тогда, по причине развития анафилактического шока, спасти пациента, скорее всего, не получится.
Хотя первые успехи терапии андрогенами и кортикостероидами при апластической анемии очень впечатляли и шли как самостоятельное лечение, сейчас эти группы препаратов в подобном ракурсе не рассматриваются. Клиницисты все больше склоняются к лечению андрогенами (оксиметалон) и кортикостероидами (преднизолон) в комплексе с таким иммуносупрессорами, как циклоспорин-А и АЛГ (антилимфоцитарный глобулин).
Удаление селезенки в течение длительного времени тоже воспринималось как один из главных способов регуляции костномозгового кроветворения при АА. Сейчас на этот счет сформировались другие взгляды: спленэктомия хоть и имеет место быть, но уже выступает в качестве вспомогательного лечения (показания к операции: глубокая, не поддающаяся терапии, тромбоцитопения, геморрагический синдром, необходимость частых трансфузий тромбомассы).
Терапия гемопоэтинами (интерлейкины – ИЛ, колониестимулирующие факторы – КСФ), необходимыми для размножения и дифференцировки кроветворных клеток, тоже как-то проблему не решила. Применение КСФ дает временное повышение элементов лейкоцитарного звена, но, в целом, не изменяет само течение патологического процесса.
Трансплантация костного мозга при апластической анемии, имеющей тяжелую форму течения, остается методом выбора.
Кроме этого, она сопряжена с определенными трудностями до и после пересадки: подбор идентичного донора по системе гистосовместимости HLA (до) и возникновение иммунологических реакций, когда организм больного не принимает чужой КМ или костный мозг «не желает знать» нового хозяина (после).
Механизм развития
Механизм развития гипопластической анемии связан с действием провоцирующих факторов на систему кроветворения. Патологические изменения приводят к замедлению процесса размножения форменных элементов до их полного исчезновения.
Прогрессирование патологического процесса приводит к замещению тканей костного мозга жировыми клетками
При данном типе анемии наблюдается нарушение обмена железа в результате усиленного разрушения эритроцитов и изменения порфиринового обмена. Далее происходит снижение утилизации железа и его отложение в тканях и органах, что приводит к возникновению вторичного гемохроматоза.
В формировании недуга выделяют несколько механизмов:
- поражение стволовых клеток костного мозга;
- нарушение клеточного и гуморального механизма;
- дисфункция элементов стромы костного мозга;
- недостаток факторов, стимулирующих процесс кроветворения.
Кроме этого, механизм возникновения патологии может быть связан с образованием антител, действующих на выработку форменных элементов крови в костном мозге.
Чтобы в отношении диагноза не было вопросов
Панцитопения, обнаруженная при микроскопическом исследовании мазка (общеклинический анализ крови), дает основания заподозрить апластическую анемию и предполагает комплекс мероприятий, позволяющих установить диагноз:
- Повторный анализ крови с подсчетом тромбоцитов и ретикулоцитов;
- Биохимический анализ крови (БАК);
- Пункцию костного мозга для последующей оценки состояния всех ростков кроветворения;
- Трепанобиопсию, которая позволяет выделить 2 варианта: присутствие небольших очагов, осуществляющих гемопоэз или же – жировое перерождение кроветворных клеток с образованием инфильтратов воспалительного характера.
гистологическая картина трепанбиопсии костного мозга в норме и при апластической анемии
Возможно, диагностические мероприятия на этом не закончатся и для уточнения предварительного диагноза потребуются дополнительные тесты:
- Цитогенетический анализ КМ и лимфоцитов, циркулирующих на периферии, – для выявления хромосомных аберраций, если они есть;
- Ультразвуковое исследование (УЗИ) печени, селезенки, вилочковой железы (у детей, поскольку у взрослых она уже завершила свою деятельность), лимфатических узлов;
- Определение наличия вирусов в организме (Эпштейн-Барр, цитомегаловирус, маркеры гепатитов, ВИЧ, ВПГ и др.);
- Компьютерная томография – КТ (проводится с целью исключить вторичную гипоплазию КМ)
- Иммунологическое исследование (определение состояния иммунитета на клеточном и гуморальном уровнях);
- Типирование антигенов HLA II класса (ПЦР), если предполагается пересадка костного мозга.
Разумеется, перед тем как приступить к обследованию, врач тщательно собирает и изучает семейную историю, анамнез жизни и болезни пациента. Диагностические мероприятия, предусматривающие использование инструментальных методов (пункция КМ), а также проведение операций после установления диагноза (спленэктомия, пересадка костного мозга) требуют письменного согласия больного или его родителей (если подобные процедуры осуществляются у детей).
Видео: лекция о лечении апластической анемии у детей
{banner_banstat9}
Общая характеристика недуга
Гипопластические анемии характеризуются дисфункцией костного мозга, в результате чего нарушаются процессы его самовосстановления, что приводит к повреждению ростков кроветворения. Сниженное содержание тромбоцитов, лейкоцитов, эритроцитов сопровождается нарушением их созревания на различных этапах формирования.
Заболеванию подвержены лица молодого возраста, преимущественно женщины и подростки
Характерным признаком патологии является полное истощение костного мозга на последних стадиях, а также выраженное нарушение его функций.
Симптоматика проявляется выраженной анемией, тромбоцитопенией, лейкопенией. При отсутствии лечения патология быстро прогрессирует, что может привести к летальному исходу.
И еще пару слов о прогнозе…
{banner_banstat10}
Хоть прогноза апластической анемии вскользь и касались в ходе описания болезни, но хотелось бы добавить еще несколько слов.
Главной причиной смерти больных при АА являются инфекции и кровотечения. Некоторые авторы считают, что весьма нехорошими прогностическими признаками являются: прием левомицетина (пусть и короткими курсами) и развитие болезни после инфекционного гепатита (тяжелая костномозговая аплазия рассматривается, как показание к пересадке КМ в самом начале болезни).
Однако не стоит сразу отчаиваться и воспринимать АА как смертельный приговор.
Использование современных методов лечения, в целом, улучшает ситуацию и позволяют многим пациентам заметно увеличить продолжительность жизни, а то и вообще избавиться от тяжелого заболевания.
Более половины больных АА после применения иммуносупрессивных препаратов живут 10 лет и дольше. Шансы заметно возрастают у людей (их до 75%), которым был успешно пересажен донорский костный мозг.
А вообще, прогноз строится в первую очередь, исходя из формы заболевания.
Например, идиопатическая АА, если она
не
протекает в острой сверхтяжелой форме, дает больше надежд на многолетнюю выживаемость или выздоровление. Но прогнозировать что-то наперед может только лечащий врач (да и то с большой осторожностью), наша задача лишь дать общие сведения о таком патологическом состоянии, как апластическая анемия.
Классификация
Кроме различных этиологических вариантов апластической анемии (лекарственного, постгепатитного, идиопатического), различают острую (до 1 мес. течения), подострую (от 1 до 6 мес.) и хроническую (более 6 мес.) форму заболевания. На основании выраженности тромбо- и гранулоцитопении апластическая анемия подразделяется на 3 степени тяжести:
- очень тяжелую (тромбоцитов менее 20,0х109/л; гранулоцитов менее 0,2х109/л)
- тяжелую (тромбоцитов менее 20,0х109/л; гранулоцитов менее 0,5х109/л), по данным трепанобиопсии – низкая клеточность костного мозга (менее 30% от нормы)
- умеренную (тромбоцитов более 20,0х109/л; гранулоцитов более 0,5х109/л)
Апластическую анемию, протекающую с избирательным угнетением эритропоэза, называют парциальной красноклеточной аплазией.
Возможные осложнения
При апластической анемии возможны следующие последствия:
- различные кровотечения – геморрагические осложнения. Самое опасное осложнение – геморрагический инсульт (определенный участок головного мозга пропитывается кровью, в результате чего гибнет);
- анемическая кома – отсутствие реакции на происходящее из-за утраты сознания, возникающее в результате поступления недостаточного количества кислорода к головному мозгу, что вызвано значительным снижением количества эритроцитов;
- при наличии хронических заболеваний ухудшается состояние внутренних органов.
- осложнения инфекционного характера – развитие заболеваний, которые вызваны различными микроорганизмами (бактерии, грибы, вирусы);
Если при данном заболевании не проводится лечение, в 90% случаев пациент умирает в течение года.