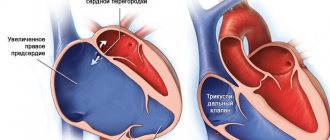
Инфаркт миокарда
— это острая форма ишемической болезни сердца. Суть патологии заключается в резком нарушении кровоснабжения тканей сердца и возникновении участка некроза. Современные методики позволяют своевременно реагировать на болезнь, есть эндоваскулярные и медикаментозные методы восстановления кровотока. Остается открытым вопрос своевременной постановки диагноза — ведь именно от этого зависит начало эффективных лечебных мер. Для того, чтобы определить наличие инфаркта, используется ряд методик, включая оценку клинической картины, инструментальные и лабораторные методы.
Клиническая картина патологии
Симптомы инфаркта могут быть разнообразными. Первый и главный признак — давящая боль за грудиной, которая имеет сжимающий характер, нередко пациент отмечают, что она жгучая и очень интенсивная. Боль возникает на высоте эмоционального напряжения или физической нагрузки. Её резкое возникновение приводит к общей слабости, перебоям в дыхании.
Кроме боли могут наблюдаться следующие симптомы:
- тошнота;
- потеря сознания;
- слабость;
- повышенная потливость;
- бледность.
Боль, как правило, локализуется за грудиной, но может иррадиировать в левую руку, плечо, межлопаточную область, челюсть, верхнюю часть живота. Это зависит от локализации некроза.
Различают клинические формы инфаркта:
- астматическая
У пациента наблюдается сухой кашель, одышка, боль в груди.
- абдоминальная
Боль размещена в верхней части живота, наблюдается сильная тошнота.
- аритмическая
Наблюдается сбой сердечного ритма, слабость, кратковременная потеря сознания.
церебральная
У пациента появляются жалобы на выраженную головную боль.
Есть бессимптомные формы инфаркта, они наблюдаются при сахарном диабете, а также у пациентов, которые злоупотребляют алкоголем. В таком случае может наблюдаться общая слабость и нарушения сознания, но нет типичной боли, которая характерна для инфаркта.
Результаты исследования
При оценке клинико-анатомических особенностей пациентов, поступивших в региональный сосудистый центр (табл. 1), было выявлено, что в целом портрет пациента с ИМ в Югре соответствовал таковому, полученному в общероссийском регистре РЕКОРД-3, описанному в ранее опубликованных работах [10], и характеризуется высоким сердечно-сосудистым риском.
Большинство пациентов с ИМ имели при поступлении ОКС с подъемом сегмента ST [n=79 (97,5%)]. Острая сердечная недостаточность Killip II–III при поступлении регистрировалась у 10 (12,3%) пациентов.
Коронарография при поступлении выполнена всем пациентам. По ее результатам 60,5% больных (n=49) проведено стентирование инфарктзависимой артерии стентами с лекарственным покрытием. У остальных больных технической возможности выполнения эндоваскулярного вмешательства не было. Догоспитальная тромболитическая терапия и экстренное коронарное шунтирование были выполнены 1 (1,2%) пациенту.
Несмотря на то, что большинство пациентов в обследованной группе имели ИМ на фоне ОКС с подъемом сегмента ST, согласно оценке по шкале GRACE больные характеризовались низким и умеренным риском госпитальной летальности (средний показатель 100,6+25,0 баллов). Геморрагический риск по шкале CRUSADE соответствовал уровню в 16,1+11,6 балла (очень низкий риск крупного кровотечения во время госпитализации в стационаре). Формально согласно стандартным шкалам пациенты с ИМ имели незначительный риск развития конечных точек исследования.
В стационаре пациенты получали стандартную коронароактивную терапию (табл. 2). Почти всем пациентам назначена двойная антитромбоцитарная терапия.
В течение госпитального периода лечения ИМ у пациентов, несмотря на суммарно низкий риск, достаточно часто развивались конечные точки. Значимые конечные точки за период наблюдения выглядели следующим образом (табл. 3).
Все летальные исходы (n=11, 13,6%) являлись результатом текущего ИМ (сердечно-сосудистая смерть), осложнившегося кардиогенным шоком, жизнеугрожающими нарушениями ритма с неэффективной реанимацией. Обращает на себя внимание достаточно высокий уровень госпитальной летальности у пациентов с ИМ, несмотря на исходно невысокий расчетный риск ее развития. Такой уровень соответствует данным регистра РЕКОРД-3 [10], где ранние госпитальные летальные исходы лишь в 39% (839 случаях) ассоциировались с GRACE более 140 баллов. Аналогичные данные были получены и в Кемеровском регистре ОКС за 2015 г., который также продемонстрировал развитие госпитальной летальности только в 24,9% (у 62 человек) из группы высокого риска осложнений [11].
Медианы и интерквартильный интервал всех и изучаемых на 1-е сут биомаркеров представлены ниже (табл. 4), они для ряда показателей были выше норм, указанных производителями наборов. В большинстве случаев результаты были сопоставимы среди умерших и выживших в течение госпитального периода пациентов. Однако в группе умерших при поступлении с ИМ регистрировались достоверно меньшие средние значения hsТnT и значимо более высокие значения NTPBNP.
Дополнительно проведена стратификация пациентов в обеих группах с уровнями биомаркеров выше референсных значений в оцениваемых точках в разные сроки от начала ИМ. Согласно полученным данным (табл. 5), на 1, 2–3 и 7-е сут после ИМ регистрировалось сопоставимое количество диагностически значимых повышений следующих биомаркеров: MG, NTPBNP, hsCRB, MPO, ЭТ-1, sCD40L в группе умерших пациентов и hsТnT, MPO, ЭТ-1, PLGF — в группе выживших больных.
В группе умерших больных значимо чаще отмечались диагностически значимые повышения ТnI и PLGF на 2–3-и сут от начала ИМ по сравнению с 1-ми сут заболевания. Чаще выявлялись диагностически значимые повышения hsТnT на 1-е сут ИМ по сравнению с недельными результатами забора крови.
У выживших пациентов на 1-е сут ИМ по сравнению с другими сроками определения биомаркеров чаще регистрировались диагностически значимые повышения MG. На 2–3-и сут ИМ по сравнению со значениями 1-х и 7-х сут чаще выявлялись диагностически значимые повышения для ТnI, NTPBNP, hsCRB. Для sCD40L диагностически значимые повышения чаще регистрировались на 2–3-и и 7-е сут ИМ, чем на 1-е сут.
Согласно общей частоте выявления диагностически значимых повышений кардиомаркеров между сравниваемыми группами живых и умерших пациентов после развития ИМ было зарегистрировано сопоставимое число повышений для ТnI, MG, NTPBNP, MPO, PLGF, однако среди умерших больных были достоверно чаще выявлены повышения для ЭТ-1, реже — для sCD40L, hsCRB, hsТnT (табл. 6).
Сравнение межгрупповой частоты выявления диагностически значимых повышений маркеров у живых и умерших пациентов с ИМ в разные сроки заболевания показало, что в группе умерших пациентов на 1-е сут ИМ чаще регистрировались диагностически значимые повышения NTPBNP, на 2–3-и сут — MG и PLGF, на 7-е сут — ТnI (табл. 7).
При углубленном изучении было установлено, что из всех взятых у пациентов биомаркеров более мощным предиктором госпитальной летальности при ИМ в течение всего госпитального этапа лечения был hsТnT (табл. 8).
Обнаружение прироста ЭТ-1, отличного от референсного, напротив, ассоциировалось в исследуемой группе со снижением частоты возникновения летальных исходов. Тем не менее формально все изучаемые биомаркеры с показателем ОР > 1 могут рассматриваться для прогнозирования высокого риска госпитальной летальности.
Современные методы диагностики
Если возникли подозрения на счет инфаркта, есть анамнестические данные про ишемическую болезнь сердца и характерные клинические признаки, врач назначает диагностическую программу. Она состоит из таких методов:
- электрокардиограмма;
- лабораторная диагностика.
Рассмотрим подробнее данные методы исследования.
Электрокардиограмма представляет собой графическое изображение проведения импульса по волокнам миокарда. Если за счет некроза проводимость нарушена — это отобразится на записи. По изменениям на ЭКГ можно различить локализацию зоны некроза. Также, на графике можно увидеть фазу инфаркта — острую или подострую.
Общий анализ крови
В общем анализе крови не наблюдается специфических изменений и поэтому на его основе нельзя выставить диагноз. При инфаркте развивается лейкоцитоз, который возникает через несколько часов после начала процесса и достигает максимума к концу суток. Повышенный показатель удерживается несколько дней и постепенно возвращается к норме. Лейкоциты не повышаются сильно, как, например, при инфекционной патологии, что позволяет провести дифференциальную диагностику. Это важно при атипичной клинической картине инфаркта миокарда, когда врач может подозревать несколько патологий. В общем анализе крови можно также увидеть повышенный показатель СОЭ, который остается таким на протяжении нескольких недель. Повышаются и эозинофилы, они остаются повышенными около недели.
Биохимический анализ крови
Аланинаминотрансфераза (АЛТ)
Показатель разрушения гепатоцитов и кардиомиоцитов. Повышается при гепатитах различной этиологии, инфаркте, токсических поражениях внутренних органов. АЛТ — это активный компонент обмена веществ в печени, фермент, который ускоряет метаболизм аминокислот. Наибольшая концентрация вещества находится в клетках печени, почек, сердца, а также в скелетной мышечной ткани. Так как его локализация — цитоплазма, в кровь он выходит при разрушении клеточной мембраны. Чем массивнее участок разрушения, тем выше концентрация фермента в крови. Пик активности фермента при инфаркте — 12 часов.
Повышение или нормализация уровня АЛТ — маркер состояния пациентов различного профиля с заболеваниями внутренних органов и мягких тканей. В зависимости от заболевания АЛТ может повышаться умеренно или остро, например, наивысшая степень концентрации наблюдается при гепатитах.
При инфаркте применяется коэффициент де Ритиса, который состоит из сопоставления активности АСТ и АЛТ. Если показатель превышает норму, это говорит об инфаркте, а если ниже её значения — возможно развился некроз почечной ткани или активная фаза гепатита. Естественно, на основании показателя АЛТ не происходит постановка диагноза. Для этого применяются более специфические маркеры. Уровень трансаминаз проверяют в общем биохимическом анализе, для дифференциальной диагностики и контроля общего состояния пациента.
Аспартатаминотрансфераза (АСТ)
Маркер состояния тканей сердца, печени. Повышается при вирусных гепатитах, токсических поражениях тканей сердца и гепатоцитов. применяется также при профилактическом обследовании, при необходимости подтвердить или исключить инфаркт. Это вещество ответственно за обмен аминокислот в клетках, поэтому наибольшее его количество находится в клетках печени, сердца, скелетных мышцах и эритроцитах. Если клетки данных органов повреждены — происходит выход трансаминазы в кровь, где можно обнаружить её повышение. Есть допустимый уровень фермента в крови, ведь клетки органов периодически разрушаются, но при патологических состояниях этот показатель возрастает в разы и десятки раз. Пик максимальной концентрации в крови — через 12 часов после начала инфаркта. Применяется также сравнение показателей АЛт и АСТ. Каждый из этих ферментов повышается при отдельных патологиях, а при инфаркте оценивается их соотношение. АСТ не является специфическим показателем при инфаркте, он дополняет общую картину лабораторного исследования.
Креатинкиназа MB
Это вещество является изоферментом, маркером состояния сердечной мышцы. Принимает участие в метаболизме креатина и креатинфосфата. Это вещество содержится только в миокарде, поэтому повышается при его заболеваниях — миокардитах, инфаркте, рабдомиолизе, перикардитах. Уровень вещества является маркером при острой и подострой фазе процесса. Кратковременное увеличение показателя наблюдается при хирургических вмешательствах на сердце, что отражает реакцию миокарда на лечение. Максимум концентрации при инфаркте наблюдается через 12 часов после начала. Высокая активность говорит о значительном размере участка поражения. Сравнивают повышение данной фракции КФК с общим показателем вещества по организму. В принципе, оценка уровня КФК МВ применяется для ранней диагностики поражения миокарда, а также для дифференциации состояния с другими заболеваниями. Повышение маркера может говорить, кроме инфаркта, о таких состояниях, как шок, отравления и интоксикации, инфекционные поражения тканей сердца.
Тропонин I
Белок, который в высоком количестве содержится в скелетных мышцах и миокарде. Существуют разновидности этого белка, которые отвечают за разные фазы сокращения мышц. Все эти белки являются кардиоспецифическими и говорят о состоянии миокарда. Повреждение миоцитов сердца приводит к выходу вещества в кровь, где его можно обнаружить с помощью лабораторного исследования. Площадь некроза влияет на уровень повышения показателя тропонинов в крови. Тропонин I является наиболее чувствительным и специфическим при инфаркте. Повышенный тропонин удерживается в течении 5-6 дней после начала патологического процесса.
Миоглобин
Это белок, который находится в мышечных клетках и содержит молекулы железа. Аналогичен по строению с гемоглобином — железосодержащим белком крови. Функция миоглобина также похожа — он транспортирует кислород в миоциты, клетки мышц. При некрозе происходит разрушение мышечных клеток, миоглобин освобождается и попадает в кровоток, где его и можно обнаружить. Белок из крови выводится вместе с почками. Определить его в крови можно уже через несколько часов после начала патологического процесса, в течении 2-3 суток его все еще можно определить. Этот маркер реагирует одним из первых, что повышает его диагностическую ценность. При некротических изменениях он повышается в 7-10 раз, в зависимости от площади участка некроза. Для сравнения, период пикового повышения остальных маркеров — 12 часов, тогда как для миоглобина — 6 часов. Так же быстро происходит и нормализация анализов. Они могут оставаться повышенными дольше суток если наступили осложнения, например, расширение участка некроза. Иногда случаются новые очаги, тогда миоглобин повышается снова, что требует динамического контроля показателя. Важен также отрицательный результат исследования, что, в сопоставлении с клинической картиной позволяет исключить патологию. Кроме инфаркта, миоглобин может говорить о синдроме длительного сдавления. патологии мышц, воспалительных процессов.
Введение
Результаты многочисленных исследований подтверждают, что атеротромбоз и последующий некроз (инфаркт) миокарда сопровождаются активацией многих патологических реакций (гиперагрегация и гиперкоагуляция, активация клеточно-гуморального гомеостаза, миокардиальный дистресс-синдром), которые обусловливают системные эффекты повреждения миокарда и являются непосредственными механизмами формирования неблагоприятного прогноза заболевания [1–7].
Имеются данные, что максимально ранний мониторинг биологических маркеров активации системных патологических процессов, сопровождающих инфаркт миокарда (ИМ), может повысить эффективность стратификации риска пациентов в отношении неблагоприятного исхода острой коронарной катастрофы [8]. В частности, «золотым стандартом» как ранней диагностики ИМ, так и рискометрии при всех типах острого коронарного синдрома (ОКС) является серийное определение высокочувствительных тропонинов [9]. Биомаркеры включены в некоторые действующие модели оценки риска у пациентов с ОКС (GRACE, CRUSADE), тем не менее даже «золотой стандарт» диагностики ИМ — высокочувствительный тропонин имеет ограничения, обусловленные недостаточной специфичностью этого признанного биомаркера некроза миокарда, а также невозможностью повсеместного внедрения этого метода лабораторной диагностики в практику отделений, принимающих пациентов с подозрением на ОКС для дифференциальной диагностики.
В силу этого сохраняется интерес к использованию мультимаркерных моделей диагностики и риск-стратификации ОКС, когда серийное определение нескольких биологических маркеров, отражающих активность основных патологических реакций, может быть эффективным для оценки риска неблагоприятного исхода в разные периоды заболевания.
Цель исследования:
оценка возможности использования мультимаркерной модели для прогнозирования риска летального исхода у пациентов с острым ИМ.
Что может влиять на результат?
На результаты анализов влияет время проведения диагностики, которое прошло с момента начала заболевания. Также, изменения зависят от распространенности зоны некроза, локализации процесса. Многие лабораторные показатели, которые наблюдаются при инфаркте, могут сопровождать и другие патологические состояния. К примеру, трансаминазы повышаются при заболеваниях внутренних органов, нарушении функции печени, гепатитах различной этиологии, на фоне употребления алкоголя. Тропонин повышается при воспалительных процессах в миокарде. Креатинкиназа и миоглобин могут колебаться при нарушении структуры мышечной ткани, рабдомиолизе, различных воспалительных процессах, миозитах. Многие их этих показателей остаются повышенными после перенесенного хирургического вмешательства, что следует учитывать при сборе анамнеза у пациента.
Если есть такая возможность, анализ желательно сдавать натощак, перед сдачей крови из вены стоит немного отдохнуть. Хорошо, если до исследования удается исключить употребление алкоголя, никотина и физические нагрузки. Нужно сказать врачу, какие препараты принимались, так как они также могут отразиться на результатах анализов.
Своевременная диагностика инфаркта позволяет вовремя начать лечение. В случае с инфарктом, это особенно важно, так как счет времени идет иногда на часы. Эффективная терапия или хирургическое вмешательство могут продлить жизнь пациента, улучшить её качество и снижают риск осложнений. Необходимо доверять свое здоровье проверенным медицинским учреждениям, где есть условия для точной диагностики за короткий срок.
Материал и методы
В исследование был включен 81 пациент, госпитализированный в Окружной кардиологический диспансер «Центр диагностики и сердечно-сосудистой хирургии» (региональный сосудистый центр г. Сургута) в течение 1 мес. 2022 г. с подтвержденным диагнозом ИМ, установленным согласно действующим критериям Российского кардиологического общества.
При включении все пациенты подписали информированное добровольное согласие на участие в исследовании, одобренное локальным этическим комитетом СурГУ. В исследование не включали пациентов, не подписавших информированное согласие, имевших при поступлении в клинику острой сердечной недостаточности Killip IV и тяжелую соматическую патологию (терминальная хроническая почечная недостаточность, онкологическое заболевание с метастазированием), ограничивающую вероятность выживания пациента более 12 мес.
На первом этапе исследования был составлен общий клинико-анамнестический портрет исследуемой группы пациентов с ИМ. Далее в течение стационарного лечения регистрировались «жесткие» конечные точки (госпитальная летальность, рецидивы ИМ, желудочковые нарушения ритма сердца, инсульты, большие кровотечения, повторные экстренные реваскуляризации).
На 1, 2–3, а также 7-е сут от момента возникновения ИМ у всех доживших пациентов — участников исследования забирали образцы крови для лабораторной оценки нескольких биологических маркеров [тропонин I, высокочувствительный тропонин Т (hsТnT), миоглобин (MG), N-терминальный фрагмент предшественника мозгового натрийуретического пептида (NTproBNP), тканеспецифичный С-реактивный белок (hsCRB), растворимый сывороточный лиганд CD40 (sCD40L), миелопероксидаза (MPO), эндотелин-1 (ЭТ-1), плацентарный фактор роста (PLGF)]. Плазменные концентрации тропонина I, миоглобина, NTproBNP, PLGF (лабораторный набор Roche Cobas, Швейцария), sCD40L (лабораторный набор Bender MedSystems, Австрия) эндотелина-1 (лабораторный набор Biomedica Gruppe, Австрия), МРО (лабораторный набор HyCult biotechnology, США), а также тканеспецифичного тропонина Т (лабораторный набор Roche Elecsys, Швейцария) определяли методом иммуноферментного анализа (ИФА) на анализаторе для лабораторной экспресс-диагностики COBAS E411 (Roshe, Швейцария); величины hsCRB определяли на иммунохемилюминесцентном анализаторе IMMULITE 1000 (Siemens, Германия). При этом референсными считали уровни: ТnI — до 0,3 нг/мл; hsТnT — до 0,1 нг/мл; MG — до 70 мкг/л, NTPBNP — до 125 пк/мл; hsCRB — до 10 мг/л; MPO — до 350 пк/мл; sCD40L — до 1,5 нг/мл; ЭТ-1 — до 1 фмоль/л; PLGF — до 22 пг/мл.
В завершающей части исследования в группах живых и умерших после ИМ пациентов путем статистического анализа лабораторных показателей, отличных от референсных значений, выявляли предикторы госпитальной летальности.
Количественные показатели в исследовании представлены в виде средних значений с учетом стандартного отклонения, качественные — в частоте в процентах. При распределении признаков, отличном от нормального, применены методы непараметрической статистики в виде расчета медианы, а также нижних и верхних квартилей. Различия количественных признаков оценены с помощью критерия Манна — Уитни, качественные — дифференцировали по Хи-квадрату Пирсона. Для выявления предикторов госпитальной летальности рассчитывался относительный риск (ОР) и 95% доверительные интервалы (ДИ), чувствительность и специфичность. Критический уровень значимости в исследовании принят как р<0,05. Статистические расчеты выполнены с использованием программы Statistica 10.0 (Stat Soft Inc., USA).