© Автор: Солдатенков Илья Витальевич, врач-терапевт, специально для СосудИнфо.ру (об авторах)
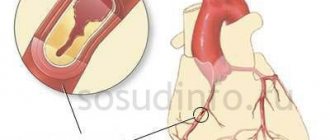
Реваскуляризация миокарда — группа операций, позволяющих восстановить коронарное кровообращение при ишемии сердечной мышцы. Основными причинами ишемической болезни сердца в любом ее проявлении являются нарушение проходимости коронарных артерий и сужение их просвета из-за атеросклероза. К оперативному вмешательству прибегают в тех случаях, когда консервативная терапия не дает положительного эффекта и не устраняет имеющиеся нарушения.
Реваскуляризация осуществляется путем установки расширяющего сосуд стента, удаления атеросклеротической бляшки путем воздействия на неё, либо формирования шунта – пути обхода пораженного участка артерии.
Реваскуляризация миокарда бывает двух видов — прямая и непрямая.
Прямая реваскуляризация в свою очередь подразделяется на:
- Коронарное шунтирование – наиболее распространенный метод, который в официальной медицине называется прямая реваскуляризация. Аорту соединяют с венечными артериями с помощью специальных шунтов, по которым начинает циркулировать кровь. Так врачи-хирурги восстанавливают коронарное кровообращение.
- Балонная ангиопластика и коронарное стентирование — малоболезненные и практически бескровные методики. Подобные малоинвазивные процедуры показаны пациентам с тяжелой сопутствующей патологией. Эти операции значительно снижают послеоперационную летальность.
Это традиционные методы реваскуляризации миокарда.
Непрямая реваскуляризация миокарда — особый хирургический метод, предназначенный для восстановления кровообращения в мелких артериях сердца, пораженных атеросклерозом. В этих случаях аортокоронарное шунтирование и ангиопластика неэффективны и не могут улучшить состояние больных. Проводится лазерная реваскуляризация – в толще миокарда создают каналы с помощью лазера, по которым кровь проникает из левого желудочка в мелкие сосуды сердца.
Аортокоронарное шунтирование
Коронарное шунтирование — сложная и дорогостоящая операция, которую выполняют высококвалифицированные специалисты для лечения ИБС. Во время операции хирурги-кардиологи накладывают обходные анастомозы между аортой и пораженной коронарной артерией, по которым осуществляется коронарное кровообращение.
К операции больного необходимо подготовить. Чтобы стабилизировать состояние больных, следует нормализовать уровень артериального давления, частоту сердечных сокращений и дыхательных движений, показатели сахара в крови. Это позволит улучшить прогноз и самочувствие пациента после хирургического вмешательства. Чтобы выявить противопоказания к операции, специалисты полностью обследуют больного. Лучше всего переносят коронарную реваскуляризацию лица в возрасте 30-55 лет. У них редко регистрируются осложнения.
Во время подготовки к аортокоронарному шунтированию необходимо соблюдать рекомендации врачей. Последний раз принимать пищу следует накануне вечером, желательно до 18 часов. Утром пациенту необходимо принять душ и сбрить волосы на груди.
Шунты выполняют из подкожной вены, которую берут из бедра или преплечья. Обычно за одну процедуру устанавливают не более 5-6 шунтов.
Аортокоронарное шунтирование — оперативное вмешательство на сердце, предотвращающее необратимые изменения миокарда, улучшающее его сократимость и повышающее качество и продолжительность жизни пациентов. Операцию проводит бригада специалистов, в которую входя хирурги-кардиологи, анестезиологи, реаниматологи. Длится операция три-четыре часа и проводится под аппаратом искусственного кровообращения.
Этапы операции:
- Продольный разрез по средней линии грудины.
- Определение места установки шунта по данным ангиографии.
- Забор шунта с руки или ноги.
- Введение «Гепарина» для предупреждения образования тромбов.
- Подключение аппарата искусственного кровообращения.
- Наложение шунта.
- Восстановление самостоятельной работы сердца.
- Введение «Протамина».
- Дренирование операционной раны и ее ушивание.
Результаты коронарного шунтирования не всегда долговечны. В большинстве случаев установленные шунты служат около пяти лет. Риск развития послеоперационных осложнений крайне высок. У больных развивается сердечная недостаточность, открывается кровотечение, происходит инфицирование операционной раны.
Противопоказаниями к проведению коронарного шунтирования являются:
- Тяжелое состояние больных,
- Онкологические заболевания,
- Артериальная гипертензия,
- Состояние после инсульта,
- Дистальные и диффузные стенозы.
Возрастающий интерес к малоинвазивной хирургии обусловлен, с одной стороны, высокой долей больных старшего возраста с тяжелой сопутствующей патологией, с другой — необходимостью снижения травматичности вмешательства, частоты и тяжести осложнений, а также экономических затрат. В последние годы в хирургическом лечении больных хронической ишемической болезнью сердца (ИБС) в ряде случаев стали отдавать предпочтение полной реваскуляризации миокарда с применением чрескожной транслюминальной ангиопластики с использованием стентов с лекарственным покрытием. При невозможности выполнения этой процедуры приоритет все же остается за коронарным шунтированием (КШ) с использованием внутренних грудных артерий для реваскуляризации системы левой коронарной артерии. Преимуществами первого подхода являются малая инвазивность вмешательства, малое количество интра- и послеоперационных осложнений, быстрая реабилитация и возврат к обычному образу жизни. Большая частота повторных реваскуляризаций в сравнении с КШ — известный недостаток чрескожных коронарных вмешательств (ЧКВ). Преимуществом КШ остается высокая проходимость артериальных маммарных кондуитов в отдаленном периоде, обеспечивающая лучшие результаты реваскуляризации. Основные недостатки КШ — травматичность вмешательства и значимое количество различных периоперационных осложнений [4, 5, 22, 24]. Широкое внедрение КШ на работающем сердце без применения искусственного кровообращения (ИК) не решило полностью проблему вследствие травматичности срединной стернотомии, а операции из минидоступов, в частности, маммарокорнарное шунтирование (МКШ) передней межжелудочковой артерии (ПМЖА) из переднебоковой миниторакотомии (ПБМ), имеют ограниченное применение при многососудистых поражениях коронарных артерий [10, 15, 20, 21, 26]. Кроме того, доказано, что длительность функционирования аутовенозных шунтов сопоставима с таковой современных стентов [8]. В этой связи в определенной группе больных, у которых технически выполнима эндоваскулярная реваскуляризация системы правой коронарной артерии (ПКА) и огибающей артерии (ОА), возможно использование этапной гибридной реваскуляризации миокарда, позволяющей использовать позитивные и исключить негативные факторы двух основных методик. Интегральный подход включает МКШ ПМЖА из ПБМ и ЧКВ в бассейнах ОА и ПКА с использованием стентов с лекарственным покрытием [19]. Анализу первых результатов применения гибридного подхода посвящена данная публикация.
Материал и методы
Данное исследование являлось пилотным проспективным нерандомизированным и было выполнено за период с июля по ноябрь 2011 г. в отделе мультифокального атеросклероза НИИ КПССЗ. За указанный период в учреждении проведено около 400 стандартных операций КШ и более 800 ЧКВ. Объектом исследования явились 8 пациентов с многососудистым поражением коронарного русла, оперированных в НИИ КПССЗ с июля по ноябрь 2011 г. У этих больных выполнена реваскуляризация миокарда в рамках гибридного подхода: МКШ ПМЖА из ПБМ и ЧКВ на других коронарных артериях.
Показаниями к гибридной реваскуляризации миокарда были следующие:
— многососудистое поражение коронарного русла со стенозами ≥ 0%;
— стенокардия II—III функционального класса (CCS);
— возможность выполнения МКШ ПМЖА из ПБМ и ЧКВ;
— консенсус между кардиохирургом и специалистом по рентгеноэндоваскулярной диагностике и лечению о соответствии пациента критериям включения и исключения;
— подписанное пациентом информированное согласие на участие в исследовании.
Общеклиническими противопоказаниями служили следующие:
— наличие острого коронарного синдрома;
— предшествующее КШ;
— предшествующий тромбоз и рестеноз стента;
— сопутствующая патология, ограничивающая ожидаемую продолжительность жизни (например, инкурабельное онкологическое заболевание);
— невозможность применения двухкомпонентной антитромбоцитарной терапии.
Ангиографическими противопоказаниями были:
— наличие критических стенозов (≥95%) в системе ПКА, ОА и промежуточной артерии, подходящих для реваскуляризации, но опасных высоким риском ишемических осложнений во время МКШ ПМЖА;
— показания к экстренной реваскуляризации.
Средний возраст пациентов составил 56,2±10,6 года. Преобладали пациенты мужского пола (n=7) с клинической картиной стенокардии напряжения I—III ФК (n=8). Абсолютное большинство больных страдали артериальной гипертензией (n=7) и мультифокальным атеросклерозом (n=5). Резидуальные явления острого нарушения мозгового кровообращения имелись у 2 пациентов, сахарный диабет не выявлен ни в одном случае, однако у 2 больных зарегистрировано нарушение толерантности к углеводам. Средняя фракция выброса левого желудочка по данным эхокардиографии составило 59,5±7,7%.
По данным коронарографии, у 4 (50%) больных имелось двухсосудистое гемодинамически значимое поражение коронарного русла со стенозами основных эпикардиальных ветвей, включая ПМЖА ≥70%. В 3 случаях диагностировано трехсосудистое поражение, у одного пациента выявлено поражение ствола левой коронарной артерии в сочетании со значимыми стенозами 3 сосудов.
Непосредственные результаты реваскуляризации изучали в сроки до 30 дней. Оцениваемыми исходами были смерть, инфаркт миокарда, повторная реваскуляризация целевого сосуда, а также неврологические (острое нарушение мозгового кровообращения или транзиторная ишемическая атака), инфекционные и геморрагические осложнения.
Под инфекционными осложнениями понимали раневую инфекцию, потребовавшую применения хирургических методов санации, под геморрагическими — любые кровотечения, связанные с операцией с необходимостью реторакотомии и/или гемотрансфузии. Тромбоз стента в течение всего периода наблюдения оценивали согласно общепринятой классификации ARC (Academic Research Consortium).
Оценку результатов проводили с помощью сбора клинических данных в госпитальном периоде, а также путем телефонного опроса пациентов или при визите больных в клинику.
Результаты
Во всех случаях первым этапом реваскуляризации являлось МКШ ПМЖА из ПБМ без ИК. Вторым этапом было ЧКВ, проведенное в течение госпитального периода, в рамках которого также выполнялась шунтография. Данная последовательность выбрана, с одной стороны, в связи с отсутствием необходимости в отмене двухкомпонентной антитромбоцитарной терапии перед КШ, с другой — с возможностью контроля работы шунта к ПМЖА перед ЧКВ. Интервал между этапами реваскуляризации составил от 3 до 5 дней. За 24 ч до ЧКВ пациенты получали нагрузочную дозу клопидогрела 300 мг с последующей суточной дозировкой 75 мг и продолжали принимать ацетилсалициловую кислоту из расчета 1 мг/кг/сут.
У 4 (50%) больных целевым сосудом для стентирования являлась ПКА, в 2 случаях — интермедианная артерия и по одному случаю — сегмент ствола левой коронарной артерии — ОА, ветвь тупого края. При шунтографии, предваряющей ЧКВ, адекватное функционирование МКШ (левой внутренней грудной артерии) к ПМЖА отмечено во всех 8 случаях. У всех пациентов при ЧКВ применяли стенты с лекарственным покрытием. Среднее число стентов на одного пациента составило 1,25. Средний диаметр имплантированных эндопротезов достигал 3,5±0,5 мм, средняя длина — 22±6,1 мм. Во всех 8 случаях ЧКВ было успешным (кровоток по целевой артерии не ниже TIMI 3 в отсутствие осложнений).
На протяжении 30 дней наблюдения не было зарегистрировано ни одного оцениваемого отрицательного исхода. Все больные были своевременно выписаны из клиники для амбулаторного наблюдения.
Приводим клинический пример.
Пациент У., 70 лет, в 2010 г. впервые обратился с жалобами на симптомы стенокардии II функционального класса. У больного имелась сопутствующая патология в виде артериальной гипертензии, умеренного атеросклеротического поражения сонных артерий и хронической сердечной недостаточности II степени (NYHA).
В 2011 г. по результатам коронарографии выявлены стенозы ПМЖА 75%, ветви тупого края 60% и ПКА 40% (см. рисунок, а).
Рисунок 1. Коронарограммы больного У., 70 лет. а — исходная ангиограмма: признаки гемодинамически значимых стенозов передней межжелудочковой и огибающей артерий (показано стрелками); б — ангиография перед выполнением чрескожного коронарного вмешательства: проходимая левая внутренняя грудная артерии после операции маммарокоронарного шунтирования к передней межжелудочковой артерии; в — окончательный ангиографический результат после имплантации коронарного стента в огибающую артерию (показано стрелкой). Тактика лечения была определена в пользу гибридной реваскуляризации миокарда в объеме МКШ ПМЖА из ПБМ на работающем сердце с применением левой внутренней грудной артерии и ЧКВ ветви тупого края с имплантацией стента с лекарственным покрытием.
Перед хирургическим вмешательством по данным ЭКГ ритм синусовый, 64 в 1 мин. Замедление внутрипредсердной проводимости. Умеренные изменения миокарда левого желудочка. При эхокардиографии: умеренно расширено левое предсердие, конечный диастолический размер левого желудочка 5,5 см, фракция выброса 64%. Зон с нарушением локальной сократимости не выявлено.
В июле 2011 г. проведена операция МКШ из ПБМ на работающем сердце с применением левой внутренней грудной артерии (см. рисунок, б)
. В ходе операции осложнений не зарегистрировано. Послеоперационный период протекал без особенностей.
Спустя 7 сут после МКШ выполнена контрольная коронарошунтография с подтверждением функционирования шунта к ПМЖА и проведено запланированное ЧКВ на ветви тупого края: имплантирован стент с лекарственным покрытием Xince V 2,5×28 мм (см. рисунок, в)
. Из клиники пациент был выписан на 17-е сутки после МКШ из ПБМ в удовлетворительном состоянии. В ходе 30-дневного наблюдения за больным осложнения не выявлены, клиническая картина стенокардии отсутствовала.
Обсуждение
Стандартом хирургической реваскуляризации у больных с многососудистым поражением остается операция КШ в условия ИК и пережатия аорты с использованием стернотомного доступа. Хорошая визуализация, неподвижное и бескровное операционное поле при достаточной защите миокарда сделали это вмешательство очень распространенным, а более чем 90% десятилетняя проходимость маммарных кондуитов обеспечила прочные позиции в арсенале методов лечения больных ИБС [3, 6, 9, 16, 21].
Однако высокая инвазивность КШ с ИК, увеличивающая продолжительность госпитального и реабилитационного периодов, а также ряд пери- и послеоперационных осложнений, связанных с операционной травмой и использованием ИК, обусловленных выраженным системным воспалительным ответом, гипоперфузией, микро- и макроэмболией из аппарата ИК и восходящего отдела аорты, определяющих развитие различных тяжелых органных осложнений (неврологические, почечные, дыхательные и геморрагические), требуют оптимизации путей реваскуляризации миокарда. С целью исключения множества негативных факторов применяется методика МКШ из ПБМ без использования ИК и вмешательства на восходящей аорте [12, 13].
Вместе с тем рекомендации Американской ассоциации сердца по торакальной и кардиохирургии (2011) позиционируют выбор гибридного метода только у ограниченного контингента пациентов из группы высокого риска пожилого возраста при наличии тяжелых сопутствующих заболеваний, технической невозможности ЧКВ ПМЖА, а также при высоком риске вмешательств, связанных с морфологическими изменениями восходящего отдела аорты [1]. Отношение к использованию гибридного подхода у обычной группы пациентов более сдержанное. Несмотря на возможности гибридной технологии, соединяющей в себе преимущества открытой и чрескожной реваскуляризации, опыт применения данного вмешательства в мире явно недостаточен, опубликованный опыт не превышает 120—130 вмешательств [7, 18]. Прежде всего этого касается пациентов с многососудистым поражением коронарных артерий, большинству из которых выполняется КШ как с ИК, так и без ИК [2, 7, 10, 17, 18, 25, 27]. Расширение сферы применения реваскуляризации миокарда из минидоступа не только у пациентов с однососудистым поражением КА, но и при множественном поражении является актуальной задачей. Это объясняется тем, что использование методики МКШ ПМЖА из ПБМ с последующим ЧКВ и стентированием других коронарных артерий в повседневной практике, вероятно, позволит существенным образом улучшить результаты реваскуляризации у пациентов с многососудистым поражением коронарного русла как высокого, так и умеренного хирургического риска при снижении частоты развития пери- и послеоперационных осложнений, связанных с операционной травмой, использованием ИК и манипуляцией на восходящем отделе аорты. Немаловажным вопросом является этапность гибридной реваскуляризации миокарда. Первоочередная реваскуляризация бассейна передней нисходящей артерии из минидоступа имеет ряд преимуществ и является, с нашей точки зрения, предпочтительной технологией. Среди этих преимуществ: 1) возможность ангиографического контроля за МКШ; 2) хирургическое вмешательство без дезагрегантной терапии с меньшим риском кровотечений; 3) реваскуляризация большого бассейна передней нисходящей артерии, снижающего риск дальнейшего ЧКВ. Недостатком является возможность острых коронарных осложнений в бассейнах нереваскуляризированных ОА и ПКА, а также возможность безуспешного последующего ЧКВ при сложных видах стентирования, в случае которого возникает вопрос о необходимости выполнения КШ через срединную стернотомию. К преимуществам первоочередного ЧКВ можно отнести возможность одномоментной первичной коронарографии и ЧКВ и возможность гибридной реваскуляризации после вмешательств по поводу острого коронарного синдрома. Однако выполнение открытого вмешательства в условиях базовой дезагрегантной терапии и поэтому опасного развитием кровотечений, а также отсутствие контроля за состоянием передней нисходящей артерии после вмешательства является существенным недостатком подобного подхода. Однако следует отметить, что многие авторы считают риск кровотечения в таких условиях при использовании минидоступа явно преувеличенным [11].
Первый опыт нашего центра в выполнении гибридной реваскуляризации миокарда с МКШ ПМЖА из ПБМ с последующим ЧКВ и стентированием других коронарных артерий дает обнадеживающие результаты в лечении больных с многососудистым поражением коронарного русла. Во всех случаях оба этапа реваскуляризации выполнены успешно. Адекватное функционирование МКШ к ПМЖА подтверждено при помощи ангиографии, предваряющей ЧКВ, что позволило убедиться в качественном функционировании анастомоза и выполнить полную реваскуляризацию миокарда без ИК, манипуляций на аорте и различного рода пери- и послеоперационных осложнений.
Высокая проходимость шунтов из внутренней грудной артерии и низкая частота рестенозов при применении стентов с лекарственным покрытием позволяют прогнозировать хорошие результаты и в отдаленном периоде. Далеко идущие выводы делать пока рано: требуются увеличение числа наблюдений и сопоставление результатов с группой больных после стандартного КШ на фоне ИК в рамках рандомизированного исследования.
Решение данной проблемы позволит определить место гибридной реваскуляризации миокарда в лечении больных с многососудистым поражением коронарного русла, разработать алгоритм отбора пациентов для того или иного способа реваскуляризации и дифференцированно применять различные стратегии хирургической, эндоваскулярной и гибридной коррекции в клинической практике.
Заключение
Первый опыт применения гибридной реваскуляризации у больных с многососудистым поражением коронарного русла при использовании в качестве первого этапа МКШ ПМЖА из ПБМ в отсутствие ИК и в качестве второго этапа — ЧКВ (с имплантацией стентов с лекарственным покрытием) других коронарных сосудистых бассейнов показал отсутствие осложнений в течение 30 дней наблюдения.
Балонная ангиопластика
Одним из способов хирургической реваскуляризации миокарда является баллонная агниопластика. Операцию проводят с целью расширения закупоренных или суженых венечных артерий. Для ее проведения используют специальный катетер, с помощью которого пациенту вводят баллон, расширяющий просвет стенозированной артерии. Операция позволяет восстановить коронарный кровоток и улучшить кровоснабжение миокарда.
Балонная ангиоплатика – это малоинвазивный метод, предназначенный для восстановления просвета артерий. Операции с применением ангиопластики расширяют сосуды, питающие кровью сердечную мышцу. Чтобы определить место сужения сосуда, специалисты направляют больного на ангиографическое исследование. Больному внутривенно вводят контрастное вещество и делают серию рентгеновских снимков, на которых отображается патологический процесс, происходящий в артериях.
Операцию проводят под местной анестезией. Через прокол на бедре в пораженную артерию вводят длинный и тонкий катетер, на конце которого имеется баллончик. Подводят его к суженному участку артерии и надувают. Этот метод позволяет растянуть просвет артерии на 50–80%. Ангиопластика проводится под ангиографическим контролем.
Балонная ангиопластика является высокоэффективной и малотравматичной операцией, которая не оставляет на коже заметных шрамов и отличается коротким реабилитационным периодом.
Коронарное стентирование
Стентирование — оперативное вмешательство, позволяющее избежать повторного сужения артерии. Эта операция избавляет больных от стенокардии и уменьшает количество принимаемых лекарств. Спустя 3 или 4 суток после стентирования пациенты возвращаются к нормальной жизни. Коронарное стентирование назначают лицам, у которых имеется стеноз коронарных артерий.
Стент представляет собой эндопротез, имеющий сетчатый каркас из металла цилиндрической формы. Он удерживает стенки сосуда в определенном положении. Некоторые стенты покрываются лекарством, препятствующим появлению рубцов на стенках артерий, но они являются более дорогостоящими. Стент подводят в сложенном виде к сосуду с атеросклеротической бляшкой, а затем раскрывают его путем раздувания баллона изнутри. Но существуют и самораскрывающиеся конструкции без баллона. Они практически не травмируют стенки сосуда, способствуют сокращению времени операции и снижению лучевой нагрузки на организм. Весь процесс происходит под контролем рентгена.
Материал и методы
В период с 2007 по 2013 г. на базе отделения кардиохирургии № 2 Ростовской областной клинической больницы (Ростов-на-Дону), выполнено более 5000 коронарных шунтирований, из них 60 пациентам выполнено АКШ в cочетании с ТМЛР. Информированное согласие было получено от каждого пациента. Критериями включения в исследование были диффузное поражение КА, атеросклеротическое изменение дистального русла или наличие мелких, неподходящих для шунтирования КА, сохранение в области операции жизнеспособного миокарда. Если имелась возможность прямой реваскуляризации хотя бы одной КА, выполняли АКШ, которое дополняли ТМЛР в тех зонах, которые не были доступны реваскуляризации. Критериями исключения были тяжелая хроническая обструктивная болезнь легких (объем форсированного выдоха за 1 с <55% от прогнозируемого значения); острый период инфаркта миокарда; тяжелые нарушения ритма; декомпенсированная сердечная недостаточность.
Исследуемую группу составили 52 мужчины и 8 женщин в возрасте от 46 лет до 81 года (средний возраст 65,9±7,3 года). Большинство больных (n
=44) имели стенокардию напряжения IV Ф.К. Общая сводная характеристика больных представлена в табл. 1.
Таблица 1. Общая характеристика больных Примечание. ФВ ЛЖ — фракция выброса левого желудочка, ИМ — инфаркт миокарда, ХСН — хроническая сердечная недостаточность.
Больным для объективизации состояния выполнялись коронароангиография, холтеровское мониторирование ЭКГ. Определение класса стенокардии проводилось согласно рекомендациям Канадского сердечно-сосудистого общества и модифицированного протокола Брюса. До хирургического лечения пациенты не в состоянии были выполнять нагрузочные пробы (тредмил-тест) из-за выраженной стенокардии. Для диагностики жизнеспособности миокарда проводили сцинтиграфию миокарда и ЭхоКГ. Все операции выполнялись стандартно: в условиях искусственного кровообращения и фармакохолодовой кардиоплегии раствором Кустодиол. Во всех случаях сначала выполнялось АКШ, затем ТМЛР — после наложения шунтов и восстановления кровотока в КА в условиях искусственного кровообращения (ИК). Во всех случаях лазерную реваскуляризацию выполняли с помощью отечественной ЭКГ-синхронизированной лазерной установки Перфокор. После расположения рукоятки манипулятора над поверхностью сердца подавали импульс, синхронизированный с ЭКГ пациента относительно зубца R. Пенетрация всей толщи миокарда при помощи 500 Вт СО2-лазера происходила за один импульс, что подтверждалось появлением пульсирующей струи крови из трансмиокардиального канала, а также данными чреспищеводной эхокардиографии в виде пузырьков газа в полости Л.Ж. При этом нарушений ритма не возникало, а кровотечение из канала останавливалось самостоятельно либо прижатием марлевым тупфером или салфеткой в течение 2 мин. В плевральную полость устанавливался активный дренаж, и грудную клетку ушивали по стандартной методике.
У всех пациентов оценивали показатели госпитальной, отдаленной и общей летальности, а также динамику таких клинических параметров, как ФК стенокардии, потребность в приеме нитроглицерина, толерантность к физическим нагрузкам, сократимость миокарда, ФВ ЛЖ, перфузия миокарда. Динамику качества жизни определяли по анкетам SF-36, при этом оценивали психоэмоциональное и физическое состояние больных в различные сроки после операции. Рассчитывали показатели выживаемости, свободы от возврата стенокардии и инфаркта миокарда в отдаленные сроки.
Пациенты находились под клиническим наблюдением в ближайшем послеоперационном периоде (в стационаре или 30 дней амбулаторно) и отдаленном периоде: через 3, 6 и 12 мес после операции и далее выборочно до 10 лет после операции (в среднем через 7,5±0,9 года). В каждом интервале у больных оценивались основные неблагоприятные сердечные события, класс стенокардии, ФВ ЛЖ и необходимость повторных реваскуляризаций.
В первые часы после операции проводился инвазивный контроль гемодинамики, мониторинг ЭКГ, газового состава крови, кислотно-щелочного состояния и биохимических показателей, включая ферменты-маркеры некроза миокарда. Анализ ЭКГ в первые часы после ТМЛР показал, что, несмотря на воздействие лазера на миокард, данных за повреждение миокарда или его ишемию не выявлено.
Лазерная реваскуляризация миокарда
Это новый экспериментальный метод хирургического лечения ишемии сердца, выполняемый с помощью лазера. Через разрез на груди к сердцу подводят специальный проводник. Лазером делают отверстия в миокарде и создают каналы, через которые поступает кровь, насыщенная кислородом и питательными веществами. Спустя пару-тройку месяцев эти каналы закроются, а результат операции сохранится на несколько лет. Этот метод обычно применяют для лечения пациентов, которым невозможно провести аортокоронарное шунтирование.
Лазерная реваскуляризация коронарных артерий показана пациентам, имеющим атеросклеротическое поражение мелких сосудов. Таким лицам коронарное шунтирование не подходит.
В настоящее время эта методика все еще считается экспериментальной. Но несмотря на это, лазерная технология очень популярна. Данная процедура малотравматична, проводится на бьющемся сердце, редко приводит к развитию осложнений, имеет относительно короткий восстановительный период.
Модернизация оборудования и дополнительные исследования в области лечения пациентов с коронарной недостаточностью способствуют тому, что трансмиокардиальная лазерная реваскуляризация миокарда в ближайшем будущем может стать основным методом оперативного лечения ИБС.
Трансмиокардиальная лазерная реваскуляризация, мед. анимация
Показания для реваскуляризации
Восстановление кровоснабжения сердца хирургическим путем выполняют при отсутствии эффекта (или недостаточном эффекте) от приема медикаментозной терапии. Выбор методики реваскуляризации миокарда – это сложный, комплексный подход, основанный на оценке состояния пациента, особенности поражения коронарных артерий, сопутствующих заболеваниях, сложности послеоперационного периода и др.
Для определения показаний к выполнению того или иного метода лечения рекомендуется пройти полноценное кардиологическое обследование. Мы используем современные методики оборудования, что позволяет минимизировать риск осложнений после операций.
Если Вы обнаружили у себя некоторые, пускай даже незначительные, признаки сердечно-сосудистого заболевания, не откладывайте посещение врача на потом. Если у вас возникла необходимость кардиологу, сделать это можно в режиме «он-лайн» на нашем сайте.
Ударно-волновая терапия
Этот метод хирургического вмешательства является также экспериментальным. Так называемая «акустическая волна», направленная на сердце, стимулирует в миокарде рост новых артерий и капилляров в плохо кровоснабженной зоне миокарда.
Ударно-волновая терапия является абсолютно безболезненной и бескровной. В настоящее время данная методика практически не применяется. Это связано с отсутствием конкретной информации о результатах лечения и отзывов пациентов.
Коронарная реваскуляризация миокарда устраняет лишь последствия болезни, но не ее причину. Если пренебречь правильным питанием и продолжать употреблять в пищу жирные и сладкие блюда, разовьются новые осложнения атеросклероза, еще более тяжелые и опасные для жизни.