Врожденные пороки сердца – это целая группа заболеваний. В нее включены анатомические дефекты клапанов сердца и сосудов. Особенностью этих заболеваний является период возникновения, они появляются во время внутриутробного развития. Дефекты сосудов и клапанов приводят к нарушению гемодинамики во всем организме.
Группа врожденных пороков сердца характеризуется разнообразными симптомами. Наиболее характерными из них являются:
- бледность или синюшных кожных покровов;
- патологические шумы в сердце;
- отставание в физическом развитии;
- дыхательная недостаточность;
- сердечная недостаточность.
Для врожденных пороков сердца используются методы диагностики от ЭКГ до МРТ. Для лечения врожденных пороков сердца используются хирургические методики.
Частота встречаемости врожденных пороков сердца составляет от 0,8 до 1,2% у всех новорожденных. Кроме того, они составляют от 10 до 30% от всех врожденных аномалий. В большинстве случаев дети с подобными заболеваниями без лечения редко доживают даже до 3 лет.
Анатомия сердца
Перед тем как начать говорить о сердечных пороках, необходимо понять, как устроено сердце. У человека этот орган состоит из 4-х камер:
- правое предсердие;
- левое предсердие;
- правый желудочек;
- левый желудочек.
В правое предсердие впадают большая и малая полые вены, которые завершают большой круг кровообращения. Под ним располагается правый желудочек, который переходит в легочную артерию.
В левое предсердие впадают легочные вены, которые несут кровь, богатую кислородом от легких. Через отверстие с клапаном кровь попадает в левый желудочек, а затем – в аорту. Аорта является началом большого круга кровообращения, который насыщает все органы и системы питательными веществами и кислородом.
При врожденных пороках развития может нарушаться как состояние строения сердца и структуры, так и близлежащих к нему сосудов. Именно поэтому при рождении требуется комплексная диагностика для оценки состояния ребенка.
Какие заболевания входят в группу врожденных пороков сердца?
Наиболее распространенными врожденными пороками сердца являются:
- дефекты межжелудочковой перегородки (20%);
- дефекты межпредсердной перегородки (около 10–15%);
- стеноз аорты (около 10–15%);
- коарктация аорты (около 10–15%);
- открытый артериальный проток (около 10–15%);
- транспозиция крупных сосудов (магистральных) (около 10–15%);
- стеноз легочной артерии (около 10–15%).
Дефект межпредсердной перегородки (открытое овальное окно) – это патология, которая диагностируется при выявлении одного или нескольких отверстий в межпредсердной перегородке. Это заболевание является одним из самых распространенных у детей. Клинические признаки очень вариабельны и могут зависеть от локализации дефекта, его величины, а также силы тока крови. Достаточно часто дефект межпредсердной перегородки может проявляться при синдроме Дауна, а также сопровождать иные пороки сердца.
Дефект межжелудочковой перегородки (ДМЖП) – это патологическое состояние, при котором формируется отверстие между левым и правым желудочком сердца. Этот порок сердца может быть как изолированным, так и сочетаться с другими врожденными пороками сердца. Небольшой дефект может быть практически незаметен: ребенок растет и развивается с незначительным дефицитом. Симптомы заболевания наиболее выражены при крупном дефекте межжелудочковой перегородки. Однако, опасность заболевания заключается в том, что он может приводить к развитию легочной гипертензии. Это говорит о том, что дефект нуждается в хирургическом лечении в кратчайшие сроки.
Коарктация аорты – врожденный порок сердца, который наиболее характерен для мальчиков. Кроме того он редко бывает изолированным и часто сочетается с другими аномалиями развития. При этой патологии сужается участок аорты, что приводит к нарушению тока крови из левого желудочка в большой круг кровообращения. Это значит, что все органы и системы организма человека испытывают дефицит питания.
Открытый артериальный проток – диагностируется в тех случаях, когда не происходит заращение Боталлова протока. В норме он может определяться у новорожденных, однако, уже через небольшой промежуток времени после рождения он должен быть полностью закрыт. Боталлов проток не наносит никакого вреда ребенку в период внутриутробного развития, что связано с особенностями кровообращения. Однако, уже после рождения он становится причиной заброса крови из аорты в легочную артерию. При данной патологии редко наблюдаются серьезные клинические проявления. Однако, открытый артериальный проток также нуждается в хирургической коррекции, так как его наличие сопряжено с риском внезапной смерти.
Атрезия легочной артерии – при этой патологии происходит недоразвитие створок аортального клапана у новорожденного. Из-за этого часть крови забрасывается в правый желудочек. Это состояние в первую очередь приводит к недостаточному кровоснабжению легких. В то же время при регулярном растяжении правого желудочка произойдет деформация, которая приведет к явлениям правожелудочковой сердечной недостаточности.
Стеноз клапана легочной артерии – при этой патологии происходит сужение просвета артерии, которая несет кровь к легким. В результате нарушается ток крови из правого желудочка в малый круг кровообращения от чего страдают легкие.
Тетрада Фалло – это сложный сочетанный врожденный порок сердца. Он включает в себя дефект межжелудочковой перегородки, стеноз легочной артерии, гипертрофию правого желудочка, а также декстрапозицию аорты. Эта патология опасна тем, что происходит постоянно смешение артериальной и венозной крови, в это значит, что организм живет в состоянии постоянного дефицита кислорода.
Транспозиция магистральных сосудов является еще одним сложным врожденным пороком сердца. При этом аорта отходит от правого желудочка, а легочный ствол – от левого. Поэтому по аорте течет венозная кровь, а по легочному стволу – артериальная. Порок протекает крайне тяжело, поэтому наблюдается высокая смертность среди новорожденных.
Декстрокардия – это патология внутриутробного развития, при которой сердце размещено в правой половине грудной клетки. Эту патологию часто сопровождает «зеркальное» расположение органов: другие непарные органы также располагаются на противоположной от нормы стороне.
Аномалия Эбштейна – этот врожденный порок сердца встречается достаточно редко. Основанием для установления диагноза является изменение расположения створок трехстворчатого клапана. В норме створки клапана идут от предсердно-желудочкового предсердно-фиброзного кольца. При аномалии Эбштейна они начинаются непосредственно от стенок правого желудочка. При этом пороке также наблюдается уменьшение размеров правого желудочка, а также удлинение правого предсердия.
Все это говорит о том, что врожденные сердечные патологии крайне разнообразны. А это значит, что подход к диагностике и лечению должен быть индивидуальным для каждого новорожденного.
Возможности эхокардиографии плода в I триместре беременности (11-14 недель)
УЗИ сканер WS80
Идеальный инструмент для пренатальных исследований.
Уникальное качество изображения и весь спектр диагностических программ для экспертной оценки здоровья женщины.
Введение
Актуальность темы пренатальной диагностики врожденных пороков сердца (ВПС) понятна всем врачам, которые связаны с пренатальной диагностикой, неонатологией, педиатрией, кардиологией, генетикой. ВПС являются одной из ведущих причин перинатальной смертности и регистрируются с частотой 4-13 на 1000 живорожденных [1]. В связи с тем, что профилактические мероприятия по предупреждению ВПС не имеют должного успеха, представляется актуальной и необходимой их пренатальная ультразвуковая диагностика.
В многочисленных исследованиях зарубежных и отечественных коллег неоднократно формулировались и изучались различные группы риска по возникновению ВПС. Это делалось для того, чтобы потенциально сузить группу беременных женщин, которым показана эхокардиография в специализированном центре. Среди этих групп риска выделяли:
- Семьи, имеющие ребенка с ВПС.
- Семьи с ВПС у одного или обоих супругов.
- Женщин, страдающих сахарным диабетом, системными заболеваниями соединительной ткани, гипотиреозом.
- Беременных с тератогенной экспозицией в ранние сроки беременности (герпес ранее 6-7-й недели) [2].
Однако параллельно другими учеными эти группы риска отвергались, потому что большинство ВПС встречались у плодов и детей, матери которых не входили ни в одну из предложенных групп риска. Единственными разумными критериями так называемого селективного отбора были признаны беременные, попавшие в группу риска после проведения скрининга I триместра и беременные с подозрением на ВПС при ультразвуковом исследовании (УЗИ) плода [3].
Неоспоримо, что оптимальными сроками беременности для исследования сердца плода являются 20-22 недели, однако большинство летальных и клинически значимых пороков сердца могут быть диагностированы в конце I триместра беременности. Позволим себе процитировать слова главы Fetal Medicine Foundation Кипраса Николаидеса, высказанные им на страницах сайта FMF (www.fetalmedicine.com): «Специалист ультразвуковой диагностики с 12 недели беременности должен заверить большинство родителей, что у их ребенка нет крупных врожденных пороков сердца. В случае крупных врожденных пороков сердца их раннее выявление может привести к постановке правильного диагноза или хотя бы вызвать подозрение для осуществления ультразвукового мониторинга».
Главная цель пренатальной диагностики сформулирована специалистами пренатальной диагностики всего мира — это обеспечение женщины максимально возможной информацией о пороке как можно раньше. Мы должны дать право женщине и семье в целом решать вопрос о пролонгировании беременности с грубыми пороками развития у плода [4].
С каждым годом все большее количество публикаций посвящается диагностике ВПС в ранние сроки — в I триместре беременности [5-8]. Практически ни один из выпусков журнала ISUOG (Ultrasound In Obstetrics and Gynecology, или «белого» журнала, как его называют специалисты) не обходит своим вниманием тему ранней диагностики врожденных пороков развития.
На самом знаменитом сайте в мире пренатальной диагностики www.thefetus.net (Philippe Jeanty, USA) опубликовано уже более 30 случаев находок ВПС в I триместре беременности. Однако в отечественной периодике встречаются лишь единичные работы по этой теме. Все они пренадлежат «перу» специалистов пренатальной диагностики Российской ассоциации врачей ультразвуковой диагностики в перинатологии и гинекологии, хотя для многих специалистов как раньше, так и сейчас осмотр сердца плода в сроки 11-14 недель заключается лишь в констатации числа сердечных сокращений.
Цель эхокардиографии в I триместре беременности состоит в выявлении летальных и клинически значимых ВПС. Это исследование не ставит целью выявление стенозов и гипоплазий выносящих трактов, диагностику мелких дефектов перегородок, патологий дуги аорты и артериального протока. Многие из этих пороков не только технически невозможно заподозрить в I триместре, манифестируют они после 30-й недели беременности, т.е. их диагностика является прерогативой исследования III триместра.
Точность пренатальной диагностики ВПС во все сроки беременности варьирует в широком диапазоне. Причинами этого могут быть разный опыт специалистов, ожирение беременной, частота использованных ультразвуковых трансдьюсеров и класс ультразвукового аппарата, перенесенные ранее абдоминальные операции, срок беременности, количество околоплодных вод и положение плода. Однако заметим, что многие из этих факторов теряют свою актуальность именно при проведении трансвагинальной эхокардиографии в I триместре беременности. Своевременная диагностика ВПС позволяет идентифицировать плоды высокого риска по генетическим синдромам, что имеет важное значение при проведении пренатального консультирования и оказывает существенное влияние на акушерскую тактику.
Результаты
С 2006 по 2011 г. пренатально в I триместре беременности были выявлены 125 ВПС. Из них 68 (55%) ВПС сочетались с различными хромосомными аномалиями (ХА) плода, 30 (24%) входили в состав различных множественных врожденных пороков развития (МВПР), 27 (21%) ВПС были изолированными.
При эхокардиографии изучались четырехкамерный срез сердца плода (рис. 1) и срез через три сосуда (рис. 2). УЗИ проводилось трансабдоминальным датчиком, лишь при необходимости (затрудненная визуализация) использовался внутриполостной датчик. Четырехкамерный срез сердца плода при ультразвуковом сканировании трансабдоминальным датчиком визуализировался в 85% случаев, срез через сосуды — в 73%, при использовании трансвагинального датчика эти цифры существенно возрастали до 100 и 91% соответственно. Оптимизация пренатальной диагностики ВПС может быть достигнута путем строгого соблюдения основных методических правил. При оценке четырехкамерного среза плода необходимо оценить нормальное расположение сердца плода, исключив его эктопию (рис. 3), положение оси сердца плода, что не представляет никаких трудностей, нормальные пропорции и размеры камер сердца, движение створок атриовентрикулярных клапанов должно быть свободным, септальная створка трикуспидального клапана должна располагаться ближе к верхушке сердца (рис. 4). При оценке среза через три сосуда необходимо оценить взаиморасположение сосудов и их диаметр.
Рис. 1.
Беременность 12 недель. Четырехкамерный срез сердца плода. Отчетливо видны камеры сердца.
Рис. 2.
Беременность 12 недель. Срез через три сосуда. Визуализируются аорта, легочной ствол. Сосуды расположены в одну линию и имеют нормальные размеры.
Рис. 3.
Беременность 8 недель. Эктопия сердца. Сердце расположено снаружи грудной полости.
Случай опубликован на сайте www.thefetus.net.
Рис. 4.
Беременность 13 недель. Четырехкамерный срез сердца плода. Отчетливо видны камеры сердца. Положение атриовентрикулярных клапанов.
Расширенная эхокардиография предполагает применение дополнительных режимов и срезов — среза через дугу аорты (рис. 5), среза через выносящий тракт левого желудочка (рис. 6), режима ЦДК (рис. 7), импульсной допплерометрии, технологии STIC (рис. 8-11). Это обследование проводится при обнаружении аномальных скрининговых проекций сердца плода, маркеров ХА [расширение толщины воротникового пространства — ТВП, гипоплазия/отсутствие носовой кости (рис. 12, 13), регургитации в венозном протоке (рис. 14), трикуспидальной регургитации (рис. 15)] и/или врожденных пороков развития плода.
Рис. 5.
Беременность 13 недель. Срез через дугу аорты. Отчетливо видны три плечеголовных сосуда, отходящих от дуги.
Рис. 6.
Беременность 12 недель. Тетрада Фалло. Режим ЦДК. Срез через выносящий тракт левого желудочка. Видна «аорта-наездница», сидящая над ДМЖП. Случай опубликован на сайте www.thefetus.net.
Рис. 7.
Беременность 13 недель. Двойной выход сосудов из правого желудочка. Режим ЦДК. Параллельный выход сосудов из правого желудочка.
Рис. 8.
Беременность 12 недель. Атриовентрикулярная коммуникация (АВК) при синдроме Дауна. Режим STIC.
Рис. 9.
Беременность 12 недель. Тетрада Фалло. Режим STIC. Аорта «наездница», сидящая над ДМЖП. Случай опубликован на сайте www.thefetus.net.
Рис. 10.
Беременность 13 недель. Транспозиция магистральных сосудов. Режим STIC. Виден параллельный ход выносящих сосудов, верхний из которых выходит из левого желудочка и делится на бифуркацию (легочная артерия).
Рис. 11.
Беременность 12 недель. Общий артериальный ствол. Режим STIC. Виден единый выносящий сосуд из двух желудочков.
Рис. 12.
Беременность 11,4 недель. Множественные маркеры ХА. Синдром Патау (трисомия 13). Увеличение ТВП, аномальный профиль с гипоплазией носовой кости, протуберансом на верхней челюсти (признак расщелины лица), полидактилия. У плода выявлена гипоплазия левых отделов сердца.
Рис. 13.
Беременность 12 недель. Множественные маркеры ХА. Синдром Дауна (трисомия 21). Увеличение ТВП, аномальный профиль с гипоплазией носовой кости. У плода выявлена АВК.
Рис. 14.
Беременность 12 недель. Реверсный кровоток в венозном протоке у плода с гетеротаксией.
Рис. 15.
Беременность 12 недель. Трикуспидальная регургитация у плода с общим артериальным стволом.
Нозология выявленных нами ВПС была следующей:
- синдром гипоплазии левых отделов сердца (СГЛОС) — 29 случаев (рис. 16);
- атриовентрикулярная коммуникация (АВК) — 23 (рис. 17, 18);
- дефект межжелудочковой перегородки (ДМЖП) — 19 (рис. 19);
- патология магистральных сосудов — 19 (из них транспозиция — 3, двойное отхождение сосудов из правого желудочка — 2, тетрада Фалло — 5, общий артериальный ствол — 9);
- патология правых отделов сердца (патология трикуспидального клапана) — 3;
- синдром гетеротаксии — 6;
- единственный желудочек — 4;
- эктопия сердца — 7;
- сочетанные формы ВПС встретились в 15 случаях.
Рис. 16.
Беременность 13 недель. Синдром гипоплазии левых отделов сердца у плода с синдромом Тернера (45Х). Единый поток через трикуспидальный клапан. Сброс крови в гипоплазированный левый желудочек через ДМЖП.
Рис. 17.
Беременность 11,4 недель. Четырехкамерный срез сердца. Единый атриовентрикулярный клапан. Отсутствует «крест» нормального взаимоотношения атриовентрикулярных клапанов и сердечных перегородок.
Рис. 18.
Беременность 11,4 недель. Четырехкамерный срез сердца. Режим ЦДК. Единый атриовентрикулярный клапан.
Рис. 19.
Беременность 12 недель. Режим ЦДК. Обширный ДМЖП у плода с синдромом Эдвардса (трисомия 18).
При кариотипировании плодов с пренатально установленным диагнозом ВПС в 11-14 недель было диагностировано 68 хромосомных аномалий:
- трисомия 21 (синдром Дауна) выявлена в 23 (34%) случаях,
- трисомия 18 (синдром Эдвардса) — в 19 (28%);
- трисомия 13 (синдром Патау) — в 7 (10%);
- моносомия Х (синдром Тернера) — в 6 (9%);
- триплоидия — в 8 (12%);
- другие хромосомные дисбалансы — в 5 (7%).
Особо следует отметить, что в 8 случаях обнаруженных ХА показанием к кариотипированию было выявление ВПС. У этих плодов было нормальное значение как ТВП, так и длины носовой кости.
При ХА выявленные ВПС по нозологии имели следующие особенности: у большинства плодов с синдромом Дауна диагностировались АВК и ДМЖП; с синдромом Патау — СГЛОС и ДМЖП; с синдромом Эдвардса — ДМЖП, тетрада Фалло и ОАС; при синдроме Тернера — СГЛОС и патология аорты — коарктация аорты в типичном месте (рис. 20).
Рис. 20.
Беременность 12 недель. Срез через дугу аорты. Режим ЦДК. Сужение аорты в «типичном» месте у плода с синдромом Тернера (45Х).
Необходимо отдельно рассмотреть вопрос верификации ультразвукового диагноза. Все беременности с изолированными ВПС в I триместре пролонгировались до срока II триместра, когда возможна 100% морфологическая верификация диагноза. В современных условиях верификация диагнозов после прерывания беременности в I триместре представляет довольно значимую проблему. Однако при специализированном обучении специалистов-морфологов верификация ВПС возможна и при прерывании беременности в I триместре (рис. 21, 22). Это, несомненно, зависит от качества полученного материала, квалификации морфолога и специального оборудования, необходимого в некоторых случаях, а также от общих методологических подходов к анатомо-морфологической диагностике независимо от срока гестации.
Рис. 21.
Беременность 13 недель. Увеличенная ТВП у плода с гипоплазией левых отделов сердца.
Рис. 22.
Тот же плод. Морфологическое обследование — гипоплазия восходящей аорты и кистозные полости (отмечены стрелками).
Заключение
Из сказанного выше можно сделать следующие выводы.
Сердце плода необходимо оценивать у всех беременных при скрининговом осмотре в I триместре (11-14 нед). Так как современная концепция развития пренатальной диагностики в рамках «пилотного» проекта МЗ РФ подразумевает скрининговое обследование в I триместре врачом-экспертом, именно он и должен оценить сердце плода и заподозрить ВПС уже в конце I триместра беременности.
Для исключения летальной и клинически значимой сердечной патологии в I триместре обязательна оценка четырехкамерной проекции сердца плода и среза через три сосуда.
Расширенная эхокардиография должна проводиться при обнаружении аномальных скрининговых проекций сердца плода, маркеров ХА и/или ВПР плода.
При выявлении ВПС в I триместре показано кариотипирование плода.
Литература
- Office for National Statistics. Mortality Statistics. Childhood, Infancy and Perinatal. Series DH3. Stationary Office: London, 2007; 40.
- Новикова И.В., Прибушеня О.В., Румянцева Н.В. Формирование групп риска по дородовой диагностике врожденных пороков сердца. Инструкция по применению. Минск, 2004.
- Carvalho J.S., Moscoso G., Tekay A. et al. Clinical impact of first and early second trimester fetal echocardiography on high risk pregnancies. Heart. 2004; 90: 921-926.
- Becker R., Wegner R.-D. Detailed screening for fetal anomalies and cardiac defects at the 11-13 week scan. Ultrasound Obstet Gynecol 2006; 27; 613-618.
- Allan L.D., Sharland G.K., Milburn A. et al. Prospective diagnosis of 1,006 consecutive cases of congenital heart disease in the fetus. J Am Coll Cardiol 1994; 23: 1452-1458.
- Huggon I.C., Ghi T., Cook A.C. et al. Fetal cardiac abnor-malities identified prior to 14 weeks’ gestation. Ultrasound. Obstet. Gynecol. 2011; 20: 22-29.
- Persico N., Moratalla J., Lombardi C.M. et al. Fetal echocardiography at 11-13 weeks by transabdominal high-frequency ultrasound Ultrasound Obstet. Gynecol. 2011; 37: 296-301
- Allan L.D. Echocardiographic detection of congenitalheart disease in the fetus: present and future. Br. Heart. J. 1995; 74: 103-106.
УЗИ сканер WS80
Идеальный инструмент для пренатальных исследований.
Уникальное качество изображения и весь спектр диагностических программ для экспертной оценки здоровья женщины.
Аневризма межпредсердной перегородки (АМПП)
Аневризма межпредсердной перегородки – еще один врожденный порок развития. Достаточно часто это состояние наблюдается у вполне здоровых детей: с возрастом образование самостоятельно исчезает. Однако, аневризма межпредсердной перегородки представляет существенную опасность в тех ситуациях, когда она сочетается с другими врожденными пороками сердца, а также не исчезает самостоятельно.
Аневризма межпредсердной перегородки по своей сути представляет выпячивание стенки предсердия в одну из сторон. Наиболее часто аневризма выпячивается в сторону открытого овального окна (или того места, где оно располагалось). Это связано с тем, что сердечная мышца в этом месте еще недостаточно прочная и легко деформируется под воздействием внешних факторов. Овальное окно – это необходимость для ребенка в период внутриутробного развития, так как кровеносная система функционирует особым образом. Легочное дыхание у ребенка в утробе матери отсутствует, поэтому овальное окно способствует равномерному распределению крови в правом и левом предсердии, большом и малом круге кровообращения. Так органы ребенка получают достаточное питание и кислород. Однако, после рождения большой и малый круг должны быть изолированы друг от друга. Это необходимо для того, чтобы венозная и артериальная кровь не смешивались.
Однако, во врачебной практике нередки случаи, когда овальное окно остается открытым длительное время (более 12 месяцев). Давление тока крови приводит к тому, что стенка миокарда деформируется и выпячивается. Аневризма образуется в «слабом» месте, именно по этой причине она чаще всего образуется в сочетании с другими сердечными пороками.
Аневризма межпредсердной перегородки классифицируется в зависимости от направления выпячивания:
- аневризма межпредсердной перегородки с выпячиванием в правое предсердие;
- аневризма межпредсердной перегородки с выпячиванием в левое предсердие;
- аневризма межпредсердной перегородки с S-образным выпячиванием (разные части перегородки выбухают в разные предсердия).
Прогноз считается благоприятным в том случае, если не происходит перераспределения тока крови в предсердиях. Если же в легочном стволе нарастает кровяное давление, то развивается легочная гипертензия.
Наиболее частыми причинами развития патологии являются:
- инфекционные заражения матери во время беременности;
- плохая экологическая обстановка;
- стрессы матери во время беременности;
- авитаминоз во время беременности;
- гипоксия плода.
Возможно ли развитие аневризмы межпредсердной перегородки у взрослых? Да, это одно из главных отличий этой патологии от других врожденных пороков сердца. Однако, это состояние все же крайне редко развивается у взрослых: только после перенесенного обширного инфаркта миокарда.
При отсутствии сочетания АМПП с другими пороками сердца существенные нарушения умственного и физического развития отсутствуют, а клинические симптомы выражены слабо. А вот при сочетании этой патологии с другими пороками могут наблюдаться такие проявления, как:
- тахикардия (повышение частоты сердечных сокращений);
- акроцианоз (синюшность кожи в носогубном треугольнике);
- одышка (у младенцев может наблюдаться при кормлении грудью);
- плаксивость, беспокойство младенца;
- нарушения сна.
В более старшем возрасте могут наблюдаться такие проявления, как:
- увеличение частоты сердечных сокращений;
- боль в груди в области сердца;
- повышенная утомляемость;
- ощущение слабости;
- головокружение;
- потеря аппетита;
- сонливость и др.
Основным способом выявления патологии у ребенка является УЗИ сердца. Альтернативное название манипуляции – ЭХО-кардиография. Данная процедура абсолютно безболезненна и безопасна, поэтому является методикой выбора при диагностике многих врожденных патологий сердца. Для того чтобы увеличить информативность исследования, необходимо использовать современные аппараты УЗИ, а прием должны вести опытные специалисты, которые способны заметить даже небольшие нарушения гемодинамики. Такой подход позволяет обеспечить достоверную диагностику патологий даже у самых маленьких пациентов.
Нетяжелые формы аневризмы межпредсердной перегородки чаще всего не требуют специального лечения. Однако, ребенок все же нуждается в регулярном наблюдении специалиста: следует посещать кардиолога не реже 1 раза в 12 месяцев, а также регулярно проходить УЗИ сердца.
Кроме того, детям рекомендуются легкие, незначительные физические нагрузки, а также психоэмоциональный покой. Ребенку необходимо обеспечить полноценное, рациональное питание, а также необходимый (по возрасту) сон. Кроме того, для детей с АМПП очень полезны сеансы психотерапии и аутотренинги.
Пороки сердца у детей
Пороки сердца являются нередкой патологией у детей. Частота пороков у детей в последние годы увеличивается. Консультация и осмотр детского кардиолога — детская поликлиника «Маркушка».
Врожденные пороки сердца у детей, ребенка
Частота врожденных пороков сердца (ВПС) у новорожденных детей составляет 0,8 %, они широко варьируют по анатомическим особенностям и тяжести течения. Клинические проявления ВПС у детей разнообразны и определяются тремя основными факторами: анатомическими особенностями порока, степенью компенсации и возникающими осложнениями.
ВПС у ребенка можно заподозрить, если у него выявляются: цианоз или выраженная бледность, гипотрофия, частые простудные заболевания, недостаточная переносимость адекватных по возрасту физических нагрузок (быстрая утомляемость при кормлении грудью, при подвижной игре, появление одышки при подъеме даже на один пролет лестницы и др.), увеличение размеров сердца, изменение тонов сердца, появление шумов в сердце, изменение пульса на руках, слабый пульс на бедренной артерии или его отсутствие, изменение артериального кровяного давления, деформация грудной клетки, нарушения ритма сердца, любые патологические изменения ЭКГ, необычные изменения, выявляемые на рентгенограмме грудной клетки и др.
Врожденные пороки сердца с обогащением малого круга кровообращения
Дефект межпредсердной перегородки (ДМПП) является одним из распространенных ВПС. В 10—20 % случаев ДМПП сочетается с пролапсом митрального клапана.
Гемодинамика при ДМПП определяется сбросом артериальной крови слева направо, что приводит к увеличению минутного объема малого круга кровообращения. В образовании шунта имеют значение разница давления между правым и левым предсердием, более высокое положение последнего, большая растяжимость правого желудочка и площадь правого атриовентрикулярного отверстия, сопротивление, объем сосудистого ложа легкого. Развитие легочной гипертензии и поражение сосудистого русла легких приводят к обратному шунтированию крови и появлению цианоза. При первичных дефектах часто наблюдается митральная недостаточность.
В отличие от дефектов межжелудочковой перегородки, при которых значительный сброс приводит к объемной перегрузке обоих желудочков, при ДМПП сброс крови меньше и влияет только на правые отделы сердца.
При выраженном сбросе у больных наблюдаются отставание в весе и склонность к повторным респираторным заболеваниям и пневмониям в первые годы жизни. Как правило, в этих случаях имеются жалобы на одышку, утомляемость, боли в сердце.
Дефект межжелудочковой перегородки (ДМЖП) является одним из наиболее часто встречающихся ВПС. На его долю приходится от 17 до 30 % случаев сердечных аномалий.
Выделяются три типа развития ДМЖП в зависимости от особенностей гемодинамики порока (величины лево-правого шунта), определяющих клинические проявления и прогноз заболевания.
Первый тип — имеется маленький дефект в перегородке (менее 0,5 см2/м2), малый сброс крови (< 25% ударного объема) не вызывает изменений давления в правом желудочке и малом круге кровообращения, легочная гипертензия не развивается. Клинические проявления отсутствуют. Дети с таким пороком не нуждаются в систематическом лечении.
Второй тип — средней величины дефект (0,5—1 см2/м2) приводит к большему сбросу крови в правый желудочек (< 50 % ударного объема) и среднему повышению давления в малом круге кровообращения. При этом типе ДМЖП мало выражены клинические признаки порока и не возникает проблем с лечением. Могут наблюдаться отставание в физическом развитии, застойная сердечная недостаточность, рецидивирующие нижнедолевые пневмонии. Оперируют таких детей в дошкольном возрасте.
Третий тип — большой дефект (более 1 см2/м2), когда сброс крови в правый желудочек превышает 50 % ударного объема. Характеризуется частыми бронхолегочными заболеваниями, нарушениями роста и признаками сердечной недостаточности, при выраженности которых прибегают к радикальной или паллиативной операции. При высоком легочном сопротивлении могут наблюдаться одышка в покое и при физической нагрузке, боли в груди, цианоз, кровохарканье. Большинство больных умирает в детском и подростковом возрасте.
Большинство дефектов межжелудочковой перегородки имеют малый размер и представляют риск в отношении инфекционного эндокардита.
Открытый аортальный проток у детей, ребенка
Артериальный (боталлов) проток соединяет легочную артерию и аорту непосредственно за левой подключичной артерией. Функциональное закрытие открытого аортального протока у доношенных детей происходит через 10—15 ч. после родов, облитерация протока — через несколько недель жизни. У недоношенных детей ОАП может функционировать от нескольких недель до месяца. У доношенных детей он остается открытым при структурных аномалиях, у недоношенных тем чаще, чем более незрелый ребенок, хотя спонтанное закрытие встречается часто.
При ОАП наблюдается сброс крови из аорты в легочную артерию из-за более высокого давления в аорте, что приводит к переполнению малого круга кровообращения и перегрузке левых камер сердца. При развитии легочной гипертензии присоединяется перегрузка и правого желудочка. Диаметр и длина протока определяют тяжесть сопутствующих гемодинамических нарушений, которые аналогичны таковым при ДМЖП различных размеров.
Обычно клинические проявления порока возникают в конце 1-го или на 2-3-м году жизни. Дети до появления клинических симптомов порока развиваются физически и нервнопсихически нормально, а первая фаза течения порока у части из них протекает легко. Ранние клинические признаки порока возникают при широких протоках.
Полная транспозиция магистральных сосудов у детей, ребенка
Полная транспозиция магистральных сосудов (ТМС) — аорта отходит от правого желудочка, легочная артерия — от левого, при этом образуются два отдельных и независимых друг от друга круга кровообращения. Жизнь ребенка после рождения возможна только при наличии компенсирующих коммуникаций. Этот порок сердца представляет собой основную причину смерти в первые два месяца жизни среди других ВПС.
Врожденные пороки сердца с обеднением малого круга кровообращения
Стеноз легочной артерии (СЛА) обусловлен чаще стенозом клапанов легочной артерии, реже — под- и надклапанным стенозом, стенозом ветвей легочной артерии. Подклапанный стеноз чаще является частью сложного ВПС.
Препятствие оттоку крови из правого желудочка в легочную артерию обусловливает повышение систолического давления и гипертрофию правого желудочка. Величина градиента давления зависит от размера отверстия клапанного кольца.
У большинства детей до года и старше заболевание протекает бессимптомно, хотя в некоторых случаях отмечается небольшая утомляемость.
Незначительный или умеренный СЛА может ничем не проявляться. При выраженном стенозе наблюдаются одышка, боли в сердце, бледность.
Тетрада Фалло
Тетрада Фалло характеризуется большим дефектом межжелудочковой перегородки, расположением аорты над местом дефекта, гипертрофией правого желудочка и стенозом легочной артерии.
Вследствие больших размеров ДМЖП систолическое давление одинаково в обоих желудочках и аорте. Степень обструкции правого желудочка определяет направление и объем сброса крови. В большинстве случаев он достаточно велик, чтобы преодолеть системное сопротивление и вызвать сброс справа налево и развитие цианоза. Размеры ДМЖП имеют второстепенное значение, так как его диаметр в основном равен диаметру устья аорты.
Различаются две основные формы ТФ. При крайнем варианте тетрады Фалло по типу общего ложного артериального ствола легочный ствол не работает, состояние ребенка тяжелое, наблюдается выраженное нарушение гемодинамики. Дети в 80 % случаев погибают на первом месяце жизни без оперативного вмешательства.
При классическом варианте тетрады Фалло имеются стеноз легочной артерии (чаще клапанный и выхода из правого желудочка), дефект межжелудочковой перегородки (мембранозная часть), декстрапозиция аорты (аорта над дефектом межжелудочковой перегородки), вторичная гипертрофия правого желудочка.
Дети отстают в физическом развитии, для них характерны одышка (при кормлении или движении ребенка), цианоз, деформация пальцев рук и ног («барабанные палочки»). Приступы усиливающегося цианоза с углублением дыхания — одышечно-цианотические — развиваются у детей до года и у детей младшего возраста. Прогноз неблагоприятный вследствие развития осложнений цианоза и полицитемии, таких как инсульт и абсцесс головного мозга. Часто развивается инфекционный эндокардит.
Врожденные пороки сердца с обеднением большого круга кровообращения
Коарктация аорты (КА). Сужение наблюдается ниже отхождения от аорты левой подключичной артерии. Хотя сужения могут локализоваться в любом участке, начиная от дуги и заканчивая бифуркацией аорты, в 98 % случаев они находятся в области ответвления артериального протока. При предуктивном стенозе (инфантильная форма) сужение наблюдается до ОАП, эта форма сочетается с другими пороками: ДМЖП, двустворчатым клапаном аорты, транспозицией магистральных сосудов и др.
Клинические проявления порока имеют место уже в период новорождения. Симптомы у детей первого года жизни характерны для сердечной недостаточности. Часто отмечаются затруднения при кормлении и низкий прирост массы тела. У детей старшего возраста заболевание обычно протекает бессимптомно, хотя возможно наличие небольшой утомляемости или слабости в ногах при беге.
Классическими признаками КА являются разные на руках и ногах пульс и артериальное давление: артериальная гипертензия на верхних конечностях и отсутствие или ослабление пульса на артериях ног и значительно более низкое АД на ногах, чем на руках (в норме на ногах АД на 10-20 мм рт. ст. выше, чем на руках). Выражена пульсация сосудов верхней половины тела, определяется приподнимающий левожелудочковый толчок. Границы сердца расширены влево.
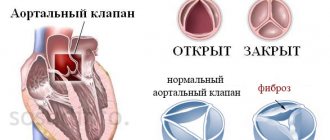
Аортальный стеноз у детей, ребенка
Аортальный стеноз (АС) составляет около 5 % от всех ВПС у детей. Чаще распространен клапанный стеноз (около 80 %), реже (20 %) встречаются подклапанный и надклапанный варианты аортального стеноза. Аномалия строения аортального клапана (двустворчатость) относится к основным врожденным порокам сердца у взрослых. Течение и прогноз порока определяются его локализацией и выраженностью, сочетанием с другими пороками сердца и фиброэластозом, сопутствующим поражением миокарда.
При выраженном стенозе уже в грудном возрасте появляются признаки тяжелой левожелудочковой недостаточности, однако в большинстве случаев порок выявляется в школьном возрасте. Больные жалуются на утомляемость, одышку, боли в области сердца, головокружения, обморочные состояния.
Приобретенные пороки сердца у детей, ребенка
Приобретенные пороки сердца — приобретенные морфологические изменения клапанного аппарата, ведущие к нарушению его функции и гемодинамики. Чаще всего они возникают в результате перенесенного ревматизма, инфекционного эндокардита, системных заболеваний соединительной ткани, травмы, пролапса митрального клапана (ПМК).
Недостаточность митрального клапана у ребенка, детей
Недостаточность митрального (двустворчатого) клапана развивается при поражении его створок, а также подклапанного аппарата. Возникает как осложнение ревматизма, инфекционного эндокардита, системных заболеваний соединительной ткани, в результате травмы, ПМК, патологии клапанного аппарата: разрыва хорд, разрыва или дисфункции папиллярных мышц, дилатации митрального кольца или полости левого желудочка и др.
Жалоб дети могут не предъявлять. При длительно существующей недостаточности клапана может сформироваться выбухание левой половины грудной клетки — сердечный горб.
Митральный стеноз может быть первичным (при латентно или подостро текущем ревматизме) или вторичным, возникающим на фоне недостаточности митрального клапана. Врожденный митральный стеноз проявляется сердечной недостаточностью в грудном и раннем детском возрасте.
Давление в левом предсердии повышается, развивается его гипертрофия, ускоряется кровоток в левый желудочек из-за сужения митрального отверстия до 1-1,5 см2 (в норме площадь митрального отверстия 4-6 см2). Высок риск инфекционного эндокардита при любом поражении клапанов. При тяжелом митральном стенозе (площадь митрального отверстия <1 см2 давление в левом предсердии превышает 25 мм рт. ст., что приводит к легочной гипертензии и в покое. При развернутой клинической картине дети жалуются на одышку и быструю утомляемость (одышка при нагрузке возникает, когда площадь отверстия клапана уменьшается вдвое (< 2 см2). Мерцательная аритмия, инфекции и инфекционный эндокардит могут при тяжелом митральном стенозе вызвать отек легких.
Недостаточность аортального клапана у детей, ребенка
Чаще всего недостаточность аортального клапана возникает в результате деформации аортальных клапанов при ревматизме (почти всегда сочетается с поражением митрального клапана), вследствие инфекционного эндокардита, миксоматозной дегенерации клапанов, травмы, наследственных заболеваний соединительной ткани, врожденного двустворчатого клапана и др.
При недостаточности аортального клапана часть крови возвращается во время диастолы из аорты в левый желудочек, в результате чего мышечные волокна левого желудочка растягиваются и гипертрофируются.
Больные жалуются на одышку и сердцебиение, возникающие при физической нагрузке, нередко — на боли в области сердца. Кожные покровы бледные, нередко отмечается усиленная пульсация сонных артерий (пляска каротид). Пульс скорый и высокий, реже можно отметить появление капиллярного пульса.
Стеноз устья аорты у детей, ребенка
Чаще всего стеноз устья аорты возникает в результате деформации и развития фиброза и кальциноза двустворчатого аортального клапана, вследствие перенесенного ревматизма (почти всегда сочетается с поражением митрального клапана), изолированного кальциноза аортальных клапанов, инфекционного эндокардита с массивными вегетациями, травмы.
При стенозе устья аорты гемодинамика обусловлена сужением выходного тракта левого желудочка и увеличением нагрузки на левый желудочек (систолическая перегрузка). При легкой степени стеноза площадь отверстия аортального клапана равна 1,2-2 см2, при умеренном стенозе — 0,75-1,2 см2, при тяжелом стенозе <0,75 см2. 15-20 % больных при наличии симптомов стеноза аорты умирают внезапно.
Пролапс митрального клапана у детей, ребенка
Пролапс митрального клапана (ПМК) — это прогибание митральных створок в полость левого предсердия во время систолы левого желудочка. Этот синдром чаще связан с аномалией строения клапана, при которой одна из его створок (чаще задняя) или обе провисают в конце систолы в полость левого предсердия. ПМК может быть первичным (идиопатическим) и вторичным (в результате врожденных или приобретенных заболеваний).
Среди врожденных заболеваний ПМК чаще сочетается с наследственно обусловленными заболеваниями соединительной ткани (синдромы Марфана, Элерса-Данлоса, Холта-Орама и др.). У больных при этом часто наблюдаются астеническое телосложение, сколиоз, плоскостопие, вальгусная деформация стоп, расслабление связок. В возникновении ПМК определенную роль играет состояние подклапанного аппарата — удлинение или аномалии прикрепления хорд, форма створок клапана. ПМК возникает при патологических изменениях его створок и клапанных хорд, дисфункции папиллярных мышц, нарушениях сократимости левого желудочка при ревматизме, неревматическом кардите, бактериальном эндокардите, кардиомиопатиях, ВПС. ПМК часто сопутствует нейроциркуляторной дистонии и функциональной кардиопатии, при которых имеет место преобладание симпатического или парасимпатического отдела вегетативной нервной системы. В генезе его большую роль играет наследственная предрасположенность.
Дети с ПМК особых жалоб не предъявляют, поэтому болезнь обычно выявляется случайно. Иногда отмечаются боли в сердце, головокружение, обмороки (ээг ребенку — поликлиника «Маркушка»), что обусловлено вегетативными сдвигами, часто снижением АД.
Причины появления врожденных пороков сердца
Повлиять на развитие врожденных пороков сердца может большое количество факторов. Среди них:
- хромосомные нарушения (5%);
- генные мутации (2–3%);
- влияние факторов окружающей среды (1–2%).
Чаще всего основной причиной врожденных пороков является полигенно-мультифакториальная предрасположенность (около 90%).
Хромосомные нарушения
Могут проявляться качественным (изменением структуры) или количественным (изменением количества) хромосом. Они приводят к множественным аномалиям в организме, в том числе затрагивают сердце. Например, трисомия аутосом чаще всего приводит к дефектам межпредсердной и межжелудочковой перегородок, а также их сочетаниям. Если аномалии затронули половые хромосомы, то преимущественно возникают коарктация аорты или дефект межжелудочковой перегородки.
Генные мутации
Генные мутации являются следствием точечных изменений в геноме человека. Однако, даже они могут приводить к множественным нарушениям деятельности внутренних органов. Врожденные пороки сердца могут являться следствием аутосомно-доминантных нарушений (синдром Марфана, Нунан, Крузона, Холта-Орама и т.д.), а также аутосомно-рецессивных (синдром Карпентера, Робертса Картагенера и т.д.). Кроме того, существуют генные мутации, которые связаны с X-хромосомами (Гунтера, Аазе, Гольтца и т.д.)
Влияние факторов окружающей среды
К факторам внешней среды, которые могут оказывать повреждающее действие, относятся:
- вирусные заболевания матери во время беременности;
- радиационное излучение;
- некоторые группы лекарственных препаратов;
- вредные привычки матери как во время беременности, так и до нее;
- производственные вредности.
Полигенно-мультифакториальная предрасположенность
Оказывает наибольшее влияние на формирование плода. Основные признаки наследования врожденных пороков сердца по этой модели:
- риск возрастает с увеличением числа больных врожденными пороками сердца среди родственников 1 степени;
- родственники реже болеющего пола поражаются чаще;
- чем более тяжелый порок у близкого родственника, тем выше риск его повторения у ребенка.
Наиболее критичным периодом являются первые 3 месяца беременности. Воздействие неблагоприятных факторов в этот период существенно влияет на фетальный органогенез.
Сочетание всех этих факторов приводит к появлению врожденных пороков сердца.
Врождённые дефекты сердца
Пять наиболее встречаемых дефектов — это тетрада Фалло, дефект межжелудочковой перегородки, транспозиция магистральных сосудов, коарктация аорты, гипоплазия левых камер.
Оптимальным сроком для проведения ультразвуковой диагностики сердца плода считается период 24-26 недель беременности. Именно в это время анатомические структуры сердца максимально визуализируются, а на более ранних сроках можно увидеть только явные и глобальные пороки сердца.
Наиболее информативен ультразвуковой осмотр 4-камерного среза сердца. После которого при любом отклонении от нормы женщина отправляется на более детальное обследование плода с использованием допплеровской эхокардиографии. Также проводится кариотипирование, потому что в 30% случаев аномалии являются результатом хромосомных нарушений.
Факторы риска рождения ребенка с врожденным пороком сердца
Наиболее распространенными факторами риска являются:
- возраст матери (старше 35 лет);
- эндокринные нарушения у одного или обоих родителей;
- сильные токсикозы в I триместре беременности;
- угроза прерывания беременности на любом сроке;
- мертворождение в анамнезе беременной;
- наличие у одного из родителей детей с врожденными пороками сердца;
- прием эндокринных препаратов с целью сохранения беременности.
Наиболее точно оценить риски рождения ребенка с пороком сердца можно на консультации у врача-генетика. Это специалист помогает парам оценить все генетические риски при планировании беременности.
Классификация врожденных пороков сердца
Врожденные пороки сердца чаще всего классифицируются по принципу изменений в гемодинамике. По влиянию на легочный кровоток выделяется несколько вариантов пороков сердца:
- Врожденные пороки сердца с неизмененной гемодинамикой При этом кровоток в малом круге кровообращения не изменяется или практически не изменяется. К порокам данного типа относятся: атрезия аортального клапана, митральные пороки, недостаточность легочного клапана, коарктация аорты и т.д.
- Врожденные пороки сердца с увеличенной гемодинамикой При этом нарушения могут быть двух типов. К развитию раннего цианоза не приводят: открытый артериальный проток, дефекты межпредсердной и межжелудочковой перегородок, синдром Лютамбаше. Также изменения гемодинамики могут приводить к развитию цианоза: атрезия трехстворчатого клапана, крупный дефект межжелудочковой перегородки, открытый артериальный проток и т.д.
- Врожденные пороки сердца с уменьшением гемодинамики Они также могут приводить или не приводить к развитию цианоза.
- Комбинированные врожденные пороки сердца При этом происходит нарушение анатомических взаимоотношений между отделами сердца и крупными сосудами. Являются достаточно серьезным состоянием, так как происходит обширное поражение сердца.
Существует еще одна классификация пороков. Ее чаще всего используют в практической кардиологии. При этом пороки разделяются на 3 группы:
- «Синие» пороки (цианотического типа) К ним относятся триада и тетрада Фалло, атрезия трехстворчатого клапана и транспозиция магистральных сосудов.
- «Бледные» пороки К этой группе относятся открытый артериальный проток, а также септальные дефекты.
- Пороки с препятствием выброса крови из желудочков К этой группе относятся стенозы сосудов: аорты и легочной артерии.
Как нарушается кровообращение при врожденных пороках сердца?
Нарушение формирования структур сердца во внутриутробном периоде может приводить к:
- Неполному закрытию клапанов сердца.
- Несвоевременному закрытию клапанов сердца.
- Нарушению кровотока по сосудам.
После рождения у части детей артериальный проток и овальное окно могут оставаться открытыми и продолжают функционировать в физиологическом порядке.
В период внутриутробного развития гемодинамика плода, как правило, не страдает. Этого связано с особенностями кровообращения, которое функционирует в антенатальный период.
Однако, сразу же после рождения или через небольшой промежуток времени могут проявляться первые симптомы. Выраженность симптомов может зависеть от многих факторов, среди которых:
- сроки закрытия сообщения между большим и малым кругом кровообращения;
- выраженность легочной гипертензии;
- давление в системе артерии легкого;
- направление сброса крови;
- объем выброса крови;
- индивидуальные компенсаторные особенности организма.
Ускорить появление симптомов может респираторная инфекция или иные заболевания.
Врожденные пороки сердца бледного типа сопровождаются гипертензией малого круга кровообращения из-за гиповолемии (снижения количества циркулирующей жидкости). При пороках синего типа пациенты страдают от гипоксемии (снижения количества кислорода в крови).
При отсутствии хирургического лечения около 50% детей погибают на первом году жизни от явлений сердечной недостаточности. Оставшиеся 50% после 12 месяцев находятся в стабилизированном состоянии. Однако, в это же время прогрессируют склеротические процессы в сосудах легких, нарастают процессы легочной гипертензии.
Цианотические пороки сердца приводят к перегрузке большого круга кровообращения, в то же время малый круг страдает от недостатка жидкости. Постепенно развивается гипоксемия, органы и системы находятся в состоянии дефицита питания, кожа и видимые слизистые приобретают синюшный оттенок. В этот период организм находится в состоянии стресса, поэтому включаются коллатеральные сосуды, которые могут длительное время компенсировать состояние. Коллатерали позволяют поддерживать состояние пациента стабильным. Но длительное время организм неспособен компенсировать этот процесс. Постепенно начинают развиваться необратимые процессы дистрофии в мышце сердца.
Врожденные пороки сердца (ВПС) подлежат хирургическому лечению в раннем детском возрасте.
Симптомы врожденных пороков сердца
Симптомы врожденных пороков сердца могут быть крайне разнообразны. Они зависят не только от вида аномалии, но и от характера нарушений гемодинамики и сроков развития декомпенсации кровообращения.
Симптомы, характерные для цианотических пороков сердца – это посинение кожи и слизистых оболочек. Усиление симптоматики происходит даже при небольшом напряжении. Спровоцировать усиление симптомов может даже сосание или плач ребенка. Бледные пороки сопровождаются, соответственно, бледностью кожных покровов и похолоданием конечностей из-за уменьшения притоки крови к ним.
У детей с врожденными пороками сердца также есть характерное поведение. Они беспокойны, отказываются от груди, быстро утомляются в процессе кормления. Кроме того, у детей могут быть следующие симптомы:
- потливость;
- тахикардия;
- аритмия;
- одышка;
- набухание и пульсация шейных сосудов.
Врожденные пороки сердца являются причиной отставания детей в росте и развитии. Сразу же после рождения, у ребенка можно выслушать сердечные шумы. А со временем начинают нарастать процессы недостаточности сердца:
- отеки;
- кардиомегалия (увеличение размеров сердца);
- кардиогенная гипотрофия;
- гепатомегалия (увеличение размеров печени).
Также при отсутствии лечения могут развиваться следующие осложнения:
- бактериальный эндокардит;
- тромбозы и тромбоэмболии сосудов головного мозга;
- застойные пневмонии;
- стенокардический синдром и т.д.
Как диагностировать врожденный порок сердца?
Врожденные пороки сердца диагностируются путем комплексного обследования организма.
Первым этапом диагностики является визуальный осмотр. Его цель — оценка кожных покровов и видимых слизистых оболочек (наличие или отсутствие цианоза, его характер: генерализованный или периферический).
У детей с врожденными пороками сердца могут наблюдаться:
- «сердечный горб» – специфическая деформация грудной клетки, которая характерна для пороков, появившихся в раннем возрасте;
- видимая пульсация в области верхушки сердца (5–6 межреберье слева от грудины);
- систолическое дрожание (выявляется при пальпации сердца).
Далее проводится аускультация сердца. При этом могут выявляться различные изменения в характере сердечных тонов (усиление, ослабление, расщепление), появление патологических шумов.
В качестве дополнительных инструментальных диагностических методов используются:
- электрокардиография (ЭКГ);
- фонокардиография (ФКГ);
- рентгенография органов грудной клетки;
- эхокардиография (ЭхоКГ).
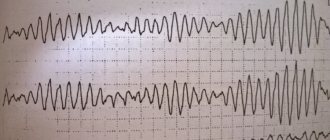
Электрокардиография – это основной диагностический метод, который позволяет выявлять сердечные патологии. При помощи ЭКГ можно диагностировать:
- гипертрофию различных отделов сердца;
- отклонение ЭОС (электрической оси сердца);
- наличие нарушений ритма и проводимости.
Электрокардиография является основным, но не единственным методом диагностики. Поэтому ее данные оцениваются в совокупности с другими лабораторными и инструментальными методами диагностики. И лишь на основании комплекса исследований можно судить о диагнозе врожденного порока сердца. Кроме того, на ЭКГ могут обнаруживаться:
- признаки гипертрофии обоих желудочков (чаще всего поражается правый);
- признаки блокады правой ножки пучка Гиса (является признаком нарушения проводимости сердца).
Для того чтобы не упустить нарушения ритма и проводимости, которые появляются спонтанно, используется суточное холтеровское мониторирование. Рентгенографические данные позволяют дополнить предыдущие методы лечения благодаря:
- оценке состояния малого круга кровообращения;
- оценке конфигурации и размеров сердца;
- состоянию соседних органов (плевра, легкие, позвоночник).
Усиление сосудистого рисунка на рентгенографии может быть признаком гиперволемии (увеличения количества жидкости) в малом круге кровообращения
При проведении ЭХО-кардиографии оценивается состояние перегородок сердца, клапанов, магистральных сосудов. Параллельно с этим специалист оценивает сократительную способность миокарда. Также во время проведения ЭХО-КГ специалист оценивает состояние гемодинамики.
Дополнительную информацию о пороке сердца может дать зондирование полостей сердца и ангиокардиография. Чаще всего их используют для дифференциальной диагностики и уточнения состояния при сложных пороках сердца, а также сопутствующей легочной гипертензии.
Лечение врожденных пороков сердца
Информации о способах лечения пороков достаточно много. Но основным вариантом лечения является хирургический. Особую сложность представляет оперативное вмешательство у детей на первом году жизни. Большая часть хирургических вмешательств в раннем детском возрасте проводится по поводу цианотических пороков сердца. Если у ребенка отсутствуют признаки сердечной недостаточности, а цианоз выражен умеренно, то оперативное вмешательство может быть отложено.
Специалистами, которые ведут наблюдение за детьми с врожденными пороками сердца, являются педиатр, кардиолог и кардиохирург (сосудистый хирург).
Лечение для каждого отдельного порока специфическое. Оно зависит от разновидности, степени и тяжести заболевания. Основными методами являются:
- ушивание дефекта перегородки;
- пластика аортального стеноза;
- эндоваскулярная вальвулопластика и т.д.
Операции делятся на паллиативные и радикальные.
Паллиативные операции проводятся с целью подготовки ребенка к следующему, более серьезному вмешательству. Радикальные операции становятся разрешением проблемы.
Как выявить порок развития плода до рождения?
Для того чтобы заболевания ребенка не стали неожиданностью после рождения, каждая женщина должна ответственно подходить к планированию беременности и вынашиванию малыша. В период беременности женщина обязательно должна встать на учет в женской консультации. Чем раньше это произойдет, тем лучше для здоровья матери и малыша. В ходе беременности проводятся регулярные обязательные исследования:
- анализ мочи;
- анализ крови;
- УЗИ;
- полное медицинское обследование.
Ответственное отношение к регулярным медицинским обследованиям позволяет выявить большинство пороков развития на ранних стадиях. К сожалению, начать лечение в этот период нельзя. Однако, у женщины появляется выбор: сохранить беременность или прервать ее. Родители могут понять: готовы ли они к рождению особенного ребенка, которому потребуется более тщательный уход.
Наиболее информативными исследованиями в период беременности являются:
- УЗИ Уже с четвертого месяца опытный УЗИ-специалист может заметить пороки развития.
- Амниоцентез Эта процедура обязательно проводится беременным женщинам старше 35 лет. Кроме того, сделать процедуру можно не только при наличии показаний, но и при желании беременной женщины. Амниоцентез осуществляется под контролем УЗИ: игла вводится в нижнюю часть живота. С ее помощью происходит захват околоплодных вод, а также амниотической оболочки. Эти биологические материалы представляют большую информационную ценность для врачей, именно поэтому направляются на исследование. Оптимальное время для проведения амниоцентеза – это 16–20 неделя беременности. Именно в этот период риски для плода во время введения иглы минимальны. Этот метод позволяет достоверно говорить об аномалиях развития, если до этого были выявлены аномалии развития с помощью иных методов. Помимо врожденных пороков сердца, этот метод позволяет определить наличие или отсутствие таких серьезных патологий, как синдром Дауна или Эдвардса.
Как избежать развития врожденных пороков развития?
К сожалению, гарантировать 100% защиту от болезней не может ни один из известных медицине способов. Однако, можно существенно уменьшить риск их возникновения, если соблюдать ряд правил:
- Исключить употребление спиртных напитков в период планирования беременности и вынашивания ребенка Особую опасность представляет алкоголь в I триместре беременности, когда происходит первая дифференцировка клеток и закладка органов.
- Исключить наркотики Они оказывают еще более разрушающий эффект на клетки эмбриона и приводят к развитию грубых, множественных пороков.
- Уделяйте пристальное внимание своему здоровью Женщине в период беременности необходимо постараться избегать любых заболеваний, в том числе их обострений. Помните о том, что многие болезни матери могут приводить к возникновению патологий у будущего ребенка.
- Откажитесь от курения Как от активного, так и пассивного. Кроме того, необходимо помнить и о том, что негативный эффект на организм плода могут оказывать не только классические сигареты, но и вейпы, кальяны и т.д.
- Не принимайте лекарственные препараты без назначения врача Многие привычные каждому человеку лекарства вовсе не безобидны для развивающегося детского организма. Антибиотики, обезболивающие, жаропонижающие и успокоительные – это лишь небольшой перечень препаратов, которые могут заставить организм плода развиваться неправильно. Поэтому перед приемом любого лекарства требуется консультация врача: специалист поможет вам подобрать безопасные альтернативы.
- Следите за своим рационом Беременная женщина находится под давлением двойной ответственности. Она не только отвечает за состояние своего здоровья, но и за здоровье малыша. Поэтому ее питание должны быть правильным, рациональным и богатым витаминами. Ребенок сможет развиваться нормально только в том случае, когда будет получать от материнского организма все необходимые для «строительства» питательные вещества.
- Уделите внимание окружающей среде Многие люди, к сожалению, не могут позволить себе переезд из загазованного, загрязненного города в экологически чистый район в период беременности. Однако, это вовсе не значит, что этот пункт должен остаться без внимания. Предпочтите отдых в парках и скверах торговым центрам, при возможности – выезжайте на выходных на природу.
Что можно сделать до беременности?
Забота о малыше должна начинаться еще до беременности. Ребенок появляется всего из двух клеток (гамет) матери и отца. Именно они дают начало новой жизни, именно от них во многом зависит то, как будет развиваться ребенок.
Половые клетки обоих родителей закладываются еще на этапе внутриутробного развития. Они подвергаются всем негативным факторам на протяжении жизни. Женские половые клетки особенно уязвимы: их количество лишь уменьшается, а влияние вредных факторов оказывает более губительный эффект. Поэтому до беременности необходимо сократить количество вредных факторов, которые влияют на организм.
Уже на этапе планирования следует отказаться от вредных привычек и пройти полную диагностику обоим будущим родителям. Если у кого-то из ближайших родственников есть врожденные пороки сердца, то стоит проконсультироваться с врачом-генетиком, сдать необходимые анализы. В случае выявления рисков специалист обязательно подскажет, как можно их минимизировать.
Чем более тщательную проверку здоровья вы пройдете до беременности, тем меньше риск столкнуться с неприятными неожиданностями во время нее.
Общий артериальный ствол
Для диагностики общего артериального клапана у младенцев необходимы клинические данные, о которых детально рассказано выше. Учитываются данные рентгенографии органов грудной клетки и данные, полученные по электрокардиограмме. Уточнить диагноз помогает двухмерная эхокардиография с цветной допплеркардиографией. Перед операцией часто возникает необходимость уточнить иные аномалии, которые могут быть у пациента, помимо рассматриваемой болезни. Тогда проводят катетеризацию сердца.
Рентгенографические методы позволяют обнаружить кардиомегалию (может быть как незначительно, так и сильно выражена), усилен легочный рисунок, дуга аорты право расположена у трети пациентов, легочные артерии расположены относительно высоко. При значительном усилении усиление легочного кровотока могут появиться признаки гипертрофии левого предсердия, что также учитывается при диагностике.
Наиболее актуальные методы диагностики
ЭхоКГ – эхокардиография – метод, представляющий собой исследование сердца при помощи ультразвука. При общем артериальном стволе выявляют прямое соединение одной или двух легочных артерий с единственным артериальным стволом.
ФКГ – фонокардиография – метод диагностики болезней и патологий сердца. На бумаге регистрируются шумы и тоны сердца, которые при помощи стетоскопа или фонендоскопа врачи не могут распознать. Метод применяется для подтверждения диагностики рассматриваемой болезни.
ЭКГ – электрокардиография – позволяет обнаружить увеличение правого предсердия, замедление проводимости сердца, увеличение и перегрузку обоих желудочков.
Аортография — рентгенологическое исследование аорты и ее ветвей с помощью ввода контрастного вещества в просвет аорты. Метод необходим для выявления уровня отхождения ствола легочной артерии, определения состояния клапанного аппарата и пр.
Ангиокардиография – рентгенография органов грудной клетки с контрастированием – позволяет обнаружить специфические изменения в сосудистом русле у пациентов с подозрением на общий артериальный ствол. Обнаруживают необычную или же нечеткую структуру корней легких, обеднение или усиление рисунка легких, неправильный кровоток как следствие обнаруживаемых дефектов. Увеличены оба желудочка и правое предсердие. Этот метод ведущий в плане диагностики такой патологии как общий артериальный ствол у новорожденных.