Тромбоз воротной вены (ТВВ),или пилетромбоз, является редко диагностируемым заболеванием сосудов печени и можетбыть результатом большого количестваразличных заболеваний как хирургического, так и терапевтического профиля,оставаясь бессимптомным длительныйпериод времени, что затрудняет его своевременную диагностику. В то же время прогноз при ТВВ всегда серьезен и неблагоприятен, в половине случаев наблюдаются смертельные исходывследствие желудочно-кишечных кровотечений и прогрессирования портальной гипертензии (ПГ) [6, 9].ТВВ называют процесс образованиятромба вплоть до полной окклюзиипросвета основного ствола и ветвей ВВ с прогрессирующим нарушением кровотока в печени и желудочно-кишечном тракте.
Впервые прижизненный диагноз тромбоза основного ствола ВВ поставил Боткин С.П. в 1862 г. [ 1, 7]. Первоеописание ТВВ принадлежит Вalfur иStewart (1868) на примере пациента соспленомегалией, асцитом и варикознорасширенными венами (ВРВ) [1, 3].В 1934 г. Стражеско Н.Д. на основании собственных исследований и данных литературы разработал и описал главные симптомы прижизненно распознанного ТВВ [3].
Достоверных сведений о частоте ТВВ нет. В зависимости от методов диагностики и критериев выборки пациентов статистические данные сильноварьируются. По данным аутопсий, в США частота портальных тромбозовколеблется от 0,05 до 0,50 % [9, 15]; данные японских патологов эти цифры подтверждают. В европейской популяции ТВВ обусловлено до 10 % всех случаев ПГ, в то же время в развивающихся странах эта цифра достигает 40 %[5, 12]. Частота ТВВ у больных циррозомпечени (ЦП), по разным литературнымданным, колеблется от 1 до 43 % [5, 9].При пересадке печени частота развитияТВВ варьируется от 2 до 26 % [5].
Таким образом, проблема ТВВ имеетважное медицинское значение, темболее что тщательно разработанныхалгоритмов диагностики и леченияданной патологии до сих пор нет.
Система ВВ
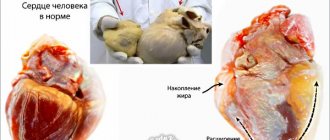
Система ВВ включает все вены, покоторым осуществляется отток венозной крови от внутрибрюшной части желудочно-кишечного тракта, селезенки, поджелудочной железы и желчногопузыря (см. рисунок).
. Анатомическое строение системы воротной вены. Ш. Шерлок, Дж. Дули.
ВВ образуется из слияния верхнейбрыжеечной и селезеночной вен позади головки поджелудочной железы приблизительно на уровне II поясничного позвонка; протяженность ВВ доворот печени составляет 5,5–8,0 см.В воротах печени ВВ разделяется направую и левую долевые ветви соответственно долям печени; далее в печениВВ делится на сегментарные ветви,сопровождающие ветви печеночнойартерии.
ВВ не содержит клапанов в основных ветвях. Распределение портального кровотока в печени непостоянно:может преобладать кровоток в левуюлибо в правую долю печени. У человека возможен переток крови из системы одной долевой ветви в систему другой. Давление в ВВ человека в норме составляет около 7 мм рт. ст. Объемнаяскорость кровотока через ВВ достигает1000–1200 мл/мин [3].
Этиология и патогенез ТВВ
Согласно современным представлениям, венозный тромбоз является суммирующим результатом врожденныхили приобретенных прокоагулянтныхнарушений и действия местных факторов [10, 22].
Состояние, при котором нарушается равновесие между процессами коагуляции и фибринолиза в пользу процессов коагуляции, может быть определено как тромбофилия. У человекас врожденными или приобретеннымив течение жизни тромбофилическими нарушениями чаще, чем в обычной популяции, развиваются артериальные или венозные тромбозы различной локализации (табл. 1) [5, 11,12, 14, 23].
Мутация Лейдена в гене фактора Vвстречается в 2–4 % европейской популяции и ведет к изменению аминокислотной последовательности самого фактора свертываемости V (заменеаргинина глутамином в позиции 506). Мутированный фактор V устойчив кразрушению протеином С; постояннаяциркуляция активированного фактораV приводит к неконтролируемому синтезу тромбина и формированию тромбов [11, 13, 16, 23].
Мутация гена фактора свертываемости II впервые описана в 1996 г., встречается в общей популяции у 2 %населения и приводит к избыточнойгенерации протромбина, т. е. сдвигугемостаза в прокоагулянтную сторону[17, 22].
Протеин С синтезируется в печеничерез витамин К – зависимый механизм, и является естественным антикоагулянтом. Протеин S – кофакторпротеина С, участвующий в нейтрализации активных форм факторов свертывания V и VIII. В настоящее время описано около 160 мутаций гена протеина С и множество мутаций генапротеина S, что ведет к дефициту этихбелков и развитию тромбофилии [11].
Приобретенные расстройства свертывания крови могут возникать примиелоприлиферативных заболеваниях,антифосфолипидном синдроме; онитакже сопровождают воспалительныеи онкологические заболевания, отмечаются на фоне применения пероральных контрацептивов [16, 22, 23], беременности и гипергомоцистеинемии.У 60 % больных при тромбозе вен внутренних органов отмечается гиперкоагуляция, у 25 % первостепенное значение имеет влияние локальных факторов [16, 20]. Для ТВВ характерна комбинация причинных факторов [18, 20].Приблизительно в 20 % случаев развитие тромбоза не находит исчерпывающего объяснения [21]. Возникновению тромбозов способствуют все заболевания, протекающие с замедлением кровотока через печень.
Патогенез ТВВ при ЦП до конца невыяснен. Значение здесь могут иметьПГ, уменьшение скорости кровотокапо ВВ, периферический лимфангиити фиброз [20].
. Причины тромбофилии.
Классификация тромбоза воротной вены
Заболевание классифицируется по нескольким основаниям.
По времени возникновения:
- Острый тромбоз – развитие патологического процесса происходит молниеносно, в течение 5-7 минут больной погибает из-за некроза органов ЖКТ (печень, селезенка, кишечник, желудок, поджелудочная железа);
- Хронический тромбоз – кровоток в вене прекращается не сразу, из-за растущего тромба он постепенно снижается, при этом формируется альтернативный путь течения крови в обход закупоренного участка.
Стадии развития тромбоза:
- Локализация тромба – переход воротной вены в селезеночную, площадь распространения – менее 50% сосудистой системы.
- Локализация тромба – участок до брыжеечного сосуда.
- Площадь распространения на третьей стадии – все вены брюшины.
- На четвертой стадии происходит обширное нарушение кровообращения.
Клиника ТВВ
Клиническая картина зависит от локализации и протяженности ТВВ, быстроты его развития и природы предрасполагающего заболевания печени. ТВВ можно разделить на острый и хронический, исходя из темпов развития венозной обструкции. О тромбозе ВВ или ее ветвей следует думать во всех случаях внезапного появления болей в эпигастральной области, сочетающихся с резким вздутием живота, быстрым накоплением жидкости в полости брюшины, повторной рвотой. ТВВ может проявлять себя в любом возрасте: начиная с 6-недельного до глубокой старости; различия по частоте его встречаемости между детьми и взрослыми не наблюдается [5]. Клинические проявления могут варьироваться от полностью бессимптомного течения болезни до острого начала с кровавой рвотой. Кровотечение из ВРВ пищевода и прямой кишки – наиболее частое проявление ТВВ. При наличии спленомегалии и гиперспленизма наблюдаются тромбоцитопения, боли в животе, транзиторный или постоянный асцит, отсутствие аппетита, слабость, похудание.
Хронический ТВВ может проявлять себя лишь неспецифическими симптомами – общей слабостью, отсутствием аппетита, а в отсутствие грамотной диагностики, что встречается довольно часто, может быть пропущен.
В терапевтической практике чаще приходится наблюдать вялотекущие формы пилефлебита на фоне портального тромбоза. Они характеризуются нерезкими болями в области печени, умеренным лейкоцитозом, длительной субфебрильной температурой тела. Слегка увеличенная печень чувстви- тельна при пальпации. Кровь в случаях вялотекущего пилефлебита оказывалась стерильной. Болезнь обычно принимается за хронический холецистохолангит, хронический аппендицит или другое хроническое воспалительное заболевание какого-либо внутреннего органа. Причина лихорадки обычно становится очевидной только после длительного наблюдения, за время которого у больного появляются увеличение селезенки и признаки более или менее развитого коллатерального кровообращения.
Выделяются следующие стадии ТВВ: 1. Острая: образование тромба; ВВ может быть увеличена. 2. Подострая: визуализируются тромб и мелкие венозные коллатерали; диаметр ВВ может быть увеличен. 3. Хроническая: кавернозная трансформация ВВ; развитие крупных коллатералей в проекции облитерированной ВВ; ВВ уменьшена в диаметре или не визуализируется.
В зависимости от локализации тромба различают три варианта ТВВ: • радикулярная форма (тромбоз селезеночной вены и мезентериальных сосудов); • терминальная форма (тромбозы мелких разветвлений и капилляров ВВ в печени); • стволовой тромбоз (в самом стволе ВВ).
Кровоснабжение кишечника выше уровня ТВВ (по ходу кровотока) остается удовлетворительным до тех пор, пока сохраняется циркуляция по дугообразным сосудам кишечника. Если же они тромбируются, развивается ишемия кишки. Этому, вероятно, способствует отсутствие сосудистых коллатералей. Последствием ишемии может стать некроз кишки с развитием перитонита, полиорганной недостаточности, а в четверти случаев – летального исхода даже после резекции некротизированного участка кишки [9, 21].
Напротив, ниже уровня тромбоза клинически значимых нарушений функции печени не развивается, поскольку ее кровоснабжение поддерживается благодаря увеличению притока крови по печеночной артерии (вследствие расширения ее ветвей) и развитию портальных коллатералей, из которых формируется кавернома [7, 19]. Коллатеральные вены развиваются в течение нескольких дней и образуют каверному, при диагностике часто ошибочно трактуемую как сосудистая опухоль, или аномалия развития. Коллатеральные вены могут изменять вид анатомических структур, примыкающих к тромбированному участку ВВ, в частности желчных протоков, желчного пузыря, поджелудочной железы, антральной части желудка, 12-перстной кишки. При диагностических исследованиях это приводит к ошибочной диагностике опухолей, панкреатитов, холециститов. Кроме того, изменения в желчных протоках, вызванные развитием коллатералей, могут приводить к развитию желтухи. Давление в системе ВВ увеличивается; развивается картина ПГ.
Диагностика ТВВ
Необходимость использования визуализирующих методов исследования определяется отсутствием специфических признаков ТВВ и потребностью в выявлении уровня нарушения венозного оттока. Основными диагностическими методами в данном случае являются ультразвуковое (УЗИ) и допплеровское исследования, компьютерная (КТ), магнитно-резонансная томографии (МРТ) и ангиография.
УЗИ позволяет выявить ТВВ лишь в том случае, когда в просвете ВВ визуализируются участки повышенной эхогенности, обусловленные наличием тромбов. При увеличении размеров ВВ можно только предположить ПГ, т. е. этот признак не является диагностическим. Обнаружение венозных коллатералей с большей достоверностью подтверждает диагноз ПГ.
Допплеровское УЗИ дает возможность выявить строение ВВ и печеночной артерии. Диагностическая ценность и результаты исследования зависят от опыта врача и качества анализа деталей изображения. Наибольшую сложность представляют исследования цирротически измененной печени и у пациентов с избыточным весом [2, 19]. При цветном допплеровском картировании (ЦДК) качество визуализации ТВВ повышается. Технически правильно проведенное ЦДК позволяет диагностировать обструкцию ВВ так же достоверно, как ангиография. С ЦДК удается выявить естественные внутрипеченочные портосистемные шунты. Это наиболее дешевый, эффективный и неинвазивный метод. Его высокие чувствительность и специфичность отмечаются у пациентов с обширными тромботическими поражениями и полным закрытием просвета сосудов. В то же время наличие остаточного кровотока по ВВ увеличивает вероятность технической ошибки при оценке результатов исследования [5, 19].
С целью снижения риска подобных ошибок при диагностике ТВВ для определения скорости портального кровотока применяют дуплексное ультразвуковое сканирование. Этот метод представляет собой сочетание допплеровского ультразвукового сканирования с традиционным УЗИ, что позволяет врачу увидеть структуру кровеносных сосудов. Дуплексное сканирование показывает движение крови по сосудам и позволяет измерять скорость кровотока. Этот метод также позволяет определять диаметр сосудов и выявлять их закупорку. К наиболее современным и точным методам визуализации относятся КТ, венография и МРТ.
КТ может дать информацию о состоянии стенок сосудов, поражении печени (например, с формированием кавернозных узлов) и показать протяженность тромбоза [5, 15].
После введения контрастного вещества появляется возможность определить просвет ВВ и выявить ВРВ, расположенные в забрюшинном пространстве, а также перивисцеральные и параэзофагеальные вены. ВРВ пищевода выбухают в его просвет, и это выбухание после введения контрастного вещества становится более заметным.
КТ в сочетании с артериальной портографией позволяет выявлять пути коллатерального кровотока и артериовенозные шунты. Портография через внутреннюю яремную вену – инвазивный, но очень точный метод диагностики. Он позволяет оценивать протяженность тромбоза, его точную локализацию и выраженность тромботического стеноза ВВ.
МРТ позволяет очень четко визуализировать сосуды и изучать их. Этот метод применяют для определения просвета шунтов, а также для оценки состоятельности портального кровотока. Результаты МРТ более надежны, чем данные допплеровского УЗИ [5, 15, 19].
Венография используется для верификации диагноза в тех случаях, когда вышеописанные методы исследования не позволяют однозначно подтвердить или исключить предполагаемый ТВВ. В то же время, если каким-либо методом установлена проходимость ВВ, подтверждение этого с помощью венографии не является обязательным. Венография также позволяет выявлять дефект наполнения ВВ или ее ветвей, свидетельствующий о сдавлении извне объемным образованием [5].
В клинической практике для диагностики портальных тромбозов обычно комбинируют два метода, чтобы преодолеть недостатки каждого из них. При диагностике ТВВ следует обратить внимание на коагулограмму: повышение содержания фибриногена, появление активированного фибриногена, увеличение протромбинового индекса, уменьшение времени свертывания крови.
Ультразвуковая диагностика венозного тромбоза в амбулаторных условиях
УЗИ аппарат HM70A
Экспертный класс по доступной цене.
Монокристальные датчики, полноэкранный режим отображения, эластография, 3D/4D в корпусе ноутбука. Гибкая трансформация в стационарный сканер при наличии тележки.
Введение
Острый венозный тромбоз — распространенное и опасное заболевание. Согласно статистическим данным, его частота в общей популяции составляет около 160 на 100 000 населения [1]. Тромбоз в системе нижней полой вены (НПВ) представляет собой наиболее частую и опасную разновидность этого патологического процесса и является основным источником эмболии легочных сосудов (84,5%). Система верхней полой вены дает 0,4-0,7% тромбоэмболий легочной артерии (ТЭЛА), правые отделы сердца — 10,4%. На долю тромбозов вен нижних конечностей приходится до 95% случаев всех тромбозов в системе НПВ. Диагноз острого венозного тромбоза прижизненно диагностируется у 19,2% больных [2]. В долгосрочной перспективе тромбоз глубоких вен (ТГВ) ведет к формированию посттромбофлебитической болезни, проявляющейся хронической венозной недостаточностью вплоть до развития трофических язв, что существенно снижает трудоспособность и качество жизни пациентов.
Основными механизмами внутрисосудистого образования тромбов, известными со времен R.Virchow, являются замедление тока крови (стаз), гиперкоагуляция, травма стенки сосуда (повреждение эндотелия). Острый венозный тромбоз достаточно часто развивается на фоне различных онкологических заболеваний (злокачественные опухоли желудочнокишечного тракта, женской половой сферы и др.) в силу того, что раковая интоксикация вызывает развитие гиперкоагуляционных изменений и угнетение фибринолиза, а также из-за механического сдавления вен опухолью и прорастания ее в сосудистую стенку. Предрасполагающими факторами ТГВ считаются также ожирение, беременность, прием оральных гормональных контрацептивов, наследственные тромбофилии (дефицит антитромбина III, протеина C и S, лейденовская мутация и др.), системные заболевания соединительной ткани, хронические гнойные инфекции, аллергические реакции [3, 4]. Наибольшему риску развития ТГВ подвержены больные пожилого и старческого возраста и лица, страдающие хронической венозной недостаточностью нижних конечностей, а также пациенты с инфарктом миокарда, декомпенсированной сердечной недостаточностью, инсультом, пролежнями, гангреной нижних конечностей. Особую тревогу вызывают травматологические больные, так как переломы бедренной кости в основном встречаются у лиц пожилого и старческого возраста, наиболее отягощенных соматическими заболеваниями [5]. Тромбозы у травматологических больных могут возникнуть при любой травме нижних конечностей, так как при этом имеют место все этиологические факторы тромбоза (повреждение сосуда, венозный застой и изменения свертывающих свойств крови) [6].
Надежная диагностика флеботромбоза является одной из актуальных клинических задач. Физикальные методы обследования позволяют поставить правильный диагноз лишь в типичных случаях заболевания, при этом частота диагностических ошибок достигает 50% [7]. Так, например, тромбоз вен икроножных мышц при сохраненной проходимости остальных вен нередко протекает бессимптомно. Из-за опасности пропустить острый ТГВ голеней клиницисты зачастую ставят этот диагноз в каждом случае появления болей в икроножных мышцах [8]. Особое внимание заслуживают «травматологические» больные, у которых наличие боли, отека и изменения окраски конечности могут быть следствием самой травмы, а не ТГВ. Иногда первым и единственным проявлением подобного тромбоза служит массивная ТЭЛА.
В задачи инструментального обследования входят не только подтверждение или опровержение наличия тромба, но также определение его протяженности и степени эмбологенности. Выделение эмболоопасных тромбов в отдельную группу и изучение их морфологической структуры имеют большое практическое значение, так как без этого невозможны разработка эффективной профилактики легочной эмболии и выбор оптимальной тактики лечения. Тромбоэмболические осложнения чаще наблюдаются при наличии флотирующего тромба с гетерогенной структурой, неровным гипо- или изоэхогенным контуром в отличие от тромбов, имеющих гиперэхогенный контур и гомогенную структуру. Важным критерием эмбологенности тромба является степень его подвижности в просвете сосуда. Эмболические осложнения чаще отмечаются при выраженной и умеренной подвижности тромбомасс [9, 10].
Венозный тромбоз — достаточно динамичный процесс. С течением времени процессы ретракции, гуморального и клеточного лизиса способствуют уменьшению размеров тромба. Одновременно с этим идут процессы его организации и реканализации. В большинстве случаев проходимость сосудов постепенно восстанавливается, клапанный аппарат вен разрушается, а остатки тромбов в виде пристеночных наложений деформируют сосудистую стенку. Затруднения в диагностике могут быть при возникновении повторного острого тромбоза на фоне частично реканализованных вен у больных с посттромбофлебитической болезнью. В этом случае достаточно надежным критерием является различие вен в диаметре: у пациентов с признаками реканализации тромбомасс происходит уменьшение вены в диаметре вследствие стихания острого процесса; при развитии ретромбоза вновь происходит достоверное увеличение диаметра вены с нечеткими («размытыми») контурами стенок и окружающих тканей [9]. Этими же критериями пользуются при дифференциальной диагностике острого пристеночного тромбоза с посттромботическими изменениями вен.
Из всех неинвазивных методов, применяемых для диагностики тромбоза, в последнее время все чаще используется ультразвуковое сканирование венозной системы. Метод триплексного ангиосканирования, предложенный Barber в 1974 г., включает исследование сосудов в В-режиме, анализ допплеровского сдвига частот в виде классического спектрального анализа и цветового картирования потока (в скоростном и энергетическом режимах). Использование спектральной допплерографии позволило точно измерять кровоток внутри просвета вен. Применение метода цветового допплеровского картирования (ЦДК) обеспечило возможность быстро отличать окклюзирующий тромбоз от неокклюзирующего, выявлять начальные стадии реканализации тромбов, а также определять местоположение и размер венозных коллатералей. При исследованиях в динамике ультразвуковой метод позволяет обеспечить достаточно точный контроль за эффективностью тромболитической терапии. Кроме того, с помощью ультразвукового исследования можно установить причины появления клинической симптоматики, сходной с таковой при патологии вен, например выявить кисту Бейкера, межмышечную гематому или опухоль. Внедрение в практику ультразвуковых приборов экспертного класса с датчиками частотой от 2,5 до 14 МГц позволило достичь практически 99% точности диагностики.
Материал и методы
Обследование включало осмотр пациентов с клиническими признаками венозного тромбоза и ТЭЛА. Больные предъявляли жалобы на отек и боль в нижней (верхней) конечности, боль в икроножной мышце (чаще распирающего характера), «тянущую» боль в подколенной области, боль и уплотнение по ходу подкожных вен. При осмотре выявлялись умеренный цианоз голени и стопы, плотный отек, болезненность при пальпации мышц голени, у большинства пациентов — положительные симптомы Хоманса и Мозеса.
Всем обследуемым проводилось триплексное сканирование венозной системы на современных ультразвуковых аппаратах линейным датчиком с частотой 7 МГц. При этом оценивалось состояние вен бедра, подколенной вены, вен голени, а также большой и малой подкожных вен. Для визуализации подвздошных вен и НПВ использовался конвексный датчик с частотой 3,5 МГц. При сканировании НПВ, подвздошных, большой подкожной вены, бедренных вен и вен голени в дистальном отделе нижних конечностей пациент находился в положении лежа на спине. Исследование подколенных вен, вен верхней трети голени и малой подкожной вены проводилось в положении пациента лежа на животе с валиком, подложенным под область голеностопных суставов. Затруднения в диагностике возникали при визуализации дистального отдела поверхностной бедренной вены у тучных пациентов, визуализации вен голени при выраженных трофических и индуральных изменениях тканей. В этих случаях также использовался конвексный датчик. Глубину сканирования, усиление эхо-сигнала и другие параметры исследования подбирали индивидуально для каждого пациента и сохраняли неизменными во время всего обследования, включая наблюдения в динамике.
Сканирование начинали в поперечном сечении для исключения наличия флотирующей верхушки тромба, о чем свидетельствовало полное соприкосновение венозных стенок во время легкой компрессии датчиком. Убедившись в отсутствии свободно флотирующей верхушки тромба, компрессионную пробу датчиком проводили от сегмента к сегменту, от проксимальных отделов к дистальным. Предлагаемая методика является наиболее точной не только для выявления тромбоза, но и для определения его протяженности (исключая подвздошные вены и НПВ, где проходимость вен определялась в режиме ЦДК). Продольное сканирование вен подтверждало наличие и характеристики венозного тромбоза. Кроме того, продольное сечение использовалось для локации анатомического слияния вен. Во время обследования оценивались состояние стенок, просвет вен, локализация тромба, его протяженность, степень фиксации к сосудистой стенке.
Ультразвуковая характеристика венозных тромбов проводилась по отношению к просвету сосуда: они различались как пристеночные, окклюзирующие и флотирующие тромбы. Признаками пристеночного тромбоза считались визуализация тромба с наличием свободного кровотока в просвете вены, отсутствие полного спадения стенок при компрессии вены датчиком, наличие дефекта заполнения при ЦДК, наличие спонтанного кровотока при спектральной допплерографии (рис.1).
Рис. 1.
Неокклюзирующий тромбоз подколенной вены. Продольное сканирование вены. Огибающий кровоток в режиме энергетического кодирования потока.
Ультразвуковыми критериями флотирующих тромбов считали: визуализацию тромба как эхогенной структуры, расположенной в просвете вены с наличием свободного пространства, колебательные движения верхушки тромба, отсутствие соприкосновения стенок вены при компрессии датчиком, наличие свободного пространства при выполнении дыхательных проб, огибающий тип кровотока при ЦДК, наличие спонтанного кровотока при спектральной допплерографии. При выявлении флотирующего тромба оценивалась степень его подвижности: выраженная — при наличии спонтанных движений тромба при спокойном дыхании и/или задержке дыхания; умеренная — при обнаружении колебательных движений тромба в ходе проведения функциональных проб (кашлевая проба); незначительная — при минимальной подвижности тромба в ответ на функциональные пробы.
Результаты исследования
С 2003 по 2006 г. были обследованы 236 пациентов в возрасте от 20 до 78 лет, из них 214 с клиникой острого тромбоза и 22 с клиникой ТЭЛА.
В первой группе в 82 (38,3%) случаях проходимость глубоких и поверхностных вен не была нарушена и клиническая симптоматика обусловлена иными причинами (табл. 1).
Таблица 1
. Состояния, имеющие сходную с ТГВ симптоматику.
| Патология | Количество больных | |
| абс. | % | |
| Травма | 33 | 40,2 |
| Заболевания суставов | 18 | 22,0 |
| Лимфовенозная недостаточность | 12 | 14,6 |
| Киста Бейкера больших размеров | 6 | 7,3 |
| Лимфаденит | 5 | 6,1 |
| Внутримышечная гематома | 4 | 4,9 |
| Экстравазальная компрессия | 4 | 4,9 |
Диагноз тромбоза был подтвержден у 132 (61,7%) больных, при этом в большинстве случаев (94%) тромбоз выявлялся в системе НПВ. ТГВ был обнаружен в 47% случаев, поверхностных вен — в 39%, поражение как глубокой, так и поверхностной венозной системы наблюдалось в 14%, в том числе у 5 больных с вовлечением перфорантных вен.
Вероятные причины (факторы риска) развития венозного тромбоза представлены в табл. 2.
Таблица 2
. Факторы риска развития тромбоза.
| Фактор риска | Количество больных | |
| абс. | % | |
| Травма (в том числе длительная гипсовая иммобилизация) | 41 | 31,0 |
| Варикозная болезнь | 26 | 19,7 |
| Злокачественные новообразования | 23 | 17,4 |
| Операции | 16 | 12,1 |
| Прием гормональных препаратов | 9 | 6,8 |
| Тромбофилии | 6 | 4,5 |
| Хроническая ишемия конечностей | 6 | 4,5 |
| Ятрогенные причины | 5 | 4,0 |
В наших наблюдениях наиболее часто выявлялись распространенная форма тромбоза, а также поражение вен на уровне подколенно-берцового и бедренно-подколенного сегментов (табл. 3).
Таблица 3
. Локализация ТГВ.
| Локализация | Количество больных | |
| абс. | % | |
| Вены голени | 19 | 14,4 |
| Подколенная вена | 8 | 6,0 |
| Подколенно-берцовый сегмент | 34 | 25,8 |
| Бедренно-подколенный сегмент | 21 | 15,9 |
| Илеофеморальный сегмент | 5 | 3,8 |
| Бедренно-подколенно-берцовый сегмент | 38 | 38,8 |
| Подвздошно-бедренно-подколенно-берцовый сегмент | 7 | 5,3 |
Чаще (63%) имели место тромбозы, полностью окклюзирующие просвет сосуда, на втором месте по частоте (30,2%) были пристеночные тромбы. Флотирующие тромбы диагностированы в 6,8% случаев: у 1 пациента — в сафенофеморальном соустье при восходящем тромбозе ствола большой подкожной вены, у 1 — илеофеморальный тромбоз с флотирующей верхушкой в общей подвздошной вене, у 5 — в общей бедренной вене при тромбозе бедренно-подколенного сегмента и у 2 — в подколенной вене при ТГВ голени.
Протяженность нефиксированной (флотирующей) части тромба, по ультразвуковым данным, варьировала от 2 до 8 см. Чаще выявлялась умеренная подвижность тромботических масс (5 больных), в 3 случаях подвижность тромба была минимальной. У 1 пациента при спокойном дыхании визуализировались спонтанные движения тромба в просвете сосуда (высокая степень подвижности). В наших наблюдениях чаще выявлялись флотирующие тромбы с неоднородной эхоструктурой (7 человек), при этом в дистальном отделе преобладал гиперэхогенный компонент, а в области головки тромба — гипоэхогенный (рис. 2).
Рис. 2.
Флотирующий тромб в общей бедренной вене. В-режим, продольное сканирование вены. Тромб гетероэхогенной структуры с четким гиперэхогенным контуром.
В первом случае зафиксирован изоэхогенный тромб с гиперэхогенным контуром (рис. 3), во втором — гомогенный «организованный» тромб с четким контуром (рис. 4).
Рис. 3.
Флотирующий тромб в поверхностной бедренной вене. В-режим, продольное сканирование вены. Тромб изоэхогенной структуры с гиперэхогенным контуром.
Рис. 4.
Флотирующий тромб в поверхностной бедренной вене. В-режим, продольное сканирование вены. Тромб гомогенной эхоструктуры с четким контуром.
В группе пациентов с клиникой ТЭЛА у 5 (22,7%) больных имел место ТГВ различных стадий развития (преимущественно бедренно-подколенный сегмент).
В динамике для оценки течения тромботического процесса были обследованы 82 пациента, из них у 63 (76,8%) отмечалась частичная реканализация тромботических масс. В этой группе у 28 (44,4%) больных наблюдался центральный тип реканализации (при продольном и поперечном сканировании в режиме ЦДК реканализационный канал визуализировался в центре сосуда); у 23 (35%) пациентов диагностирована пристеночная реканализация тромботических масс (чаще кровоток определялся вдоль стенки вены, непосредственно прилежащей к одноименной артерии); у 13 (20,6%) больных выявлялась неполная реканализация с фрагментарным асимметричным окрашиванием в режиме ЦДК. Тромботическая окклюзия просвета вены наблюдалась у 5 (6,1%) больных, в 6 (7,3%) случаях отмечалось восстановление просвета вены. Признаки ретромбоза сохранялись у 8 (9,8%) обследованных.
Выводы
Комплексное ультразвуковое исследование, включающее ангиосканирование с использованием спектрального, цветового и энергетического допплеровских режимов и эхографию мягких тканей, является высокоинформативным и безопасным методом, позволяющим наиболее достоверно и быстро решать вопросы дифференциальной диагностики и лечебной тактики в амбулаторной флебологической практике. Это исследование целесообразно проводить на амбулаторном этапе для более раннего выявления пациентов, которым не показана (а иногда и противопоказана) тромболитическая терапия, и направления их в профильные отделения; при подтверждении наличия венозного тромбоза необходимо выявлять лиц с высоким риском развития тромбоэмболических осложнений; наблюдать в динамике за течением тромботического процесса и тем самым корректировать лечебную тактику.
Литература
- Lindblad, Sternby N.H., Bergqvist D. Incidence of venous thromboembolism verified by necropsy over 30 years. // Br.Med.J. 1991. V. 302. P. 709-711.
- Савельев В.С. Тромбоэмболия легочной артерии — классификация, прогноз и хирургическая тактика. // Грудная и сердечно-сосудистая хирургия 1985. N°5. С. 10-12.
- Баркаган З.С. Геморрагические заболевания и синдромы. Изд. 2-е, перераб. и доп. М.:Медицина 1988; 525 с.
- Bergqvist D. Postoperative thromboembolism. // New York 1983. P. 234.
- Савельев В.С. Флебология. М.: Медицина 2001; 664 с.
- Кохан Е.П., Заварина И.К. Избранные лекции по ангиологии. М.: Наука 2000. С. 210, 218.
- Hull R., Hirsh J., Sackett D.L. et al. Combined use of leg scenning and impedance plethysmography in suspected venous thrombosis. An alternative to venography. // N.Engl.J.Med. 1977. N° 296. P. 1497-1500.
- Савельев В.С., Думпе Э.П., Яблоков Е.Г. Болезни магистральных вен. М., 1972. С. 144-150.
- Альбицкий А.В., Богачев В.Ю., Леонтьев С.Г. и др. Ультразвуковое дуплексное ангиосканирование в диагностике ретромбозов глубоких вен нижних конечностей. // Кремлевская медицина 2006. N°1. С. 60-67.
- Харченко В.П., Зубарев А.Р., Котляров П.М. Ультразвуковая флебология. М.: ЗОА «Эники». 176 с.
УЗИ аппарат HM70A
Экспертный класс по доступной цене.
Монокристальные датчики, полноэкранный режим отображения, эластография, 3D/4D в корпусе ноутбука. Гибкая трансформация в стационарный сканер при наличии тележки.
Лечение ТВВ
Ведение пациентов с ТВВ зависит от начала заболевания (острое или хроническое), клиники, этиологических факторов, приведших к ТВВ, возраста и других факторов. Осложнения ТВВ – асцит, кровотечение из ВРВ – лечатся так же, как и при ЦП с ПГ.
При остром ТВВ рекомендуется антикоагулянтная терапия, которая приводит к полному или частичному восстановлению просвета ВВ у 70–80 % больных [5, 12, 15].
Спонтанный лизис тромба при ТВВ возможен, однако встречается очень редко. Антикоагулянтная терапия не увеличивает риска кровотечений, зато снижает риск инфаркта кишечника, который является жизнеугрожающим. Частота рецидивов ТВВ варьируется от 6 до 40 % [2, 21], поэтому некоторые авторы рекомендуют проводить антикоагулянтную терапию в течение 6 месяцев [10, 21].
Тромболизис через транспеченочный доступ при остром ТВВ является методом, позволяющим избегать побочных эффектов системной антикоагулянтной терапии. Тромболизис может проводиться и системно, особенно в случаях острого тотального или субтотального окклюзирования ВВ [9, 10].
К сожалению, до сих пор нет четкого практического руководства по назначению антикоагулянтов у больных с ТВВ. Как выбрать правильный антикоагулянт? Какие дозы следует применять? Когда прекращать антикоагулянтную терапию? Какие противопоказания существуют к применению антикоагулянтов? Для того чтобы ответить на эти вопросы, необходимы большие рандомизированные исследования.
Хирургические методы лечения включают чреспеченочную ангиопластику, тромболизис с последующим трансюгулярным внутрипеченочным портосистемным шунтированием (TIPS), тромбэктомию с локальной инфузией фибринолитика. Если больному планируется шунтирование, предпочтительнее проводить дистальное спленоренальное шунтирование [5, 10]. Спленэктомии следует избегать, поскольку она сама является этиологическим фактором развития ТВВ. Основные методы медикаментозного и хирургического лечения ТВВ представлены в табл. 2.
. Основные методы лечения ТВВ.
Лечение тромбоза воротной вены
Цель лечения тромбоза воротной вены – восстановление кровотока, минимизация последствий закупорки вены, профилактика рецидивов. Применяется консервативное и оперативное лечение патологии.
Консервативное лечение сводится к применению такие групп препаратов, как: антикоагулянты, плазмозаменители (восполняющие объем кровотока после кровотечения), тромболитики, диуретики при асците, глюкокортикостероиды.
Прогноз заболевания
Исход тромбоза различен. К благоприятным относят асептический аутолиз тромба, возникающий под влиянием протеолитических ферментов лейкоцитов. Мелкие тромбы могут полностью подвергаться асептическому аутолизу. Чаще тромбы, особенно крупные, замещаются соединительной тканью, т. е. организуются. Врастание соединительной ткани в тромб начинается в области головки со стороны интимы сосуда, далее вся масса тромба замещается соединительной тканью, в которой появляются щели или каналы, выстланные эндотелием, происходит т. н. канализация тромба. Позже выстланные эндотелием каналы превращаются в сосуды, содержащие кровь, в таких случаях говорят о васкуляризации тромба, что нередко восстанавливает проходимость сосуда для крови. Однако организация тромба не всегда заканчивается его канализацией и васкуляризацией. Возможны обызвествление тромба, его петрификация; в венах при этом иногда возникают камни – флеболиты [3, 9, 10, 13].
К неблагоприятным исходам тромбоза относят: • отрыв тромба или его части и превращение в тромбоэмбол, который является источником тромбоэмболии; • септическое расплавление тромба, возникающее при попадании в тромботические массы пиогенных бактерий, что ведет к тромбобактериальной эмболии сосудов различных органов и тканей (при сепсисе). Прогноз при ТВВ полностью определяется этиологией данного заболевания. У взрослых с ТВВ 10-летняя выживаемость составляет, по разным данным, 38–60 % [9, 21]. Пациенты погибают в основном от осложнений фоновых заболеваний (ЦП, рак печени). Смертность от кровотечений из ВРВ у пациентов с ТВВ без ЦП не превышает 5 %, в то время как при ЦП этот показатель равняется 30–70 % [9,21].
В заключение следует отметить, что ТВВ является серьезным заболеванием, нуждающимся в немедленной диагностике и интенсивном лечении с целью профилактики осложнений, таких как формирование кавернозной трансформации и прогрессирование ПГ. Выживаемость пациентов с портальными тромбозами напрямую зависит от быстроты и тщательности диагностики, использования современных методов инструментального и лабораторного обследования и визуализации тромбоза, оценки сопутствующих тромбофилических состояний, увеличивающих риск возникновения осложнений. Ранняя антикоагулянтная и антиагрегантная терапия способствует реперфузии тромбированных участков вен портальной системы и, несмотря на риск возникновения желудочно-кишечных кровотечений, необходима пациентам с ТВВ, а также с диагностированной ПГ и кавернозной трансформацией ВВ.
Причины развития
Чаще всего тромбы образовываются в сосудах нижних конечностей и малого таза. Причина этого – пребывание человека преимущественно в вертикальном положении. При ходьбе нагрузка на ноги возрастает, потому что крови приходится развивать повышенную скорость для циркулирования в вертикальном направлении.
Причины формирования тромбов:
- Механические, аллергические, инфекционные повреждения сосудистой стенки. Нарушение гладкости внутренней стенки вены создает предпосылки для накапливания в этом месте клеток крови. При повышенной концентрации кровяных клеток формируется тромб.
- Повышенная свертываемость крови. Наследственность, вредные привычки, воздействие внешней среды, последствия перенесенных заболеваний могут стать причинами изменения показателя свертываемости.
- Замедленное кровообращение. Гиподинамия, заболевания сердца и сосудов негативно влияют на скорость кровотока. При этом кровь на может с оптимальной скоростью проходить через венозные клапаны, она движется в обратном направлении, застаивается.
Совокупность этих причин получила название «триада Вирхова». Она считается важным показателем для диагностики тромбоза. Поскольку скорость кровотока и диметр нижней полой вены не создают предпосылок для тромбообразования, эта патология развивается в результате миграции в нее тромба из нижних конечностей, сосудов брюшной полости, малого таза.
Факторы риска
Факторы, предрасполагающие к тромбообразованию:
- Травмы конечностей и брюшной полости;
- Наличие злокачественной опухоли;
- Оперативное вмешательство в брюшной полости, на органах мочеполовой системы, на нижних конечностях;
- Прием гормональных контрацептивов;
- Инфекции, передающиеся через кровеносную систему;
- Варикоз в анамнезе;
- Сложное течение беременности и родов;
- Аллергия, аутоиммунная патология;
- Гормональный дисбаланс;
- Заболевания эндокринной системы;
- Длительно выдерживаемый постельный режим.
В группе риска находятся пожилые люди, пациенты с хроническими заболеваниями, а так же те, кто имеет лишний вес, подверженность вредным привычкам, профессию, предполагающую статичность позы.