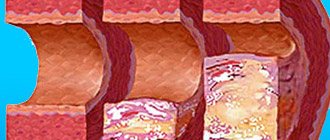
Степени патологии
ХЦВН представляет собой постепенное нарушение деятельности мозга, при котором ярко выражены симптомы повреждения мозговых клеток из-за недостаточной циркуляции крови в головном мозге. Патологии подвержены в основном пожилые люди после 50 лет.
Различают 3 степени (стадии) клинического течения заболевания:
- Начальная стадия (1 степень). Симптомы: головные боли, нарушение работы вестибулярного аппарата (неустойчивой походкой), бессонница, ухудшение памяти, быстрая утомляемость и пониженная работоспособность. Происходят изменения структуры глазного дна (ангиопатия сетчатки глаз), повышенное АД, сердечная аритмия.
- На средних стадиях (2 степень) сосудистой деменции наблюдается снижение умственных и интеллектуальных способностей, склероз сосудов головного мозга, изменение структуры мозговой жидкости.
- На последней стадии (3 степень) ХЦВН больным присваивают инвалидность из-за ярко выраженных признаков нарушения умственной деятельности.
Часто заболевание сопровождается приступами инсульта, инфаркта миокарда и сердечной аритмией.
Современные представления о хронической недостаточности мозгового кровообращения
В свою очередь, показатель распространенности деменции составляет 5–10% среди лиц старше 60 лет [3]. Исходя из приведенных данных, можно сделать вывод, что 0,5–2,5% пожилых людей страдают сосудистой деменцией. Число лиц с сосудистыми когнитивными расстройствами, не достигающими выраженности деменции, предположительно, в 2–3 раза больше, чем число страдающих сосудистой деменцией [3, 4]. Таким образом, распространенность ХНМК может достигать до 10% лиц старше 60 лет.
В отечественной неврологической практике используется несколько синонимичных диагностических формулировок для обозначения ХНМК:
- дисциркуляторная энцефалопатия (ДЭП);
- хроническая ишемия головного мозга;
- гипертоническая энцефалопатия;
- хроническая сосудистая мозговая недостаточность;
- хроническая цереброваскулярная недостаточность;
- хроническая цереброваскулярная болезнь;
- ишемическая болезнь мозга.
Все приведенные выше диагностические формулировки можно рассматривать как синонимы, которые обозначают клинический синдром, развивающийся при хроническом прогрессирующем неинсультном поражении головного мозга. Столь значительное разнообразие диагноcтических формулировок отражает историю изучения ХНМК, эволюцию взглядов на эту проблему и отсутствие на сегодняшний день единого взгляда на патогенетические механизмы и клинику ХНМК.
Термин «дисциркуляторная энцефалопатия» был предложен в 1958 г. выдающимися отечественными неврологами профессорами Г.Э. Максудовым и В.М. Коганом [5]. Под этим термином было предложено понимать хроническое прогрессирующее диффузное поражение головного мозга в результате хронической ишемии и гипоксии, которое проявляется прогрессирующими когнитивными и другими неврологическими расстройствами. В 1985 г. данный термин был включен в отечественную классификацию сосудистых заболеваний головного мозга, принятую на пленуме Всесоюзного общества неврологов (рис. 1) [6].
Развитие методов нейровизуализации в конце ХХ – начале ХХI в. заставило подвергнуть определенной ревизии представление о патогенетических механизмах развития клинического синдрома ДЭП. Было показано, что наряду с хронической ишемией и гипоксией, которая приводит к развитию диффузных изменений белого вещества (лейкоареоз (ЛА)), существенный вклад в развитие ДЭП также вносят повторные острые нарушения мозгового кровообращения без клиники инсульта – так называемые «немые» инфаркты. Они развиваются бессимптомно или с минимальной, стертой или атипичной симптоматикой, которая не позволяет распознать инсульт. Однако в последующем накопление объема повреждения мозга в результате повторных «немых» инфарктов способствует дальнейшему прогрессированию ДЭП [7, 8].
В связи с новыми представлениями о механизмах формирования ДЭП в 2001 г. академиком РАН, профессором Н.Н. Яхно была предложена новая редакция дефиниции ДЭП: «дисциркуляторная энцефалопатия – это синдром различной этиологии, проявляющийся прогрессирующими неврологическими, нейропсихологическими и психическими расстройствами, который развивается в результате повторных острых нарушений мозгового кровообращения и/или хронической недостаточности мозгового кровообращения» [9]. Приведенное определение наглядно демонстрирует предпочтительность термина «дисциркуляторная энцефалопатия (допускаются различные патогенетические механизмы сосудистого поражения головного мозга), перед термином «хроническая ишемия мозга» (имеется в виду наличие одного механизма поражения головного мозга).
Этиология и патогенез ДЭП
ДЭП – не самостоятельное заболевание, а осложнение разнообразных сердечно-сосудистых заболеваний. Список причин ХНМК повторяет список причин инсультов (табл. 1). На практике чаще всего ХНМК развивается в результате длительно существующей неконтролируемой артериальной гипертензии, атеросклероза церебральных артерий и фибрилляции предсердий с повторяющейся микротромбоэмболией в головной мозг.
Общность этиологических факторов обусловливает высокую коморбидность ДЭП и инсультов. Как правило, пациенты с ДЭП имеют инсульты в анамнезе, а пациенты, перенесшие инсульт, страдают также ДЭП. При наличии инсульта в анамнезе диагноз ДЭП правомерен в том случае, если инсульт не может объяснить всей имеющейся у пациента симптоматики и при исключении иного сопутствующего заболевания (например, нейродегенеративного).
Можно выделить 3 основных патогенетических механизма формирования хронического прогрессирующего неинсультного сосудистого поражения головного мозга при ДЭП [8–11]:
- повторные острые нарушения мозгового кровообращения без клиники инсульта («немые» инфаркты или «немые» кровоизлияния);
- ЛА;
- вторичная церебральная атрофия.
Как правило, «немые» инфаркты имеют небольшой объем, т. е. относятся к категории лакунарных инфарктов (менее 10–15 мм в диаметре). Единичный лакунарный инфаркт может оставаться бессимптомным. Однако при повторных лакунарных инфарктах (что часто наблюдается при отсутствии адекватного лечения артериальной гипертензии) накопление объема повреждения головного мозга приводит к формированию неврологической симптоматики. При этом данная симптоматика будет формироваться постепенно – как хроническое сосудистое поражение головного мозга [7, 8].
Характер неврологических симптомов при повторных лакунарных инфарктах определяется их локализацией. Вследствие анатомо-физиологических особенностей сосудистой системы головного мозга чаще всего лакунарные инфаркты обнаруживаются в подкорковых базальных ганглиях, внутренней капсуле, мосту и мозжечке [7, 8].
Поражение подкорковых базальных ганглиев (полосатые тела, таламус) в результате лакунарных инфарктов ведет к вторичной дисфункции лобных долей головного мозга. Это объясняется наличием тесной функциональной связи между лобной корой и подкорковыми образованиями. Поэтому нарушение взаимодействия между указанными областями приводит к вторичной дисфункции лобной коры. Клинический анализ неврологической и нейропсихологической симптоматики, которая наблюдается на начальных стадиях ХНМК, неоспоримо свидетельствует о ее связи с нарушением функционирования лобных долей головного мозга [8–11].
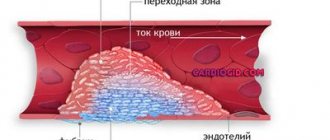
Под ЛА принято понимать весьма распространенные в пожилом возрасте изменения плотности и анатомического строения белого вещества головного мозга, которые часто ассоциированы с сосудистыми заболеваниями. При этом макроскопически определяется побледнение определенных участков белого вещества головного мозга, а микроскопически – демиелинизация, глиоз и расширение периваскулярных пространств (криблюры) [8, 10–13].
Патогенетические механизмы развития ЛА остаются не до конца изученными. Предполагается, что важную роль в этом играет эндотелиальная дисфункция, которая приводит к повышению проницаемости стенки сосудов микроциркуляторного русла. В результате нарушается гематоэнцефалический барьер, происходит пропотевание плазмы крови в паренхиму головного мозга, формируется хронический отек определенных отделов белого вещества (в первую очередь перивентрикулярных), который со временем может приводить к вторичным морфологическим изменениям. Считается также, что большое значение для возникновения ЛА имеют повторные эпизоды транзиторной локальной ишемии головного мозга без формирования инфаркта мозга (так называемые «незавершенные» инфаркты) [8, 10–13].
ЛА приводит к нарушению связи между различными корковыми, а также между корковыми и подкорковыми структурами (феномен разобщения). В результате разобщения в наибольшей степени страдают лобные доли головного мозга, что связано с их физиологической ролью. Дело в том, что функцией передних отделов мозга является управление познавательной деятельностью и поведением. При отсутствии связи с другими отделами мозга данная функция не может быть осуществлена [10, 11].
Церебральная атрофия – закономерный итог поражения белого вещества при хронической недостаточности кровоснабжения головного мозга. Она развивается по механизму так называемой «валеровской дегенерации»: разобщение лобных долей с остальными отделами мозга приводит к снижению активности нейронов передних отделов мозга. По общим физиологическим законам в функционально неактивных (а следовательно, «не нужных» мозгу нейронах) запускается процесс генетически запрограммированной гибели (апоптоза), который и приводит к церебральной корковой атрофии. При этом максимальная выраженность атрофического процесса наблюдается в передних отделах головного мозга. При нейровизуализации это проявляется непропорциональным расширением в данной области субарахноидальных пространств [14, 15].
Клиническая картина ДЭП
Клиническая картина ДЭП весьма вариабельна. Однако в подавляющем большинстве случаев в клинике доминируют неврологические, эмоциональные и когнитивные дисфункции лобных долей головного мозга, что отражает патогенетические основы и локализацию патологического процесса при ДЭП. Наиболее часто наблюдаются разнообразные сочетания когнитивных расстройств, депрессии и/или апатии и нарушений постуральной устойчивости, равновесия и походки [10, 11, 16, 17].
Традиционно выделяют 3 стадии ДЭП [9]:
I стадия. Характеризуется так называемыми субъективными неврологическими симптомами: головной болью, головокружением, шумом в ушах или голове, повышенной утомляемостью, нарушением сна, забывчивостью. Объективно выявляется «рассеянная» неврологическая симптоматика в виде повышения и/или асимметрии сухожильных рефлексов, легкой дискоординации, нистагма, интенционного тремора и др. Ранее предполагалась, что в основе клинических симптомов на данной стадии лежит нарушение функции нейронов в результате хронической ишемии и гипоксии без формирования структурного дефекта. Однако развитие методов нейровизуализации убедительно показало, что в реальности структурные изменения предшествуют нарушению функции: достаточно длительное время сосудистое поражение головного мозга может оставаться бессимптомным. В настоящее время распространено представление о том, что в основе субъективных неврологических симптомов I стадии ДЭП лежат эмоциональные нарушения, связанные с лобной дисфункцией: так называемая сосудистая депрессия или эмоциональная лабильность [17–20].
На II стадии ДЭП субъективные неврологические симптомы утрачивают свою актуальность, снижается критика и в то же время формируется более отчетливая объективная неврологическая симптоматика. Может развиваться 1 или несколько из следующих неврологических синдромов [9]:
- умеренные когнитивные нарушения (табл. 2);
- псевдобульбарный;
- нарушения походки и равновесия (лобная дисбазия);
- амиостатический;
- пирамидный.
На III стадии ДЭП отмечается сочетание нескольких из указанных выше неврологических синдромов, когнитивные нарушения достигают выраженности деменции, присоединяются тазовые расстройства [2, 9].
Диагностика и дифференциальная диагностика ДЭП
Для диагностики синдрома ДЭП необходимы наличие когнитивных нарушений и другой характерной неврологической симптоматики, базисного сосудистого заболевания и доказательства причинно-следственной связи между сосудистым заболеванием и поражением ЦНС (табл. 3).
Одним из существенных доказательств сосудистой природы поражения головного мозга являются характерные особенности когнитивного статуса. При ДЭП, по крайней мере на начальных ее стадиях, нарушения памяти отсутствуют или представлены в небольшой степени. На первый план в структуре когнитивных расстройств выходят нарушения управляющих лобных функций в виде снижения активности психической деятельности, нарушения планирования, когнитивной инертности и недостаточности контроля [16, 22, 23]. Для выявления указанных нарушений следует использовать специфические «лобные» нейропсихологические тесты. В частности, «лобные» тесты включены в Монреальскую шкалу когнитивных нарушений (Мока-тест). Международное научное сообщество в настоящее время рекомендует использовать их для скрининга недементных сосудистых когнитивных расстройств [24].
Непростой, но актуальной клинической задачей является дифференциальный диагноз между сосудистыми и первично-дегенеративными когнитивными расстройствами, поскольку ДЭП и нейродегенеративный процесс представляют собой самые распространенные причины когнитивных нарушений у пожилых людей. В основе дифференциального диагноза лежит анализ нейропсихологических особенностей и неврологической симптоматики. Как уже указывалось выше, при ДЭП преобладают нарушения «лобных» управляющих функций, в то время как при нейродегенеративном процессе – нарушения памяти. В неврологическом статусе при ДЭП выявляются псевдобульбарный, амиостатический синдромы, нарушения равновесия и ходьбы. При первичных дегенеративных когнитивных расстройствах очаговая неврологическая симптоматика отсутствует вплоть до стадии тяжелой деменции [2, 9, 17, 22, 23].
Для дифференциального диагноза ДЭП и нейродегенеративного процесса, а также выявления сочетанных форм используется модифицированная шкала Хачинского (табл. 4) [25].
Надежной верификацией диагноза ДЭП является нейровизуализация – компьютерная, рентгеновская или, предпочтительнее, магнитно-резонансная томография. Данный метод исследования позволяет визуализировать последствия перенесенных острых нарушений головного мозга и ЛА [10, 11]. Наличие этих изменений – неоспоримое доказательство сосудистого поражения головного мозга. Однако даже при наличии доказанного сосудистого церебрального поражения клиническая симптоматика может вызываться разными причинами. Так, не менее 15% деменций в пожилом возрасте относятся к так называемой «смешанной» деменции, когда цереброваскулярная недостаточность сочетается с болезнью Альцгеймера. Столь частое сочетание сосудистого и дегенеративного поражения головного мозга объясняется общими факторами риска и патогенетическими механизмами [26].
Лечение ДЭП
ДЭП не является самостоятельной нозологической формой. Это полиэтиологический синдром, который может осложнять течение различных сердечно-сосудистых заболеваний, например, артериальной гипертензии, церебрального атеросклероза и др. Лечение ДЭП в первую очередь должно быть направлено на основное заболевание. Только оптимальный контроль всех имеющихся факторов риска нарушений мозгового кровообращения позволяет приостановить или замедлить прогрессирование недостаточности мозгового кровообращения. Лечение базисного сосудистого заболевания составляет, таким образом, этиотропную терапию ДЭП. Обычно она повторяет мероприятия по вторичной профилактике инсульта и включает антигипертензивную, антитромбоцитарную, или антикоагулянтную, и гиполипидемическую терапию, методы сосудистой хирургии.
Патогенетическая терапия ДЭП должна быть направлена на оптимизацию мозгового кровотока и создание нейрометаболической защиты головного мозга от ишемии и гипоксии.
В повседневной практике чаще всего используются вазоактивные препараты, воздействующие на церебральную микроциркуляцию. К таким препаратам относятся:
- ингибиторы фосфодиэстеразы: пентоксифиллин (Вазонит®), винпоцетин, аминофиллин, стандартный экстракт листьев гинкго двулопастного и др. Фермент фосфодиэстераза участвует в метаболизме циклического аденозинмонофосфата. Увеличение его содержания в гладкомышечных клетках сосудистой стенки в результате снижения активности фосфодиэстеразы ведет к их расслаблению и увеличению просвета сосудов;
- блокаторы кальциевых каналов – циннаризин, нимодипин, дилтиазем также обладают вазодилатирующим эффектом, в основе которого лежит уменьшение содержания внутриклеточного кальция в гладкомышечных клетках сосудистой стенки;
- блокаторы α2-адренорецепторов: ницерголин, пирибедил, α-дигидроэргокриптин. Данные препараты устраняют сосудосуживающее действие медиаторов симпатической нервной системы – адреналина и норадреналина, а также (за счет действия на церебральные пресинаптические рецепторы) увеличивает активность норадренергической медиации в головном мозге.
Эффективным вазоактивным препаратом, который хорошо зарекомендовал себя в многолетней клинической практике, является пентоксифиллин (Вазонит®, , Австрия). Данный препарат представляет собой производное метилксантина, который обладает способностью эффективно ингибировать фосфодиэстеразы 4-го типа в гладкомышечных клетках сосудистой стенки и форменных элементах крови. Применение Вазонита приводит к расширению церебральных сосудов небольшого калибра. При этом, по экспериментальным данным, в наибольшей степени препарат воздействует на пораженные сосуды в ишемизированных отделах головного мозга. Поэтому назначение Вазонита не вызывает эффекта «обкрадывания». Помимо этого, ингибирование фосфодиэстеразы в форменных элементах крови уменьшает агрегационную активность тромбоцитов и эритроцитов, способствует увеличению деформируемости тромбоцитов и эритроцитов и снижению вязкости крови [27–30].
Лекарственная форма Вазонита – таблетки пролонгированного действия, что позволяет принимать их 2 р./сут – утром и вечером. При этом нет ночных перерывов в лечении, т. е. «перекрываются» полные сутки при 2-кратном приеме.
Пентоксифиллин может назначаться как внутрь, так и внутривенно с достаточно широким диапазоном доз. Тем не менее рекомендуется назначать пентоксифиллин в таблетках по 600 мг (пролонгированная форма) 2 р./сут с едой.
Эффект пентоксифиллина может наступать в промежутке от 2-й до 4-й нед., но лечение должно продолжаться как минимум 8 нед. [31].
Высокая эффективность пентоксифиллина была продемонстрирована как в многочисленных клинических исследованиях, так и в многолетней повседневной клинической практике. Так, в исследовании А.Н. Бойко и соавт. пентоксифиллин назначался 55 пациентам с последствиями нетяжелого инсульта. На фоне данной терапии было отмечено достоверное улучшение памяти, внимания и других когнитивных функций [27].
В 1980–1990-е гг. в европейских странах было проведено более 20 рандомизированных двойных слепых плацебо-контролируемых исследований. Их результаты убедительно показали, что использование пентоксифиллина у пациентов с сосудистой деменцией и менее тяжелыми когнитивными нарушениями сопровождается достоверным улучшением когнитивных функций, а также регрессом других неврологических расстройств. При этом терапия пентоксифиллином способствовала клинически значимому уменьшению выраженности когнитивных и других неврологических расстройств как при ХНМК, так и при деменции, развившейся в результате повторных острых нарушений мозгового кровообращения [28–30].
За длительное время практического применения пентоксифиллин показал высокий профиль безопасности и хорошую переносимость, в т. ч. у пациентов пожилого возраста. Препарат не оказывает негативного влияния на жизненно важные функции и крайне редко вызывает побочные эффекты [28–30].
В отечественной практике вазоактивные препараты принято назначать курсами по 2–3 мес. 1–2 р./год. Однако в последнее время обсуждается целесообразность и более длительной сосудистой терапии.
Широко применяется при ДЭП также нейрометаболическая терапия. Целями данного вида лечения являются создание нейрометаболической защиты головного мозга от ишемии и гипоксии, а также стимуляция репаративных процессов в головном мозге. К препаратам нейрометаболического действия относятся пирацетам, этилметилгидроксипиридина сукцинат, холина альфосцерат, цитиколин и др.
Метаболическая терапия проводится курсами 1–2 р./год. Патогенетически оправданным и целесообразным является сочетанное проведение вазоактивной и метаболической терапии.
В заключение следует подчеркнуть, что воздействие и на причину, и на основные симптомы ДЭП, несомненно, будет способствовать как замедлению прогрессирования ДЭП, так и регрессу уже имеющейся симптоматики и, в конечном итоге, повышению качества жизни пациентов и их родственников.
Симптоматические проявления
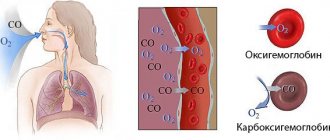
Цереброваскулярная болезнь — это патологическое изменение сосудов мозга, провоцирующее нарушение циркуляции мозгового кровотока. Патологии предшествуют атеросклероз и гипертония, а ее следствием является инсульт с инвалидностью или летальным исходом.
Этиология заболевания выражается в медленном сужении мелких артерий в мозге, развитии очаговой ишемии белого мозгового вещества. Симптомы проявления цереброваскулярной болезни следующие:
- постоянные головные боли;
- шумы в ушах;
- приступы головокружения;
- уменьшение поля зрения, пятна перед глазами;
- психические дисфункции (нарушение мышления, памяти, снижение внимания, бессонница, дрожание пальцев рук, замедление речи);
- изменение поведения (вялость, апатичность, беспричинная раздражительность и обидчивость);
- патологические поражения большей части головного мозга, выраженные в нарушении координации движения, параличах, расстройства речи и памяти, признаки паркинсонизма, слабоумие.
Цереброваскулярная болезнь делится на острые и хронические формы.
Острые виды ЦВБ:
- острая энцефалопатия по гипертоническому типу;
- транзисторный ишемический криз;
- геморрагический или ишемический инсульт.
Хроническая форма цереброваскулярной патологии — дисциркулярная энцефалопатия, которая, подразделяется на следующие виды:
- тромбоз сосудов головного мозга — непроходимость сосудов из-за закупорки просвета тромбами или атеросклеротическими бляшками;
- церебральная эмболия — закупорка мелких сосудов эмболами, оторвавшимися от крупных сосудов;
- мозговое кровотечение, вызванное разрывом сосуда (геморрагический инсульт);
- дисциркулярная энцефалопатия с последующим переходом в острую форму ЦВБ.
Белкин А.А., Зислин Б.Д., Лейдерман И.Н., Доманский Д.С.
Андрей Августович Белкин, доктор медицинских наук, профессор Директор Клинического Института Мозга СУНЦ РАМН
Клинический институт Мозга СУНЦ РАМН,
Клиника нервных болезней и нейрохирургии Уральской государственной медицинской академии,
Служба нервных болезней и нейрохирургии городской клинической больницы №40
Резюме:
В связи с внедрением в клиническую практику ряда ЛПУ представлений о синдроме острой церебральной недостаточности возникает множество вопросов по клинической интерпретации и подходам к диагностике, мониторингу и лечению больных, отвечающим его критериям. Пытаясь найти методически адекватные решения этой проблемы, специалисты нейрореаниматологии ведут комплексную научную разработку воспроизводимых способов нейромониторинга и церебротропной интенсивной терапии. Теория ОЦН становится направлением, определяющим научные исследования в разработке новых методов интенсивной церебротропной терапии, а также способов нейрорепарации и нейропротекции в качестве компонентов комплексной патогенетической терапии нейропатологических синдромов, развивающихся в результате формирования патологических систем. в ответ на воздействие патологических детерминант.
Современную реаниматологию отличает возрастающая патофизиологическая обоснованность используемых лечебно-тактических подходов. Симптоматическая терапия уступает место синдромной, направленной на коррекцию основных системных повреждений: острую дыхательную, сердечно-сосудистую, печеночную, почечную недостаточность и сепсис. У реаниматологов остается все меньше разногласий по поводу клинических критериев, мониторинга и лечения указанных состояний. А как быть с повреждением центральной нервной системы? Существует ли синдром острой церебральной недостаточности? В поисковой машине Интернета мы обнаружили более 30 цитат с упоминанием «острая церебральная недостаточность», что убедило нас в том, что реаниматологи интуитивно уже определили для себя клинический смысл состояния, для которого на сегодняшний день нет приемлемого физиологического обоснования. Иными словами, статус органа, являющегося объектом постоянного внимания реаниматолога, не имеет методологии оценки. Подобное положение мотивировало нас попытаться найти аргументы в пользу признания самостоятельности синдрома острой церебральной недостаточности (ОЦН) и сформулировать принципы его интенсивной терапии.
На современном этапе развития реаниматологии и интенсивной терапии общепризнанной является главенствующая роль системной воспалительной реакций в формировании критического состояния любой этиологии. Во-первых, постагрессивная реакция сама по себе является проявлением СВР. Во-вторых, органная дисфункция возникает вследствие прогрессирования СВР. В-третьих, даже очаговая ишемия как вариант церебральной недостаточности протекает с явлениями эндотелиальной дисфункции, что тоже свидетельствует о генерализации воспалительной реакции в ответ на повреждение нервной системы, Все больше публикаций подтверждает тот факт, что острое церебральное повреждение является проявлением классической постагрессивной реакции (SIRS-CARS-CHAOS) [3.6, 73.8, 3.11] (рис. 1).
Рисунок 1
Современная схема патогенеза генерализованной воспалительной реакции [6 ]
Нас же интересует патогенез органной дисфункции. В этой связи наиболее продуктивной может быть признана сформулированная академиком Г.Н.Крыжановским концепция формирования патологических систем в центральной нервной системе (ЦНС) [3.3]. В сжатом изложении она выглядит так (рис. 2): в результате повреждения ЦНС происходит выпадение функций по механизму нейронного торможения (очаговая ишемия) и (или) перерыва структурных связей (сотрясение головного мозга), масштаб которых соответствует объему повреждения. Высокая пластичность нервной системы позволяет компенсировать органную дисфункцию ЦНС за счет активизации резервных нейронных сетей и перераспределения функций по генетически определенному алгоритму. Но адаптивные механизмы не всегда рациональны. Активируются не только «полезные» нейроны, но «агрегаты гиперактивных нейронов», продуцирующие усиленный, неконтролируемый поток импульсов как результат недостаточности тормозных механизмов. Генерируя патологическое возбуждение, они формируют очаг в нервной системе, определяемый как патологическая детерминанта (ПД), которая устанавливает систему связей со структурами ЦНС. Таким образом, создается патологическая система (ПС), которая определяет появление нейропатологических синдромов, имеющих в основе нейрохимические и молекулярные процессы. При действии веществ непосредственно нарушающих тормозные механизмы (нейротропные яды, фармсредства), ПС является первичной. Формирование вторичной ПС происходит из-за избыточного накопления возбуждающих нейромедиаторов (глутамат) в результате экстрацеребрального эндотоксикоза (сепсис) или диффузного повреждения головного мозга (черепно-мозговая травма). При этом могут образовываться несколько ПС, способных развивать самоподдерживающую активность без дополнительной стимуляции. В зависимости от топической локализации ПС она может иметь выход на периферию, при этом ее «мишенями» являются соматические органы, что реализуется в виде разнообразных проявлений вегетативной дисавтономии.
Рисунок 2
Патологические интеграции в центральной нервной системе (по Г.Г. Крыжановскому, 2003) [3]
Блокировать формирование ПС на этапе образования патологической детерминанты способны саногенетические антипатологические системы (САС) и комплексная патогенетическая терапия (КПТ), которые при эффективном взаимодействии могут полностью предотвратить развитие нейропатологического синдрома (рис. 2). КПТ — комплекс лечебных мероприятий, направленный на стабилизацию патологических систем путем воздействия на различные их звенья. На сегодняшний день основные лечебные мероприятия привязаны к нейропатологическим синдромам, что соответствует понятию посиндромного лечения в реаниматологии. Развитие научных представлений о патогенезе ОЦН способствует созданию протоколов терапии, имеющих превентивную направленность на подавление патологических детерминант и формирование ПС. Иными словами, чем ближе в патологической детерминанте точка приложения терапии (рис. 3), тем меньше вероятность развития нейропатологического синдрома. Примечательно, что большинство лечебных протоколов является ни чем иным, как управляемой моделью естественных антипатологических саногенетических систем (САС), которые в оптимальном варианте повышают или, по крайне мере, не влияют на их эффективность, в неблагоприятном — подавляют их проявления. Становится понятным феномен «чудесного» выздоровления некоторых пациентов, которым не проводилась адекватная интенсивная терапия. Никакого чуда нет. Просто у этих пациентов оказались достаточно активны естественные саногенетические антипатологические системы (САС).
Рисунок 3
Схема формирования нейропатологического синдрома
Рисунок 4
Саногенетические антипаталогические системы (САС)
Таким образом, САС представляет собой физиологический элемент в системе формирования ПС, действующий по принципу «антисистемы», то есть осуществляющий антагонистическую регуляцию, направленную на предотвращение развития и подавление активности действующих патологических систем. Примеры САС приведены на рисунке 4. К САС следует отнести хорошо известные и доступные клинической идентификации симптомокомплексы, наиболее ярким из которых является коматозное состояние, как наивысшая точка развития охранительного торможения в ответ на появление патологической детерминанты в виде очага гиперактивных нейронов. Другой пример — повышение артериального давления и открытие коллатералей в ответ на острую окклюзию церебральной артерий. С одной стороны — понятный конкретный вариант защиты от ишемии, с другой — действие САС, направленное на предотвращение формирования ПС ишемического инсульта. Число САС неопределенно велико, поэтому в схеме САС (рис.3) мы оставляем свободное место для продолжения списка доказанных или предполагаемых механизмов церебральной защиты — САС N.
Для нейрореаниматологии наибольший интерес представляет САС 1, которую мы обозначили как комплекс (система) церебральной защиты от ВЧГ.
Рисунок 5
Этапы реализации системы церебральной защиты
Рисунок 6
Эволюция острой церебральной недостаточности
Напомним вкратце основные этапы реализации данной системы защиты с точки зрения теории САС (рис. 4). Прежде всего, в результате полученного первичного повреждения в паренхиме мозга появляется популяция пострадавших клеток в состоянии цитотоксического отека из-за нарушенного трансмембранного транспорта электролитов (формируется патологическая детерминанта). В силу увеличившегося объема отечные клетки оказывают компримирующее воздействие на соседние клетки, вызывая тем самым масс-эффект. Так происходит распространение отека на интактные клетки. Продолжающееся увеличение патологического объема вызывает компрессию капиллярно-пиального русла. Это нарушает микроциркуляцию, вызывает гипоксию-ишемию в зонах, непосредственно не связанных с первичным масс-эффектом, и приводит к патологическому разобщению различных отделов содержимого черепа. В результате разобщения этих отделов давление, создаваемое спинномозговой жидкостью и пульсовыми колебаниями артерий, не может больше свободно распространяться вдоль расположенных внутри черепа и позвоночного канала тканей и пространств спинномозговой жидкости. Между вовлеченными в отек и сохранными структурами возникает разница паренхиматозного давления, что инициирует дислокацию в направлении более низкого давления. Итогом этого процесса является диффузный отек головного мозга и его смещение в направлении единственного (если нет трепанационного дефекта) открытого выхода из полости черепа — большого затылочного отверстия. Там происходит финальная компрессия стволовых структур с угнетением первичных центров дыхания и кровообращения и прекращение жизнедеятельности мозга. Так формируется и развивается патологическая система внутричерепной гипертензии. На каждом этапе ей противодействуют 5 элементов системы церебральной защиты или САС 1 (рис. 4). Комплекс механизмов компенсации определяется свойством податливости (1-2 на рис. 1), то есть способностью адаптироваться к увеличению объема краниоспинальной системы. Первым ответом на появление и распространение дополнительного объема является использование резерва эластичности мозгового вещества и свободных пространств внутри черепной коробки (1 на рис.4). Податливость краниоспинальной системы (краниоспинальный комплайнс — Сс) обеспечивается соответствием между продукцией и резорбцией спинномозговой жидкости (2 на рис. 4). Именно преобладание резорбции позволяет освободить дополнительные пространства для «отекающего» мозга, сдерживая развитие микроциркуляторных нарушений. По мере истощения резерва краниоспинального комплайнса эффективное церебральное перфузионное давление (ЦПД) обеспечивается за счет повышения системного давления (3 на рис. 5), что позволяет преодолевать возросшее периферическое сопротивление кровотоку. Система ауторегуляции мозгового кровообращения противодействует этому за счет резерва вазодилатации. При несостоятельности САС и КПТ перфузионное давление начинает снижаться, В клинических условиях [3.1] нами были получены доказательства наличия всех перечисленных компонентов за исключением последней ступени СЦЗ — повышенной экстракции О2. Но по данным литературы [3.2], она обеспечивает лишь очень кратковременное замедление уже мало обратимого и, чаще всего приводящего к смерти мозга, процесса выравнивания церебрального перфузионного и среднего артериального давления. Такова природа действия САС 1. Параллельно с ней действуют также САС 2 и 3. Мы не имеем собственных доказательств, подтверждающих участия данных систем реализации саногенетической реакции организма, но это теоретизирование вполне логично вытекает из концепции пластичности нервной системы. При сохранении жизнеспособности организма наступает период формирования патологической системы подострого и резидуального периода. В условиях достаточной эффективности САС 4 пациент имеет шанс на выздоровление (рисунок 6). Необходимо еще раз подчеркнуть, что КПТ может быть позитивной только в случае синергизма с САС 1-4.
Рисунок 7
Нейропатологические синдромы ОЦН
Переходя к клиническому представлению синдрома острой церебральной недостаточности следует остановиться на нейропатологических симптомо-комплексах (рисунок 7). Приведенная классификация основана на принципе топической и функциональной реализации патологической системы. Топическая идентификация синдрома, построенная на классической неврологической симптоматике, позволяет локализовать патологическую детерминанту. Очаговые или диффузные проявления уточняют природу процесса (структурный или метаболический). Характер воздействия на мозг оценивается по наличию симптомов раздражения или выпадения функций (например: гематома вызывает раздражение, а очаг инфаркта — выпадение функций). Определение функционального значения симптомов (двигательные, мышечно-тонические, нейромедиаторные и нейрогуморальные) является одной из ключевых задач диагностики и мониторинга, так как определяют направленность и активность интенсивной терапии. Мы не претендуем на завершенность приведенной классификации, но ее клиническая целесообразность доказана нашим многолетним опытом.
Подведем некоторые итоги. Мы полагаем, что имеются все основания считать острую церебральную недостаточность самостоятельным реанимационным синдромом.
Во-первых, потому, что у него имеется патофизиологическая основа (патогенез): ОЦН это полиэтиологичный, но монопатогенетический процесс, связанный с формированием патологических систем, ведущей из которых является внутричерепная гипертензия (ПС ВЧГ) с вариантами ее эволюции.
Во-вторых, синдром ОЦН имеет специфический комплекс нейропатологических синдромов.
В-третьих, синдром ОЦН имеет особые, свойственные только ему, принципы интенсивные терапии, направленные на усиление действия саногенетических антипатологических систем .
Практическим подтверждением справедливости данных положений является фактическая реализация концепции синдрома острой церебральной недостаточности в рамках областной программы «интенсивная терапия», которая действует в Свердловской области в течение 5 лет. В структуре стандарта интенсивной терапии ОЦН (рис.7) выделены несколько разделов:
· алгоритм тактики, описывающий систему взаимодействия между субъектами оказания неотложной помощи (скорая помощь, диагностические службы, нейрохирургические отделения, реанимационно-анестезиологические подразделения) при оказания поэтапной помощи больным с ОЦН. Следует отметить самое важное положение алгоритма: больные с ОЦН должны госпитализироваться в РАО;
· лечебные рекомендации по лечению основных нейропатологических синдромов, построенных на основе международных протоколов и консенсусов;
· лекарственный формуляр, включающие минимально достаточный перечень медикаментов и расходных материалов для реализации лечебных рекомендаций, в том числе и для мониторинга;
· шкалы оценки состояния и исходов — свод классификации и шкал, необходимых для унифицированно го подхода к клинической оценке состояния больных с ОЦН.
Анализ деятельности реанимационно-анестезиологической службы Свердловской области [12] показал, что введение стандарта существенно улучшило показатели лечения больных с церебральным повреждением, особенно при черепно-мозговой травме.
Рисунок 8
Структура регионального стандарта интенсивной терапии ОЦН
Таблица 1
| Нозологические формы нейрореанимационной патологии в 2005 году | Послеопе- рационные | Консер- вативно | ИТОГО | Уд. вес, % | США, A.Rooper% |
| Интракраниальные артериальные аневризмы сосудов головного мозга (САК) | 147 | 55 | 192 | 15 | 13 |
| АВМ | 6 | 3 | 9 | 0,7 | 2 |
| Окклюзирующие заболевания сосудов головного мозга | 19 | 5 | 24 | 1,9 | |
| Острая черепно-мозговая травма | 104 | 33 | 137 | 11 | 11 |
| Спинномозговая травма | 6 | 4 | 10 | 0,8 | 3 |
| Ишемический инсульт | 0 | 115 | 115 | 9 | 18 |
| Геморрагический инсульт | 0 | 8 | 8 | 0,6 | 7 |
| Постреанимационная болезнь | 1 | 3 | 4 | 0,3 | 4 |
| Судорожный синдром (эпистатус) | 0 | 0 | 1 | 0,00 | 3 |
| Миастеническое состояние | 0 | 2 | 2 | 0,2 | 4 |
| Энцефаломиелополирадикулонейропатия (ГБ) | 0 | 0 | 0 | 0 | 6 |
| Менингит/менингоэнцефалит | 0 | 3 | 3 | 0,2 | 2 |
| Опухоли гипофиза и гипофизарно-селлярной области, хиазмы и зрительных нервов, дна 3 желудочка | 71 | 1 | 72 | 34 | 25 |
| Опухоли основания черепа | 25 | 1 | 26 | ||
| Внутримозговые опухоли супратенториальной локализации | 215 | 7 | 222 | ||
| Внутримозговые опухоли субтенториальной локализации | 112 | 7 | 119 | ||
| Опухоли спинного мозга | 53 | 1 | 54 | ||
| Окклюзирующие поражения ликворовыводящих путей головного мозга | 89 | 4 | 93 | 7,3 | |
| Функциональная нейрохирургия, эпилепсия | 17 | 2 | 19 | 1,5 | |
| Нейрохирургия воспалительных поражений головного мозга, черепа, спинного мозга, позвоночника | 9 | 7 | 16 | 1,3 | |
| Дегенеративные поражения позвоночника | 122 | 1 | 123 | 13 | 2 |
| Последствия травматического поражения периферической нервной системы | 20 | 0 | 20 | ||
| Невралгия тройничного нерва | 14 | 0 | 14 |
Еще одним важным аргументом в пользу правомочности существования синдрома ОЦН можно признать факт наличия специализированных нейрореанимационных отделений. Популяцию больных этих отделений объединяет однородность нозологических форм и возможность широкого применения единых протоколов. Целесообразность выделения подобных отделений доказана в разных странах. При наличии существенных различий в организационных аспектах работы этих отделений имеется сходство именно в номенклатуре нозологий. В таблице 1 приведена структура пролеченных пациентов в нейрореанимационном РАО ГКБ ?40 Екатеринбурга и университетской клинике г. Бостона (США) [3.4]. Имеющиеся различия касаются, в основном, только номенклатуры нейрохирургических операций, выполняемых в данных госпиталях.
ВЫВОДЫ
1. Существование патофизиологической модели острой церебральной недостаточности, воспроизводимого стандарта лечебных, диагностических, тактических действий позволяют признать правомочным наряду с другими реанимационными синдромами (ОДН, ОГН, ОПН и др.) выделение синдрома ОСТРОЙ ЦЕРЕБРАЛЬНОЙ НЕДОСТАТОЧНОСТИ (ОЦН).
2. Теория ОЦН становится направлением, определяющим научные исследования в разработке новых методов интенсивной церебротропной терапии, а также способов нейрорепарации и нейропротекции (терапия стволовыми клетками) в качестве компонентов комплексной патогенетической терапии нейропатологических синдромов, развивающихся в результате формирования патологических систем. в ответ на воздействие патологических детерминант.
3. Знакомство с основами нейрореаниматологии должно быть предусмотрено в программе подготовки неврологов, нейрохирургов и общих реаниматологов.
Литература
1. Белкин А.А. Патогенетическое понимание системы церебральной защиты при внутричерепной гипертензии и пути ее клинической реализации у больных с острой церебральной недостаточностью. Интенсивная терапия, 2005, ?1.
2. Плам Ф., Познер Д. Диагностика ступора и комы. Москва, М.,1986, с.148-155.
3. Крыжановский Г.Н. Патологические интеграции в центральной нервной системе. Мозг. Теоретические и клинические аспекты. Медицина, М., 2003, с.52-67.
4. A.Rooper. Neurological and Neurosurgical Intensive Care. Lippincot Williams, 2004. 391p.
5. Черешнев В.А., Гусев Е.Ю., Юрченко Л.Н. Системное воспаление как типовой патологический феномен- миф или реальность?Вестник РАН, ?3, 2004, с. 18-23.
6. Bone R.С. Toward a theory regarding the pathogenesis of the systemic inflammatory response syndrome: what we do and do not know about cytokine regulation // Critical Care Medicine. — 1996. — V. 24 — N 1 — P. 163-72.
7. Bone R.C. Sir Isaac Newton, sepsis, SIRS, and CARS. Crit. Care Med. 1996; 245:1125-1128.
8. Bucci MN. Elevated intracranial pressure associated with hypermetabolism in isolated head trauma Acta Neurochir (Wien). — 1988. — N 93. — P. 133-136.
9. Hill AG. Initiators and propagators of the metabolic response to injury World J Surg. — 2000. -Vol 24, N 6. -P.624-629.
10. Ott M., Schmidt J., Young B. Nutritional and metabolic variables correlate with amino acid forearm flux in patients with severe head injury. Crit Care Med. — 1994. — Vol 22. — P. 393.
11. Rixen D., Siegel J.H., Friedman H.P. «Sepsis\SIRS», physiologic classification, severity stratification, relation to cytokine elaboration and outcome prediction in posttrauma ctitical illness. Journal of Trauma. — 1996. — Vol 41, N 4. — P. 581-598/
12. Левит А.Л. Организации работы реанимационно-анестезиологической службы Свердловской области в ХХI веке. Проблемы, решенные и нерешенные. Интенсивная терапия , 2005, ? 1, с. 23-27.
Причины ХЦВН
Причины, вызвавшие церебральный патогенез, делятся на основные и дополнительные.
Основные факторы:
- развивающийся атеросклероз мозговых сосудов;
- сахарный диабет, подагра;
- гиертония.
Дополнительные факторы:
- злоупотребление спиртными напитками;
- курение;
- преобладание в рационе питания жирной пищи;
- малоподвижный образ жизни;
- наследственные причины;
- воспалительные инфекции;
- остеохондроз шеи;
- заболевания сердечной системы;
- избыточный вес;
- повышенная свертываемость крови;
- полученные ранее травмы;
- отравления различными химическими препаратами;
- эмоциональные нагрузки (стресс, переживания).
Последствия ЦВБ
Цереброваскулярная болезнь опасна своими необратимыми последствиями. Нарушения кровообращения в головном мозге часто приводят к инсультам, сильными нарушениями памяти и мыслительной деятельности, затрудненностью ориентирования в пространстве, деменцией, припадками эпилепсии.
В некоторых случаях развивается болезнь Бинсвангера, сопровождающаяся развитием умственной отсталости, полной недееспособностью и нарушением речевых функций (дизартрия).
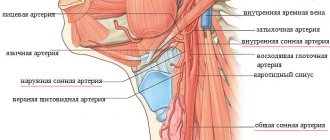
Недостаточность мозгового кровообращения в вертебрально-базилярном бассейне
Одной из частых причин возникновения головокружения является недостаточность мозгового кровообращения в вертебрально-базилярном бассейне (ВББ), которая может протекать в виде хронической ишемии, преходящих нарушений мозгового кровообращения или в виде инсультов.
Патогенез
Основными причинами ишемических изменений при данной патологии являются факторы, ограничивающие приток крови в вертебрально-базилярную систему или же способствующие избыточному оттоку из нее в другие сосудистые бассейны. Патогенез недостаточности мозгового кровообращения в ВББ может охватывать крайне широкий спектр изменений. Наряду с патологией сосудов вертебрально-базиллярной системы (стенозы и окклюзии) вследствие атеросклероза, большое значение имеют экстравазальные факторы. Например, возможен тромбоз позвоночной артерии, обусловленный диссекцией артерии при хлыстовой или иной травме шеи, неадекватных мануальных манипуляциях на шейном отделе позвоночника.
| Аномалия Киммерли |
К числу других причин относятся также патологические извитости, врожденные нарушения развития в виде гипо- и аплазии позвоночной артерии, аномалия Киммерли. При наличии последней при повороте головы происходят перегиб и компрессия позвоночной артерии с ее возможной травматизацией.
Также значимое влияние на кровоток в вертебрально-базилярном бассейне могут оказывать такие патологические состояния, как аномалия Клиппеля-Фейля-Шпренгеля, незаращение задней дужки атланта, седловидная гиперплазия боковых масс атланта, недоразвитие суставных отростков шейных позвонков, шейные ребра, “steal”-синдром (подключично-позвоночное обкрадывание) и ряд других. Кроме того, часто возникает закупорка сосудов тромбом, сформировавшимся и мигрировавшим в бассейн позвоночной или базилярной артерии из полости сердца.
Необходимо, однако, отметить, что большинство из перечисленных факторов значимы именно для острой сосудистой катастрофы, манифестирующей головокружением, – преходящих нарушений мозгового кровообращения или инсультов. Системного головокружения (т.е., когда у человека возникает ощущение падения, перемещения в пространстве, что сопровождается тошнотой и рвотой) при хронической недостаточности мозгового кровообращения не бывает никогда, а под несистемным чаще всего маскируется тревога, депрессия, ортостатическая гипотензия, метаболические расстройства (гипо-, гипергликемия), лекарственное головокружение, нарушения внимания, зрения и пр., которые требуют адекватной диагностики и лечения.
Клинические проявления
Ядром клинической картины при преходящих нарушениях мозгового кровообращения в вертебрально-базилярном бассейне являются эпизоды головокружения, часто сопровождающиеся тошнотой, рвотой, неустойчивостью при ходьбе и стоянии, шумом, ощущением заложенности в ушах, вегетативными расстройствами в виде профузного пота, тахикардии, побледнения или же наоборот покраснения кожи лица, длительностью от нескольких минут до нескольких часов. Также могут наблюдаться нарушения слуха (преимущественно снижение) и зрения («мушки» перед глазами, «затуманивание зрения», “нечеткость картины”). Крайне драматичными для больных являются внезапные падения без потери сознания («дроп-атаки», синдром Унтерхарншайдта), представляющие собой острое нарушение кровообращения в ретикулярной формации ствола мозга и возникающие обычно при резких поворотах или запрокидывании головы.
Инсульты в вертебрально-базилярном бассейне характеризуются быстрым началом (от появления первых симптомов до их максимального развития проходит не более 5 мин, обычно менее 2 мин), а также следующей неврологической симптоматикой:
- двигательные нарушения: слабость, неловкость движений или паралич конечностей;
- расстройства чувствительности: потеря чувствительности или парестезии конечностей и лица;
- нарушение зрения в виде двоения, выпадения полей зрения;
- нарушение равновесия, неустойчивость
- нарушение глотания и четкости речи.
Особой формой острого нарушения мозгового кровообращения в ВББ является инсульт “лучника” (bowhunter’s stroke), связанный с механической компрессией позвоночной артерии на уровне шейного отдела позвоночника при крайнем повороте головы в сторону.
Механическая компрессия позвоночной артерии на уровне шейного отдела позвоночника, лежащая в основе развития инсульта “лучника”.
Механизм развития такого инсульта объясняется натяжением артерии при повороте головы, сопровождающимся надрывом интимы сосуда (диссекцией) особенно у больных с патологическими изменениями артерий.
Диагностика
При диагностике недостаточности мозгового кровообращения в ВББ необходимо учитывать, что симптомы заболевания зачастую неспецифичны и могут быть следствием другой неврологической или иной патологии, что требует тщательного сбора жалоб пациента, изучения анамнеза заболевания, физикального и инструментального обследований для выявления главной причины его развития. Ведущую роль в диагностике клинически значимых изменений кровотока в вертебрально-базилярном бассейне в настоящее время играют нейровизуализационные методы исследования головного мозга (МРТ и КТ), а также ультразвуковая допплерография и дуплексное сканирование с ЦДК, позволяющие неинвазивно и сравнительно дешево оценить структуру и проходимость сосудистого русла.
Важно отметить, что дифференциальная диагностика между головокружением, вызванным поражением мозжечка и/или ствола головного мозга (центрального) и возникающим при нарушении функции вестибулярного аппарата или вестибулярного нерва (периферического), не всегда проста. С одной стороны очень часто за инсульт принимаются такие состояния как доброкачественное пароксизмальное позиционное головокружение, в то же самое время иногда пациенты с острой сосудистой недостаточностью в ВББ ошибочно проходят лечение по поводу “шейного остеохондроза c вестибулопатическим синдромом” у мануальных терапевтов и остеопатов с развитием соответствующих осложнений.
Лечение
В случае остро возникшего неврологического дефицита (альтернирующих синдромов, мозжечковой недостаточности, «негативных» скотом и т. д.) пациент должен быть в экстренном порядке госпитализирован в региональный сосудистый центр или неврологическое отделение для исключения инсульта в ВББ. При его подтверждении лечение производится согласно актуальным в настоящее время руководствам и рекомендациям.
При головокружении на фоне хронической недостаточности мозгового кровообращения в ВББ основное внимание уделяется препаратам, улучшающим кровообращение головного мозга за счет вазодилатирующего и реопозитивного действия (винпоцетин, циннаризин, бетагистин и др.). Большое значение имеет адекватная коррекция артериального давления, профилактика тромбообразования при различных нарушениях сердечного ритма.
← Назад
Диагностика хронической цереброваскулярной недостаточности
Лабораторное обследование состоит из клинического анализа крови на определение уровня тромбоцитов, эритроцитов, гемоглобина, гематокрита, лейкоцитов с развернутой лейкоцитарной формулой. Проводится анализ липидного спектра, скорости свертываемости крови, уровня глюкозы в крови.
Диагностика заболевания проводится в основном с применением инструментальных методов:
- допплерография сосудов головного мозга с использованием ультразвука для выявления аномалий сосудов;
- электроэнцефалография (ЭЭГ) мозга, позволяющая исследовать активность мозговых полушарий;
- КТ сосудов мозга спирального типа;
- МРТ головы для определения степени поражения сосудов и белого мозгового вещества;
- рентгенография головы с введением контрастных веществ.
Для подтверждения этого диагноза также назначают обследования неврологического и психологического состояния пациента.
Физикальные исследования проводятся с целью выявления патологических процессов в сердечно-сосудистой системе.
Проводятся следующие процедуры:
- измерение пульсации сосудов конечностей и головы;
- давления в 4 точках верхних и нижних конечностей;
- ЭКГ и УЗИ сердца;
- аускультация сердца и аорты брюшной полости на предмет наличия аритмии и шумов;
- допплерограмма шейных сосудов для исключения стеноза сонной и головной артерий.
Общее описание
Вертебробазилярная недостаточность
— это состояние, при котором возникает уменьшение кровоснабжения в системе артерий: базилярной и позвоночных. В результате этого состояния нарушается питание и функции головного мозга, в итоге возникают необратимые морфологические изменения мозгового вещества.
По данным статистической литературы люди с вертебробазилярной недостаточностью чаще всего подвержены к возникновению инсультов около 25-30% и транзиторных нарушений мозгового кровообращения в 65-70%.
Лечение ЦВБ
Основная задача терапии — это регенерация и нормализация кровообращения мозга, направленная на расширение просвета сосудов.
Цереброваскулярная болезнь лечится комплексно, с применением различных методов терапии.
Медикаментозное лечение проводится по следующим направлениям:
- сосудорасширяющие препараты (Мефакор, Папаверин) и антикоагулянты (Апирин, Курантил, Кардиомагнил и др.);
- ноотропные средства для восстановления памяти и когнитивной деятельности мозга (Циннаризин, Стугерон, Ноотропил, Пирацетам, Кавинтон и др.)
- антигипертензивные средства;
- препараты для нормализации веса.
Хирургические операции:
- при непроходимости сосудов применяют ангиопластику — вводят катетер с баллоном;
- удаление тромбов (эндартерэктомия);
- ввод в стенки артерий стентов, предохраняющих от сужения (стенирование).
Физиотерапевтические процедуры:
- лечебная физкультура;
- массаж;
- электрофорез;
- ультразвук.
Немедицинское лечение — логопедические занятия, консультации психолога.
Определение нетрудоспособности больных дискуляторной энцефалопатией:
- На начальной стадии (1 степень) ЦБВ пациенты сохраняют трудоспособность.
- Средняя стадия (2 степень) подразумевает присвоение больным инвалидности II-III группы. Нетрудоспособность может быть временной из-за сопутствующих недугов или в период обострения хронической недостаточности циркуляции крови.
- Тяжелая стадия (3 степень) ХЦВП вызывает полную потерю трудоспособности. Больным присваивают инвалидность I-II группы.
Профилактика заболевания
С целью предупреждения развития ХЦВН предполагаются следующие мероприятия:
- диета с исключением из рациона продуктов, богатых холестерином, отказ от жирной, соленой, копченой пищи, увеличение потребления свежих фруктов и овощей, продуктов, богатых клетчаткой, сокращение сладкого и мучного;
- подвижный образ жизни — регулярные пешие прогулки, занятия спортом;
- контроль веса;
- отказ от вредных привычек (табакокурение, алкоголь);
- постоянный контроль уровня АД;
- спортсменам следует избегать чрезмерных физических нагрузок;
- людям старшего и пожилого возраста необходимо проходить ежегодный медицинский осмотр;
- лечение сопутствующих болезней (сахарный диабет, инфекции, патологии сердца, почек, печени и др.).
Своевременное выявление ЦВБ и правильно подобранная терапия позволят предупредить развитие хронической цереброваскулярной недостаточности, сохранить здоровье и избежать опасных последствий.