Данное исследование представляет собой выявление полиморфизмов в генах, связанных с наследственной тромбофилией и другими нарушениями системы свертывания крови. Тромбофилия – это повышенная склонность к случайному (без видимых причин) тромбозу глубоких вен и тромбоэмболическим осложнениям. Тромбоз может возникнуть при нарушениях кровообращения (застой крови), повышенной способности крови образовывать тромбы (гиперкоагуляции), повреждениях сосудистой стенки и при сочетании этих факторов. Гиперкоагуляция может быть обусловлена наличием генетической предрасположенности к тромбофилии (наиболее часто встречаются полиморфизмы в генах F2 и F5), которую позволяет выявить этот анализ.
В каких случаях обычно назначают исследование?
Анализ рекомендован следующим категориям пациентов:
- пациенты с семейной историей тромбофилии и других венозных осложнений
- пациенты с наличием в семейной истории сердечно- сосудистых событий (инфарктов и инсультов) у близких родственников в возрасте до 50 лет
- женщины, планирующие прием комбинированных
- пациенты с тромбозами любой локализации в возрасте до 50 лет, даже при наличии предрасполагающих факторов
- пациенты с тромбозами необычных мест (тромбоз мозговых синусов, мезентериальные, печеночные вены)
- пациенты с хроническими заболеваниями вен, в частности с тромбофлебитами
- женщины, планирующие прием комбинированных оральных контрацептивов
- женщины, планирующие гормональную заместительную терапию
- женщины с привычным невынашиванием беременности.
Генетические факторы
Тромбофилия, которая передается по наследству, — генетически обусловленная склонность к формированию тромбов. При сочетании двух и более нарушений в системе свертывания выраженные тромботические расстройства могут развиваться уже в раннем детстве. Однако чаще наследственное повышение свертываемости крови вызвано одним нарушением, которое выявляется случайно при лабораторном исследовании крови 2.
Выделяют два основных типа тромбофилий: гематогенные, связанные с изменениями свертывающей системы крови, и негематогенные. На сегодня известны как минимум 20 генетических факторов, связанных с развитием заболевания. Их разделяют на три группы2:
- Установленные:
- фактор V Лейден — мутация, при которой из-за замены аминокислот в белковой цепи V фактора свертывания он становится устойчивым к действию одного из основных противосвертывающих агентов, активированного протеина С.
Мутация G20210А протромбина II, при которой изменяется уровень фактора свертывания крови II протромбина.
- Дефицит протеина С, инактивирующего факторы свертывания крови Va и VIIIa. Встречается реже, чем две предыдущие мутации, обычно приводит к развитию семейного венозного тромбоза.
- Дефицит протеина S — кофактора протеина С, который усиливает его противосвертывающую и фибринолитическую активность.
- • Дефицит антитромбина, основного белкового фактора, который угнетает свертывание крови. Передается по аутосомно-доминантному типу, то есть проявляется только при наличии хотя бы одного дефектного гена.
- Неопределённые:
- Дисфибриногенемия — состояние, при котором содержание фибриногена соответствует норме, однако сама молекула фибриногена изменена. Чаще передается по аутосомному типу наследования, то есть для проявления заболевания дефектный ген должен передаться от обоих родителей. Обычно проявляется умеренными кровотечениями на фоне травмы или хирургического вмешательства.
Гипергомоцистеинемия. Может быть одновременно и наследственным, и приобретенным нарушением 2. Связана с редкими генетическими поломками, которые приводят к повышению концентрации гомоцистеина в моче, плазме крови. Гомоцистеин проявляет выраженный токсический эффект, повреждая внутреннюю поверхность сосудов, значительно увеличивая риск тромбозов.
- Редкие.
К редким факторам тромбофилии относятся повышение концентрации факторов свертывания крови VIII, IX, XI, VII, XII, дефицит плазминогена, активация тканевого плазминогена, повышение липопротеина А, полиморфизм гликопротеина тромбоцитов, дефект гена тромбомодулина, другие факторы.
Как проявляется тромбофилия?
Наличие тромбофилии можно заподозрить при следующих состояниях 2:
- Повторная венозная тромбоэмболия
- Венозный тромбоз в возрасте младше 40 лет
- Венозная тромбоэмболия у родственников
- Тромбоз необычной локализации, например, брыжеечной вены, почечной вены, печени, церебральный тромбоз.
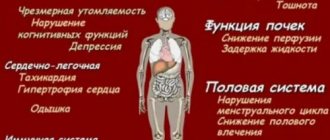
Необходимо отметить, что чаще всего тромбофилия приводит к тромбозу вен, однако недостаточность протеинов С, S и антитромбина могут проявляться также тромбозами в артериях. Последние становятся причиной инфаркта миокарда и острого нарушения мозгового кровообращения — инсульта.
Диагностика тромбофилии
Своевременная диагностика генетической (наследственной) тромбофилии играет важную роль в прогнозе заболевания. Раннее выявление заболевания позволяет внести необходимые коррективы в образ жизни и таким образом предупредить патологическое тромбообразование.
Поскольку передающаяся по наследству тромбофилия может быть связана с различными генетическими факторами, диагностика ее носит комплексный характер. Задача врача — подтвердить или опровергнуть наличие мутаций, связанных с нарушением свертывающей активности крови.
К числу анализов, которые придется сдать при подозрениях на наследственную тромбофилию, относятся3:
Развернутая коагулограмма с определением уровня факторов свертывания крови, физиологических антикоагулянтов.
Коагулограмма позволяет выявить отклонения в системе гемостаза и определить тип тромбофилии, недостаточность каких именно факторов свертываемости наблюдается.
- Определение уровня гомоцистеина, позволяющее диагностировать гипергомоцистеинемию.
- Определение содержания тромбомодулина, активности фактора Виллебранда, а также концентрации эндотелина-1, необходимые для получения информации о возможном поражении сосудов вследствие тромбофилии.
- Генетическое исследование полиморфизма генов тех факторов, которые участвуют в гемостазе.
Наследственная тромбофилия и беременность
Связь между передаваемыми по наследству тромбофилиями и осложнениями беременности, например, преэклампсией, эклампсией, самопроизвольным прерыванием беременности, задержкой развития плода, отслойкой плаценты до сих пор остается противоречивой4. И тем не менее, некоторые акушерские осложнения все же вызваны тромбофилиями.
Так, ряд исследований свидетельствует о возможной связи между потерей плода во втором и третьем триместрах беременности с наличием наследственной тромбофилии6. Это объясняется нарушением кровообращения в сосудах плаценты вследствие формирования в ней тромбов. Однако важно подчеркнуть, что самопроизвольные потери плода на ранних сроках беременности (в первом триместре) чаще не имеют отношения к тромбофилии.
Тем не менее, наличие тромбофилии, которая заложена генетически, у беременных женщин может повышать риск венозных тромбоэмболических осложнений5. Даже в норме, у здоровых женщин во время беременности свертывающая система крови активируется: наблюдается физиологическая гиперкоагуляция (повышение свертываемости крови), также имеется венозный застой. Однако, у беременных женщин, страдающих тромбофилией, коагуляция еще более увеличивается, что и может приводить к повышению риска тромбообразования, прежде всего в венозных сосудах7.
Формированию венозного застоя у будущих мам может способствовать и снижение физической активности, например, при некоторых осложнениях беременности, а также после кесарева сечения 7.
Диагностика тромбофилии при беременности затруднена, поскольку ряд показателей повышается как при патологии, так и у здоровых женщин, причем чем больше срок беременности, тем выше риск тромбоза. Чтобы поставить диагноз, прибегают к генетическому исследованию, которое обычно проводится по рекомендации лечащего врача при наличии определенных показаний, например, при наличии перенесенного венозного тромбоза нижних конечностей или наличии венозных тромбозов у близких родственников.
Что именно определяется в процессе анализа?
В данном исследовании выявляются полиморфизмы следующих генов:
- F2 — ген протромбина.
- F5 – ген фактора V свертывания крови.
- F7 – ген проконвертина.
- F13A1 – ген, кодирующий A-субъединицу XIII фактора свертывания.
- FGB – ген, кодирующий бета- субъединицу фибриногена.
- ITGA2 – ген, кодирующий тромбоцитарный гликопротеин Iа.
- ITGB3 – ген, кодирующий белок интегрин бета- 3, являющийся компонентом тромбоцитарного гликопротеина IIb/IIIа.
- SERPINE1 (PAI-I)– ген ингибитора активатора плазминогена 1 типа.
Исследование крови на наследственные дефекты гемостаза: полиморфизм генов системы гемостаза
* также встречаются названия: мутации системы гемостаза, наследственные тромбофилии, лейденская мутация, мутация PAI-I, мутация протромбина, мутация МТГФР, мутации свертывания крови, генетические тромбофилии
Исследования последних лет показали, что у пациенток с привычным невынашиванием беременности часто обнаруживают один или несколько генетических факторов тромбофилии. Тромбофилия — склонность к развитию тромбозов. Может быть наследственная и ненаследственная. Наличие тромбофилии сопряжено с повышенным риском развития осложнений беременности (привычное невынашивание, плацентарная недостаточность, задержка роста плода, поздний токсикоз (гестоз)).
Генетический анализ на тромбофилию
В нашей лаборатории исследование на полиморфизм генов системы гемостаза имеет два варианта:
Базовый блок состоит из 4 показателей
- Ген протромбина (F2): 20210 G>A
- Лейденская мутация (F5): 1691 G>A
- Ген метилентетрагидрофолатредуктазы MTHFR: 677 С>T
- Ген ингибитора активатора плазминогена (PAI-1): 675 5G>4G
Полиморфизм генов системы гемостаза и метаболизма фолатов, полное обследование, 12 показателей. Генетические полиморфизмы, ассоциированные с риском развития тромбофилии и нарушениями фолатного обмена.
- Ген протромбина (F2): 20210 G>A
- Лейденская мутация (F5): 1691 G>A
- Ген ингибитора активатора плазминогена (PAI-1): 675 5G>4G
- Ген фибриногена (FGB): -455 G>A
- Ген VII фактора (F7): 10976 G>A
- Ген фактора 13 (FХIII): G>T
- Ген интегрина альфа-2 (ITGA2): 807 С>T
- Ген тромбоцитарного гликопротеина Gp-IIIa (GPIIb/IIIa) ITGB3: 1565 T>C
- Ген MTR: 2756 A>G
- Ген MTRR: 66A>G
- Ген метилентетрагидрофолатредуктазы MTHFR: 677 С>T
- MTHFR: 1298 A>C
Какой анализ сдавать — 4 или 12 показателей?
Варианты генов системы гемостаза делятся на более частые и редкие. Традиционно считается, что более частые варианты генов, предрасполагающие к развитию тромбозов — это соответствующие полиморфизмы генов MTHFR (метилентетрагидрофолатредуктазы), протромбина, PAI-I, фактора V (лейденская мутация), входящие в блок «Полиморфизмы генов системы гемостаза, 4 фактора». Это обследование выявляет достаточно большой процент проблем. Но иногда за рамками этого стандартного обследования остаются скрытые факторы, которые могут осложнять течение беременности, прием контрацептивов, хирургические вмешательства, поэтому для получения большей информации о потенциальных рисках желательно сдавать анализ «Полиморфизмы генов системы гемостаза, 12 факторов».
Особенности молекулярно-генетических анализов
- Не требуют подготовки
- Сдаются один раз в жизни
Смотрите также:
- Полиморфизмы генов сосудистого тонуса
- Блоки обследования «Тромбофилические и аутоиммунные нарушения»
- Полиморфизм генов гемостаза и сосудистого тонуса, АФС
- Разница в полиморфизме матери и плода
- Генетическая склонность к тромбозу?
- Полиморфизм генов гемостаза, коагулограмма, снижение агрегации
Что означают результаты теста?
В качестве заключения выдается генетическая карта здоровья, составленная профессиональным врачом-генетиком нашей лаборатории. В ней представлены результаты анализа с расшифровкой, дано подробное описание исследуемых полиморфизмов и их влияния на риски развития нарушений системы свертывания крови, сердечно-сосудистых заболеваний и патологий беременности, советы по проведению дополнительных исследований и подробные клинические рекомендации для лечащего врача.
Результаты анализа интерпретируются лечащим врачом. Опираясь на них, врач может скорректировать питание и образ жизни пациента, назначить лекарственные препараты и дополнительные исследования.
Основные последствия тромбофилии
Последствия такого наследственного заболевания могут проявляться даже в раннем возрасте. Чаще всего наблюдаются следующие симптомы:
- Нарушение мозгового кровообращения – происходит, если питание перестало поступать по одной из артерий, кровоснабжающих центральную нервную систему.
- Инфаркт миокарда – при закупорке коронарного или мезентериального сосуда.
- Тромбоз вен нижних конечностей или печени.
Диагностика и лечение
Определить риск развития тромбофилии помогает специализированный анализ крови. Он представляет собой исследование генов и особенностей свертываемости крови, а также сопутствующих факторов, которую напрямую влияют на предрасположенность к тромбообразованию. Например, к ним относится обмен фолиевой кислоты, фибринолиз и т.д.
Для диагностики пациенту потребуется сдать венозную кровь. Какая-либо специальная подготовка не потребуется. Назначается анализ при наличии следующих симптомов:
- Тромбоэмболия в семейном анамнезе.
- Тромбоз в анамнезе.
- Отягощенный семейный тромботический анамнез (наличие родственников, перенесших тромбоз, инфаркт, инсульт, ТЭЛА, невынашивания, гестозы).
- Гормональная терапия у женщин.
- Планирование беременности.
- Планирование ЭКО.
- Планирование операции.
- Наличие факторов риска тромбоза (ожирение, курение, частые авиаперелеты, занятия спортом).
- Сердечно-сосудистые заболевания в семейном анамнезе.
- Невынашивание беременности.
По результатам тестирования выдается заключение врача-генетика. Исследуется 10 значимых генетических маркеров, на основании полученных данных оценивается риск развития патологии или вероятность других осложнений, напрямую связанных с нарушением гемостаза.
Далее специалист назначает необходимую терапию и ряд профилактических мер, способных уменьшить риск образования тромбов. Обязательным является изменение образа жизни пациентам, в том числе отказ от вредных привычек, нормализация веса и пересмотр питания.
Тромбофилический синдром и беременность
Особенно опасными изменения в системе свертывания крови являются в период вынашивания ребенка. И именно во время беременности чаще всего выявляется наследственный характер патологии.
Заболевание может привести к спонтанным выкидышам и другим неблагоприятным исходам, поэтому беременным женщинам, особенно с невынашиванием, в обязательном порядке назначают генетический анализ на риск подобной патологии.
ДНК тест на предрасположенность к тромбофилии
Наличие мутаций в генах, отвечающих за работу системы свертываемости крови существенно повышает риск возникновения тромбофилии.
Помимо этого, данная генетическая предрасположенность в сочетании с недостаток витаминов группы B и фолиевой кислоты может привести к развитию гипергомоцистеинемии. Эта патология характеризуется повышенным уровнем гомоцистеина в крови. Повышенная концентрация гомоцистеина пагубно влияет на внутренние стенки артерий. В результате могут образовываться тромбы и развиваться атеросклероз. Особую опасность гипергомоцистеинемия представляет для беременных. Болезнь может вызвать нарушения кровообращения в плаценте.
В панель днк анализа включены четыре гена, оказывающие решающее воздействие на систему свертываемости крови.
- Ген F2 — кодирует белок протромбин или коагуляционный фактор II. Этот белок является важной частью процесса свертывания крови. Мутации в F2 могут привести к увеличению экспрессии гена и как следствие к повышению концентрации протромбина в крови. Это приводит к увеличению рисков развития сердечно-сосудистых заболеваний в несколько раз. Например, вероятность инфаркта миокарда повышается в 4 раза.
Особую опасность представляет для беременных. У женщин с патологической формой гена F2 увеличивается риск тромбозов вен и артерий, выкидыша или задержки развития плода.
Наследуется по аутосомно-доминантному механизму. Если хотя бы один из родителей передаст ребенку мутантный ген, его свойства проявятся.
- Ген F5 — кодирует белок проакцелерин (коагуляционный фактор V или фактор Лейден). Играет важную роль в процессах свертывания крови. МУтации в гене F5 приводят гиперкоагуляции, снижению восприимчивости к антикоагулянтному эффекту протеина С. Это повышает риски тромбозов и тромбоэмболических заболеваний. При беременности повышается вероятность замершей беременности и выкидыша.
Мутантный ген передается по аутосомно-доминантному механизму наследования.
- Ген MTHFR — кодирует фермент метилентетрагидрофолатредуктазу. Этот фермент участвует в процессах метаболизма фолиевой кислоты. Мутации в гене MTHFR приводят к резкому повышению рисков венозных и артериальных тромбозов.
Снижение метаболизма фолиевой кислоты во время беременности может привести к серьезным патологиям центральной нервной системы у плода. Вплоть до не заращения невральной трубки.
- Ген CRP — кодирует C-реактивный белок, отвечающий за защитные свойства крови в острых фазах воспаления. Концентрация СРБ увеличивается в ответ на повреждения, инфекции и другие воспалительные процессы. Мутации в ген CRP приводят к высоким концентрациям C-реактивного белка в крови в отсутствии воспалений. В результате чего риск развития сердечно-сосудистых заболеваний увеличивается в 4-7 раз. В том числе и тромбозов.
Тяжесть патологии зависит от количества обнаруженных Генетических маркеров наследственной тромбофилии. Если анализ оказался положительным, необходимо проконсультироваться с врачом-генетиком.
Кардиогенетика риск развития тромбофилии (в сыворотке крови)
Тромбофилия – нарушения свертывающей системы крови, которые характеризуются повышением риска развития тромбоза. Тромбофилии обычно связаны с генетическими дефектами. Сдать анализ на риск развития тромбофилии следует для выявления полиморфизма генов факторов свертываемости крови и компонентов гемостаза, приводящих к нарушению функции системы гемостаза. Часто встречается дефицит антитротромбина III, протеинов C и S, аномалия фактора V (мутация Лейден), аномалия протромбина G 202110А и другие. Развитие тромбофилии также может быть связано с участием генов, осуществляющих контроль за метаболизмом фолиевой кислоты. Нарушение метаболизма фолиевой кислоты приводит к гипергомоцистеинемии, быстрому прогрессированию атеросклероза и возможным тромботическим осложнениям.
Полиморфизмы генов, которые ассоциированы с развитием тромбофилий:
- F5 1691 G>A (Arg506Gln) (Лейденская мутация). При данной мутации существует устойчивость пятого фактора к протеину C, что повышает скорость образования тромбина и усиливает процессы свертывания крови.
- F2 20210 G>A (мутация в гене протромбина). Синтез данного фактора увеличивается, при этом повышается риск тромбообразования. Характеризуется неблагоприятным течением беременности, задержкой роста плода, привычным невынашиванием берменности.
- F7 10976 G>A (Arg353Gln). Характеризуется снижением экспрессии гена фактора свертываемости 7. При мутации данного фактора увеличивается риск развития инфаркта миокарда и тромбозов.
- PAI – 1 -675 5G>4G (Мутация в гене, кодирующем ингибитор активатора плазминогена)
- FGB (ген, кодирующий одну из цепей белка фибриногена). Характеризуется гиперфибриногенемией, высоким риском развития тромбофилии.
- ITGB3 1565 T>C (Leu33Pro). Белок обеспечивает связь между молекулой фибриногена и тромбоцитами. При данной мутации существует повышенная склонность тромбоцитов к агрегации, увеличивается риск развития сердечно-сосудистой патологии, снижением ээфективности применения тромболизиса и аспирина.
- ITGA2: 807 C>T (Phe224 Phe). Мутация характеризуется изменением свойств тромбоцитарных рецепторов, при этом ускоряется склеивание тромбоцитов.
- При мутации этого гена нарушается обмен фолиевой кислоты, что может привести к риску развития гипергомоцистеинемии.
Анализ на тромбофилию позволяет выявить генетическую предрасположенность и осуществить профилактику развития патологии сердечно-сосудистой системы, акушерских осложнений, тромбозов и тромбоэмболий. Скрининг, включающий в себя анализ на риск тромбофилии помогает в выявлении группы риска на ранних этапах развития патологии и позволяет корректировать тактику ведения больных.
Румянцева, md
Aнализы на генетические полиморфизмы при выкидышах и замерших беременностях в первом триместре
Поскольку 80%[1] потерь приходятся на первые три месяца беременности, только этих ситуаций мы коснемся в статье. Причины потери беременности после 12 недель – предмет отдельного обсуждения.
Непросто поверить, но риск спонтанного прерывания беременности на сроке 6-12 недель у здоровой женщины моложе 35 лет составляет не менее 10%[2], и повлиять на причины этих событий можно в меньшинстве случаев.
Итак, женщина понимает: ребенка не будет. Одно из первых желаний в такие моменты – узнать причину. И находятся желающие эту потребность удовлетворить: ошарашенной женщине назначают многочисленные обследования и анализы, и редко обходится без тестов на:
- «генетические причины потери беременности»
- «полиморфизмы в генах гемостаза и фолатного цикла»
- «мутации предрасположенности к невынашиванию беременности»
- «генетический риск осложнений беременности»
- …
Вариантов названий у этой услуги множество. Суть одна: по материалу матери определяют ее генотип по полиморфизмам нескольких генов.
Когда женщине назначают «генетические анализы» по поводу потери беременности — это в 99% случаев именно анализы на полиморфизмы. Поэтому (с определенным допущением) можно сказать, что анализы на полиморфизмы = генетические анализы, которые назначаются женщинам по поводу потери беременности.
| Непросто в двух словах рассказать, что такое полиморфизмы. Полиморфизмы – это незначительные различия в структуре генов, определяющие разнообразие их проявлений. Каждый конкретный полиморфизм «живёт» в определенном гене, немножко изменяя свойства его продукта и, тем самым, проявление какого-то признака. Полиморфизмы – это то, что делает нас разными. Это генетические оттенки, из-за которых один может за милую душу выпить литр молока, а другой после пары глотков будет искать туалет. Благодаря полиморфизмам у нас столько цветов глаз и волос. Из-за них у кого-то кровь сворачивается чуть быстрее среднего, а у кого-то – чуть медленнее. Удивительно, но весь этот спектр форм, цветов и особенностей задается комбинациями четырех букв-нуклеотидов, составляющих наши гены: A, G, T и C. Одну букву мы получаем от мамы, другую – от папы. Так получается наш собственный генотип: например GG, GA или TC. Результатом анализа на полиморфизмы как раз и будут пары букв. Например, в гене фактора свертывания крови V (этот ген называется F5) буквой под номером 1691 может быть G, а может – А. Отсюда три варианта генотипов: GG, GA и AA. Вариант GG — удел большинства людей, ему не свойственны какие-то особенности. Около 2-7% людей имеют генотип GА, то есть несут полиморфизм А (так называемую Лейденскую мутацию), из-за чего склонны к повышенной свертываемости крови. Людей с генотипом АА крайне мало. Грань между понятием «мутация» и «полиморфизм» тонка и неопределенна. Ученые-биологи любое отклонение от «эталона» могут называть мутацией, а врачи-практики обычно считают мутацией только то изменение, которое может приводить к болезни. Поэтому не смущайтесь, что полиморфизм в гене F5 называют Лейденской мутацией. |
Какие полиморфизмы обычно обсуждаются в контексте потери беременности?
Назовём героев этой статьи поимённо!
Не пугайтесь того, что эти названия вам ни о чем не говорят, и пока что поверьте: они и врачу вашему в большинстве случаев ничего не скажут.
- F5: 1691 G>A (Arg506Gln)NB!
- F2: 20210 G>A NB!
- F7: 10976 G>A (Arg353Gln)
- F13: G>T (Val34Leu)
- FGB: -455 G>A
- ITGA2: 807 C>T (Phe224Phe)
- ITGB3: 1565 T>C (Leu33Pro)
- SERPINE1 (PAI-1): -675 5G>4G
- MTHFR: 677 C>T (Ala222Val)
- MTHFR: 1298 A>C (Glu429Ala)
- MTR: 2756 A>G (Asp919Gly)
- MTRR: 66 A>G (lle22Met)
NB! Обратите внимание, что эти два полиморфизма могут играть важную роль в принятии решения о назначении КОК (комбинированных оральных контрацептивов).
Почему врачи назначают анализы на эти полиморфизмы?
Когда ученые узнали о существовании полиморфизмов, они задумались: а нельзя ли использовать это знание для выделения группы людей с предрасположенностью к определенным заболеваниям, и заблаговременно их предупреждать? Известно же: предупредить легче, чем лечить!
Эти времена совпали с подъемом молекулярных технологий, позволивших выполнять тесты на полиморфизмы относительно просто и недорого. Исследователи смекнули, что работы типа «Влияние полиморфизма Х на болезнь Y» генерировать легко и делать это можно практически бесконечно. Поскольку болезней и полиморфизмов много, всегда была возможность подобрать пару «полиморфизм – болезнь», позволявшую даже из безнадежных данных вытащить мало-мальски значимую связь и опубликоваться, кокетливо умолчав об изъянах дизайна исследования. Соедините немного логики и статистики – и получите скромное, но научное достижение.
Вот как рассуждали эти исследователи: уже упоминавшаяся Лейденская мутация связана с повышенной свертываемостью крови. Известно, что формирование и функционирование плаценты сильно зависит от агрегатных свойств крови, а при невынашивании беременности в плацентах нередко находят очаги тромбоза. Логично предположить, что у носительниц Лейденской мутации эти нарушения могут встречаться чаще. Осталось провести исследование и проверить эту гипотезу. Такие исследования были проведены и некоторые показали наличие связи между наличием Лейденской мутации и повышенным риском потери беременности.
Так появилась богатая (на немалую долю отечественная) «литературная база», указывающая на связь между полиморфизмами и предрасположенностью к разным болезням.
Именно на эту «базу» опирались производители реагентов при убеждении врачей в целесообразности назначения тестов на полиморфизмы. Да-да, на определенном этапе потребность в диагностикумах для анализов на полиморфизмы стала так велика, что привлекла производителей реагентов, которые создали коммерческие наборы для выполнения этих тестов. А товар требует продвижения. Как можно расширить рынок таких наборов? Внедрить тесты на полиморфизмы в клиническую практику! И эти анализы из научных лабораторий стали «заползать» в диагностические.
Когда результаты научных исследований переносятся в клиническую практику без должной оценки последствий, страдают кошельки и нервы пациентов.
Так появились лаборатории, предлагающие тесты на полиморфизмы как медицинские диагностические услуги. Так появились врачи, наученные лабораториями и производителями реагентов, что эти тесты нужно назначать в различных случаях, в том числе при невынашивании беременности. Так сформировалась целая мифология про то, какие полиморфизмы надо выявлять и как их «лечить».
Но достаточно мифов. Дальше — только факты:
Полиморфизмы не являются значимой причиной ранней потери беременности
Около 70% беременностей, прервавшихся в первом триместре, не могли развиваться из-за генетических аномалий ЭМБРИОНА (не матери!!!)[3]. Не путайте с генетическими полиморфизмами!
Полиморфизмы – это генетические особенности мамы, а приводящие к выкидышу нарушения структуры и количества хромосом – это грубые аномалии эмбриона. Возникновение таких эмбрионов – часть жизни, так же, как и их ранняя отбраковка.
Оставшиеся 30% ранних потерь беременности тоже не имеют отношения к полиморфизмам, а обусловлены антифосфолипидным синдромом, неправильным функционированием шейки матки, инфекциями и другими причинами, к которым генетические полиморфизмы матери не относятся.
Какие-то полиморфизмы есть у всех людей
В отличие от мутаций, вызывающих редкие генетические болезни, которые встречаются у одного из десятков тысяч людей, какие-то полиморфизмы есть у всех. Каждый день мимо вас проходят люди с такими же GG, GA и TC, как у вас. Возможно, у них есть дети, но может быть и нет. Есть вероятность, что они сталкивались с потерей беременности, а может быть их это несчастье обошло стороной. В любом случае: от вас они отличаются тем, что не тратили деньги на анализ полиморфизмов.
Полиморфизмы не определяют признак полностью (или на большую часть)
Вернемся к несчастным больным генетическими заболеваниями: их редкий генетический дефект практически на 100% определяет их беду. То, что генетики называют «факторами среды» (поведение, питание, физическая активность) вносит очень маленький вклад в их несчастье. С полиморфизмами наоборот: их вклад очень мал.
Например, вероятность развития венозного тромбоза хоть в некоторой степени и зависит от наличия, например, уже знакомой нам Лейденской мутации, но на львиную долю определяется весом, статусом курения, возрастом, наличием беременности, принимаемыми препаратами и другими факторами.
Полиморфизм – не болезнь
Какими бы жуткими словами не сопровождались комбинации из букв A, G, T и C в заключении генетического анализа, они НЕ говорят о том, что у женщины будет, например, «невынашивание беременности».
Пример из жизни:
Когда на бланке результата «Нарушение развития плода – незаращение нервной трубки» написано рядом с «MTRR c.66A>G G/G» любой человек поймёт такую запись как причинно-следственную связь. А это не так. Наличие полиморфизмов говорит лишь о том, что вы принадлежите к людям, у которых по данным некоторых(!) научных(!!!) исследований эти патологии возникают чаще, чем у людей без ваших полиморфизмов. И тут мы переходим к следующему факту…
Влияние полиморфизмов «видно» только на больших группах людей
Даже будучи специалистом, я не пойму ваш генотип по генам свертывания крови, увидев вашу коагулограмму (анализ на свертываемость крови). А всё потому, что эти различия не «видны» на индивидуальном уровне. У человека с «плохими» полиморфизмами свертывание может быть «лучше», чем у «генетически идеального». Лишь среднее значение этого показателя, измеренное в большой группе людей с «плохим» генотипом, будет отличаться от такового у группы с «хорошим».
| Немного математики: Иногда в заключении анализа рядом с жуткими «диагнозами» можно увидеть цифры. Например, «Выявленный полиморфизм в 3,5…5,5 раз увеличивает риск венозной тромбоэмболии». Эти цифры – совершенно честные[4] для Лейденской мутации. Этот полиморфизм – один из двух достойных хоть какого-то внимания полиморфизмов системы свертывания крови. Второй – так называемый «полиморфизм протромбина», c.20210G>A в гене фактора свертывания крови II (F2). Но вернемся к цифрам. Увеличение в 3,5…5,5 раз – это существенно? Конечно существенно! Если мне завтра в три с половиной раза увеличат зарплату, это будет ой как существенно… А если посмотреть не относительный, а абсолютный риск? Когда у вас есть Лейденская мутация, ваш ежегодный риск получить венозную тромбоэмболию равен 0,05…0,2%. Иными словами:
Абсолютный риск ВТЭ настолько мал, что даже увеличение в разы не делает его существенным для жизни отдельного конкретного человека. Беременность в совокупности с Лейденской мутацией повышает риск ВТЭ, но шанс на то, что тромбоза НЕ будет, всё равно не опускается ниже 95%. |
И теперь пара слов о лечении:
«Вылечить» полиморфизмы нельзя.
Это часть генотипа, и он останется неизменным до конца жизни. Поэтому тактика «сдать на полиморфизмы – полечить – сдать контрольный анализ» абсурдна по своей сути.
Ни один из полиморфизмов не является прямым поводом для назначения лечения.
Справедливости ради, стоит отметить, что при невынашивании беременности антикоагулянтная терапия может потребоваться, и она дает неплохие результаты. Но для назначения антикоагулянтов должен быть установлен диагноз «антифосфолипидный синдром» (который может сочетаться или не сочетаться с полиморфизмами в генах системы свертывания).
Курантил, актовегин, тромбоасс, пиявки не нужны.
Они не имеют доказанной эффективности в улучшении исходов беременности у женщин с полиморфизмами в системе свертывания.
Тестирование женщин даже с неоднократной потерей беременности на наследственные тромбофилии[5] и полиморфизмы фолатного цикла[6] не входит в рекомендации ведущих медицинских организаций, занимающихся этой проблемой. Но в большинстве отечественных «методичек» и рекомендаций по невынашиванию беременности эти исследования входят.
И чтобы не оставлять неопределенности:
Анализы на генетические полиморфизмы женщинам, столкнувшимся с потерей беременности один или несколько раз, делать не нужно
Источники:
[1]https://www.acog.org/Resources-And-Publications/Practice-Bulletins/Committee-on-Practice-Bulletins-Gynecology/Early-Pregnancy-Loss
[2] https://www.webmd.com/baby/guide/pregnancy-miscarriage#1
[3] https://emedicine.medscape.com/article/260495-overview#a11
[4] Scott M. Stevens et al. Guidance for the evaluation and treatment of hereditary and acquired thrombophilia. J Thromb Thrombolysis (2016) 41:154–164
[5] Evaluation and treatment of recurrent pregnancy loss: a committee opinion
[6] Thrombophilias and recurrent pregnancy loss: a critical appraisal of the literature
Автор: Карпачева Клавдия, молекулярный генетик