Общие сведения
Отек мозга является одним из проявлений различных критических состояний и достаточно часто встречается в клинической практике при различного рода заболеваниях и развитии патологий. Различают отек головного, спинного и костного мозга.
Отек головного мозга
Отек головного мозга представляет собой увеличение его объема, обусловленное процессом накопления жидкости в межклеточном пространстве (интерстиции) и сопровождающееся увеличением объема мозговой ткани. В то время как увеличение объема мозга за счет интрацеллюлярной жидкости определяется термином «набухание» головного мозга. Однако, эти процессы (отек/набухание) могут развиваться одновременно и переходить взаимно друг в друга, поэтому оба эти понятия допустимо определять как отек мозга. Код отека головного мозга по МКБ-10: G93.6
Отечный синдром развивается как неспецифическая реакция организма на воздействие множества патогенных факторов. Возможна при целом ряде заболеваний/патологических состояний, протекающих с поражением нервной системы — черепно-мозговая травма, острое нарушение мозгового кровообращения, инфекционные заболевания, гипоксии, интоксикации, опухоли головного мозга (перифокальный отек), острые соматические заболевания, сопровождающиеся нарушением водно-солевого баланса/гемодинамики, при эндокринных нарушениях, болезнях крови, после оперативных вмешательств, воздействии ионизирующего излучения и др. Отек мозга часто является одним из проявлений критических состояний и непосредственной причиной смерти пациента.
Как правило отек головного мозга на ранней стадии (при своевременной медицинской коррекции) процесс обратимый, в то время как при неадекватном/поздно начатом лечении патологические процессы нарастают и часто заканчивается перерождением нервных клеток мозга с нарушением их функции и в целом, функциональной несостоятельностью мозговых структур.
Вследствие накопления в интерстиции мозга жидкости происходит увеличение объема мозга в условиях ограниченного внутричерепного пространства с развитием масс-эффекта (патологическое воздействие увеличивающейся тканью на соседние структуры, вызывая компрессию, деформацию, смещение, ателектаз), что в в первую очередь проявляется развитием внутричерепной гипертензии (ВЧД) с подрессированным нарастанием ишемии мозга, а в тяжелых случаях — со смещением мозговых структур и ущемлением в наметах мозжечка стволовых отделов, сопровождающиеся расстройством функции жизненно важных центров.
Отек спинного мозга
Наиболее часто отек спинного мозга позвоночника развивается при травматических повреждениях позвоночника. Патологические нарушения формируются как в результате травматического повреждения, так и сдавления структур спинного мозга вследствие его отека-набухания, что сопровождается ишемией вещества мозга, воспалительными изменениями и высоким риском развития необратимых нарушений функции/структуры спинного мозга. Сдавление спинного мозга вызывает образование первичных/вторичных очагов размягчения в спинном мозге и сопровождается неврологической симптоматикой. Клинические проявления определяются уровнем локализации отека, его выраженностью и длительностью. При выраженных отеках проявляется синдромом частичного/полного нарушения проводимости спинного мозга.
Отек костного мозга (трабекулярный отек костного мозга)
Выделяют субхондральные и трабекулярные отеки костного мозга. Трабекулярный отек — что это такое? Губчатое вещество (син. трабекулярная ткань) кости состоит из рыхлых перегородок/пластинок, промежутки между которыми заполнены костным мозгом, обеспечивающего кроветворение в организме человека и формирование иммунных цепочек. Отек губчатой ткани проявляется скоплением экссудата (интерстициальной жидкости) в трабекулярных пластинах. При этом, уровень жидкости увеличивается с 10 до 20% и более. В большинстве случаев диагноз ставится с запозданием, поскольку специфические симптомы отсутствуют и заболевание выявляется лишь на МРТ.
По литературным данным отек костного мозга встречается чаще у пациентов среднего возраста и при этом поражаются преимущественно крупные суставы, мыщелки большеберцовой/бедренной кости. Наиболее часто встречается (трабеккулярный отек латерального мышелка бедренной кости, отек костного мозга тазобедренных суставов, отек костного мозга в диафизе лучевой кости, отек мышелка бедренной кости и др.). Значительно реже встречается отек костного мозга позвоночника.
Причины отека костного мозга чрезвычайно разнообразны (ушибы/переломы кости, дефицит витамина D, ревматоидный артрит, остеоартроз, добро/злокачественные опухоли, остеомиелит, спондилит, деформирующий артроз, эндокринные патологии, сопровождающиеся нарушением клеточного метаболизма, эпилептический статус, острые нейроинфекции и др.). Механизмы развития отека костного мозга слабо изучены. Предполагается, что его развитию способствуют микрососудистая травма, аномальные механические нагрузки на кости/суставы, метаболические расстройства, венозная обструкция. В силу небольшого объема статьи буде рассматриваться лишь отек головного мозга.
Цитотоксический отек тканей мозга
Отек головного мозга вызван различными патологическими состояниями. Цитотоксический отек обусловлен двумя отдельными патогенетическими процессами с различными молекулярными и физиологическими механизмами: связанными с цитотоксическим (клеточным) отеком нейронов и астроцитов и связанными с транскапиллярным потоком Na + и других ионов, воды и макромолекул сыворотки крови. По большому счету , цитотоксический отек возникает из-за неконтролируемого или точнее нескомпенсированного притока катионов, главным образом Na +, через катионные каналы.
Цитотоксический отек может быть результатом почти любого поражения мозга, включая травму ( травма головного мозга ежегодно фиксируется у 1,4 миллиона человек в США , что приводит к 50 000 смертей и 235 000 госпитализаций) , инфаркт, инсульт ( В США инсульт является третьей по распространенности причиной смерти, причем ежегодно отмечается более 730 000 случаев заболевания.) новообразование, абсцесс или такие состояния, как гипоксия или токсическое воздействие или метаболическое нарушение. Цитотоксический отек определяется как клеточный процесс, иначе известный как клеточный отек, при котором внеклеточные Na + и другие катионы входят в нейроны и астроциты и накапливаются внутриклеточно, частично из-за отказа энергетически зависимых механизмов экструзии. Неконтролируемый приток катионов происходит в основном через катионные каналы. Приток катионов, в свою очередь, приводит к притоку анионов, который поддерживает электрическую нейтральность, и в совокупности эти явления приводят к притоку воды, что приводит к осмотическому расширению клетки, то есть цитотоксическому отеку. Цитотоксический отек сам по себе не приводит к отеку мозга, но образование цитотоксического отека истощает внеклеточное пространство Na + , Cl -, и воды, тем самым создавая новый градиент для этих молекул через капилляр гематоэнцефалического барьера. При соответствующих изменениях проницаемости капилляров новый градиент, созданный цитотоксическим отеком, приводит к замедлению транскапиллярного образования ионного отека. Таким образом, цитотоксический отек имеет важное значение сам по себе, поскольку он сигнализирует о преморбидном клеточном процессе, который почти неизбежно приводит к гибели онкотических или некротических клеток, но тем не менее важно, цитотоксический отек обеспечивает своего рода «движущую силу» для образования ионного отека, представляющего собой процесс, который вводит новую массу (Na + , Cl — , H 2 O), в конечном итоге отвечающую за набухание мозга.
Когда поражение мозга приводит к ишемии или гипоксии, очень мало продуцируется новых АТФ вслдествие отмены окислительного фосфорилирования. Клетки быстро используют свои запасы АТФ, и, если нормоксия не будет восстановлена, нарушенное клеточное оборудование теряет способность поддерживать гомеостаз. Первичный активный транспорт, в основном АТФ-зависимая Na + / K + АТФаза требует непрерывных расходов АТФ, которая необходима для поддержания гомеостаза. По сути баланс между выживаемостью и смертью клетки определяется борьбой между активностью электро насоса и каналами, которые позволяют Na + проникать в клетки.
Выживаемость клеток требует, чтобы Na + непрерывно экструдировали из внутриклеточного пространства, поскольку оно имеет решающее значение для поддержания нормального объема клеток. Истощение АТФ сопровождается неконтролируемым притоком внеклеточных ионов, в основном Na + , внутрь по их электрохимическим градиентам. Приток ионов натрия в свою очередь приводит к притоку Cl — через хлоридные каналы, и, как следствие, увеличение внутриклеточной осмолярности приводит к притоку воды через каналы AQP .
Внеклеточная вода проникает внутрь клетки, что приводит к увеличению объема внутриклеточной жидкости за счет внеклеточного пространства. Морфологически этот процесс приводит к изменениям в поверхностной архитектуре мембраны с заметным образованием в ней пузырьков. На начальных стадиях цитотоксического отека гематоэнцефалический барьер является неповрежденным и в значительной степени непроницаемым для ионов и жидкостей, поэтому внеклеточные ионы и потери воды не пополняются. Таким образом, движение жидкости, связанное с образованием цитотоксического отека, не приводит к изменению общего объема мозга, несмотря на наблюдаемое увеличение размера клеток.
Клетки в сером и белом веществе подвержены воздействию цитотоксического отека. Клеточный отек начинается в течение 30 минут после окклюзии MCA, особенно вокруг капилляров и сохраняется до 24 часов после реперфузии и приводит к среднему уменьшению внеклеточного пространства от нормальных 20% до 4-10%. Астроцитарный отек гораздо более заметен, чем отек нейронов. Астроциты более склонны к патологическому отеку, чем нейроны, потому что они участвуют в выведении К + и глутамата, которые вызывают осмотическую перегрузку, что, в свою очередь, способствует притоку воды. Астроцитарная, но не нейронная NKCC активируется повышенным внеклеточным K +и приводит к набуханию клеток. Важное значение имеет здесь также экспрессия высокого уровня водного канала AQP4.
Когда компенсаторные механизмы, такие как ионные насосы в плазматической мембране, плохо выполняют свою работу или вообще не работают, отекшая клетка погибает. Этот путь к гибели клеток был назван онкозом ( от греческого слова «онкос», что означает набухание) von Recklinghausen, в частности, для описания клеточной смерти при отеке. Этот термин является более конкретным способом классификации клеточной гибели, чем менее точные термины «случайная гибель клеток» или «некроз». Гибель отченых клеток также отличается от их апоптотической гибели. На электронно-микроскопическом уровне различие между двумя путями, ведущими к гибели клеток, становится очевидным: онкоз приводит к характерной форме клеток, которые показывают заметное увеличение объема и представляет собой мембранное повреждение плазмоламмы и других мембрани органелл, а также потерю мембранных фосфолипидов и исчезновение пятнистых ядер на поздней стадии, напротив, апоптоз представляет собой инволюцию клеток и их сморщивание.
Экспериментальные данные показывают четко очерченную последовательность метаболических реакций ткани головного мозга на снижение кровотока. Область мозга, в которой кровоток отсутствует или измеряется менее 10 мл / 100 г (мозговая ткань) / мин, быстро и необратимо повреждается менее чем за 6 минут, образуя «ишемическое ядро». Эта инфарктная ткань окружена » полутенью» гипоксической, но живой ткани с кровотоком более 20 мл / 100 г (ткань головного мозга) / мин. Клетки в полутени подвергаются цитотоксическому отеку и другим изменениям, которые потенциально обратимы, если перфузия восстанавливается в течение первых нескольких часов после травмы мозга. Однако, если гипоксические условия сохраняются, в конце концов умирают клетки с цитотоксическим отеком, расширяя масштаб клеточной смерти глубже в паренхиму, чем первоначально вовлеченное ядро. Таким образом, полутень является основной терапевтической мишенью для профилактики ишемического инсульта и травмы.
Ряд исследований показал, что фармакологическое ингибирование ионных каналов, включая неселективные катионные каналы, уменьшает очаговое ишемическое повреждение в моделях ишемического инсульта. Неселективные катионные каналы отличаются от селективных катионных каналов их проницаемостью; ионные селективные каналы обычно проницаемы для одного катиона, такого как Na + , K + или Ca 2+ , тогда как неселективный катионный канал может пропускать поток любого одновалентного катиона или даже смесь одновалентных и двухвалентных катионов. Вероятно, эти каналы играют важную роль во вторичной травме в зоне «полутени».
Кислотно-чувствительные ионные каналы ( ASIC) являются членами недавно обнаруженного семейства ионных каналов эпителиального натриевого канала / дегенерина. Кислотно-чувствительные гены ионного канала кодируют протонированные катионные каналы как в центральной, так и в периферической нервной системе. К настоящему времени клонированы шесть различных субъединиц ASIC, которые кодируются четырьмя генами ASIC1-ASIC. Кислотно-чувствительные ионные каналы представляют собой катионные каналы с водородным ионами, которые активируются при понижении рН, но обычно неактивны при физиологическом рН . Все ASIC проницаемы для Na + и, в меньшей степени, для Ca 2+ и блокируются амилоридом. Активация этих каналов приводит к увеличению возбудимости клеток.
Каналы ASIC ASIC1a и ASIC2a привлекли научное внимание в контексте нейропротекции. Ишемия и гипоксия приводят к заметному снижению рН ткани из-за неконтролируемой генерации молочной кислоты, а ацидоз является важной детерминантой неврологического повреждения. Субъединица ASIC1a может быть ответственна за опосредованную ацидозом, нейрональную травму, не зависящую от глутамата. Вероятность открытия ASIC1a возрастает с уменьшением рН ниже 7,0, а активация составляет половину максимума при рН 6,2, находящейся в диапазоне рН, который, как полагают, имеет место в «полутени» и сердцевине инфаркта, особенно в контекст гипергликемии. Активация ASIC1a способствует растяжению мембраны, высвобождению арахидоновой кислоты, получению лактата, состояний, которые наблюдаются в пределах инфаркта в виде набухающих клеток, Ca 2+ -зависимый фосфолипазы активируются, и происходит приток Ca 2+
Активация ASIC1a in vitro приводит к увеличению внутриклеточного Ca 2+ и индуцирует зависяще от времени повреждение нейронов, которое возникает в присутствии блокаторов каналов Ca 2+ с напряжением и глутаматных рецепторов. В моделях ишемического инсульта грызунов in vivo интра церебро — вентрикулярное введение блокаторов ASIC1a амилорида и тарантула (псальмотоксин 1) до начала ишемии, а также «выбивание гена» ASIC1a предотвращает ишемическое поражение. Канал ASIC2a вызвал особый интерес, поскольку временная глобальная ишемия вызывает его экспрессию в мозге крысы, в том числе в нейронах гиппокампа и коры.
Канал NC Ca-ATP представляет собой обнаруженный канал катионов, который проводит все неорганические одновалентные катионы, но являеся непроницаемым для Ca 2+ и Mg 2+
Открытие этого канала требует наномолярного Ca 2+ на стороне цитоплазмы. Физиологические уровни АТФ внутриклеточно блокируют открытие канала NC Ca-ATP , тогда как истощение ATP вызывает открытие канала. Предполагается, что канал NC Ca-ATP состоит из порообразующих и регуляторных субъединиц. Регуляторная субъединица SUR1, такая же, как и для K- АТФ- каналов в клетках поджелудочной железы. Поскольку SUR1 участвует в регуляции канала, фармакологические агенты, которые влияют на канал S AT1 с регулируемым KP, также влияют на канал NC Ca-ATP . Таким образом, NC Ca-ATP канальное отверстие блокируется соединениями сульфонилмочевины, такими как толбутамид и глибенкламид, и активность каналов увеличивается диазоксидом.
Канал NC Ca-ATP не конститутивно экспрессируется, а выражается в ЦНС после гипоксии или травмы. Канал был впервые обнаружен в недавно выделенных реактивных астроцитах, полученных из гипоксической внутренней зоны глиотической капсулы. С тех пор он также был идентифицирован в нейронах из ядра ишемического инсульта. В крысиных моделях ишемического инсульта регуляторная субъединица SUR1 транскрипционно регулируется в нейронах, астроцитах и капиллярных эндотелиальных клетках.
Последствия открытия канала изучались в изолированных клетках, которые экспрессируют канал, путем истощения АТФ с использованием Na + азида или Na + цианида в дополнение к 2-дезоксиглюкозе или с использованием диазоксида для открытия канала без истощения АТФ. Эти обработки индуцируют сильный внутренний ток, который деполяризует клетку полностью до 0 мВ и индуцирует цитотоксический отек и клеточное кровоизлияние. Эти эффекты воспроизводятся без истощения АТФ диазоксидом. После этих обработок, клетки умирают преимущественно посредством онкоза, а не путем апоптоза. Влияние блокировки каналов с использованием глибенкламида изучалось in vitro в реактивных астроцитах, которые экспрессирует канал. В клетках, подвергнутых воздействию Na + азида, преднамеренно истощает АТФ, глибенкламид блокирует деполяризацию мембран, значительно уменьшает кровоизлияние, связанное с цитотоксическим отеком, и значительно снижает смертностьуровень онкотических клеток. В модели массивного ишемического инсульта со злокачественным отеком головного мозга, связанного с высокой смертностью (68%), глибенкламид уменьшал смертность и отек мозга (избыток воды) на 50%. В модели инсульта, вызванной тромбоэмболией с задержкой спонтанной реперфузии, глибенкламид уменьшал объем поражения в два раза, а его использование ассоциировалось с кортикальной активностью , связанной с улучшенным лептоменингом побочным кровотоком из-за снижения массового эффекта от отеков.
Семейство канала TRP получило свое название от его роли в фототрансдукции дрозофилы . Это семейство содержит более 50 членов, 28 из которых, как известно, выражены у млекопитающих. Эти каналы различаются по своим режимам активации. Некоторые каналы TRP являются конститутивно открытыми, а другие реагируют на различные стимулы, такие как pH, окислительно-восстановительное состояние, осмолярность, растяжение, напряжение и внутриклеточный Ca 2+ Некоторые из этих каналов являются селективными для Ca 2+ , а другие являются неселективными и проницаемыми для одновалентных и / или двухвалентных катионов. Белки TRP имеют тенденцию образовывать гетеромультимеры и могут проявлять взаимозависимую экспрессию.
Анализ промоутерных областей членов подсемейства TRPC и TRPM TRPC1-7 и TRPM1-8 показывает, что эти члены обладают несколькими консенсус-сайтами связывания для одного или нескольких фак. торов транскрипции, связанных с ишемическим инсультом, что указывает на их возможное участие в гипоксическом повреждении ЦНС.
Электронейтральный котрансперсер NKCC кодируется геном из семейства катион-хлоридных котранспортеров. Этот канал опосредует связанное движение Na + и / или K + с Cl — , с стехиометрией 1Na + : 2K + : 2Cl — . Активность этого транспортера связана с регуляторными ионными реакциями эпителиальных клеток глии, нейронов, эндотелия и сосудистого сплетения. Хотя обнаружены две изоформы, только NKCC1, «домашняя» изоформа канала NKCC, играет роль в секреции и абсорбции натрия, регулировании объема клеток и поддержании внутриклеточной Cl -концентрации в ЦНС. Петлевые диуретики, такие как буметанид, могут ингибировать канал. Изоформа NKCC1 участвует во вторичном переносе неорганических ионов. Движущей силой потока ионов происходит в Na + градиент , создаваемого Na + / K + -АТФазы, с важным вкладом Cl -градиента в эпителиальных клетках. Котранспортер NKCC требует, чтобы все три иона (Na + , K + и Cl — ) одновременно присутствовали на одной стороне мембраны. Уменьшение внутриклеточного Cl — , гипертонический стресс, повышение внутриклеточного Са 2+ , и β-адренергич еские рецепторы стимуляция приводят к фосфорилированию NKCC1, что увеличивает активность канала. Киназы и фосфатазы способствуют регулированию NKCC1 через их противоположные эффекты.
Изоформа NKCC1 играет важную роль в поддержании физиологических внутриклеточных уровней концентрации Na + . Однако в патологических ситуациях, таких как ишемия и гипоксия, было показано, что это способствует чрезмерному притоку Na + , что приводит к цитотоксическому отеку. Данные in vitro в нейронах показывают, что потеря Cl — является достаточным и необходимым стимулом активации NKCC1. Аналогичным образом , работа этой изоформы каналов в астроцитах показывает повышенные уровни внеклеточного К + , чтобы они стали достаточными и необходимыми для активации астроцитов NKCC1. Генетическая абляция NKCC1, а также ее блок с помощью буметанида приводят к уменьшению внутриклеточного Cl — в гипоксических нейронах и блокирует клеточные проявления Na + — и Cl — в астроцитах. Исследования in vivo показали, что внутримозговый буметанид, вводимый через микродиализный зонд, до или во время ишемии / гипоксии, вызванной временной окклюзией MCA, является нейропротективным, улучшает повреждение головного мозга и уменьшает отек мозга при очаговой ишемии.
Каналы рецепторов ионотропных глутаматов обозначены тремя основными классами, основанными на их преимущественном сродстве к агонистам. Один класс, каналы NMDA-рецепторов, является уникальным, поскольку он лиганд-gated путем одновременного связывания глутаминовой кислоты и глицина и зависит от напряжения. При потенциале покоя мембраны этот канал рецептора блокируется «Mg 2+ plug», даже если оба агониста занимают свои соответствующие сайты связывания. Деполяризация клеточной мембраны удаляет этот блок Mg 2+ и позволяет каналу проводить Na + , K + и Ca 2+
Это дуплексное регулирование является интегральным механизмом в клеточном контроле Ca 2+гомеостаза в нейронах. Ион кальция задействован во множестве молекулярных механизмах, участвующих в различных клеточных процессах, но он также вызывает гибель клеток посредством активации Ca 2+ -зависимых протеаз, образования активных форм кислорода, фосфолипазы A2 и повреждения митохондрий. Напомним читателю, что глутамат является основным нейромедиатором в ЦНС. Каналы NMDA-рецепторов встречаются на большинстве нейронов , где они участвуют в нескольких важнейших аспектах физиологической и патологической активности мозга.
Патогенез
В основе развития отека первоначально лежат микроциркуляторные нарушения. Практически сразу после нейронального повреждения вне зависимости от его причины (кровоизлияние, травмы, ишемия, опухоль, воспаление) развивается цитотоксический перифокальный отек головного мозга, а позже на его фоне развивается дисфункция эпителия капилляров с накоплением в интерстициальном пространстве жидкости. В развитии эндотелиальной дисфункции выделяют несколько стадий, которые сопровождаются вначале функциональной (ионный отек), далее анатомической (вазогенный отек/геморрагическое преобразование) недостаточностью, а также недостаточностью гематоэнцефалического барьера.
В основе развития цитотоксического отека — накопление внутри клеток осмотически активных веществ (ионы калия/натри/хлора и молекулы глютамата), что по градиенту осмолярности способствуют перемещению жидкости из интерстиция во внутриклеточное пространство. То есть, в эту фазу отек мозга формируется за счет транс-эпителиального перетока натрия из сосудистого русла, вместе с которым перемещаются ионы хлора (для сохранения электронейтральности) и вода (для сохранения осмонейтральности). На этой стадии присутствует лишь функциональное нарушение проницаемости анатомически неповрежденного гематоэнцефалического барьера. При этом, на этом фоне формируются условия, которые способствующие развитию следующих стадий отека мозга (в частности падение концентрации интерстициального натрия). Стадия цитотоксического отека не приводит к увеличению объема мозговой ткани и внутричерепной гипертензии.
Для развивающегося вазогенного отека характерны уже более выраженные нарушения гомеостаза интерстициального пространства, что приводит к нарушению функции/жизнедеятельности нейронов. В результате повышения проницаемости ГЭБ в межклеточном пространстве происходит накопление воды, что провоцирует развитие гипоксии и вызывает сбой в работе клеточных ионных насосов головного мозга, приводящий уже к пассивному прониканию ионов натрия в клетку, а за ними и воды (процесс набухания клетки).
Накопление в ограниченном пространстве жидкости согласно формуле Монро-Келли, приводит к повышению внутричерепного давления, а в поврежденной глии (вследствие отека) нарушаются процессы обмена/захвата медиаторных аминокислот. При развитии тяжелой внутричерепной гипертензии приводит смещение церебральных структур увеличенного объема мозга с вклинением миндалин мозжечка/стволовых отделов в большое затылочное отверстие. А дальнейшее сдавление сосудов еще более усугубляет микроциркуляторные нарушения/ишемию клеток мозга. Нарушений функции сердечно-сосудистого/дыхательного/терморегуляторного центров, находящихся в стволе мозга, является частой причиной летальных исходов.
Эндотелиальная дисфункция по мере прогрессирования сопровождается выраженным некрозом эпителиоцитов и резким увеличением размеров межклеточного пространства, что способствует прохождения клеток крови и приводит к геморрагическому пропитыванию мозговой ткани, что вызывает тяжелейшее нарушение гомеостаза интерстиция, не совместимому с функционированием нейронов и развитие геморрагического некроза, что ассоциируется с тяжелым исходом отека мозга. На рисунке выше представлен патогенез отека головного мозга.
Симптоматические проявления отечности
Обычно симптомы острого отека у взрослых и детей проявляются уже после основных признаков заболевания-предпосылки. Они возникают по мере прогрессирования отечности и повышения внутричерепного давления. До возникновения осложнений пациент может испытывать:
- головные боли, мигрени, ощущение распирания в голове;
- тревожность;
- дезориентация;
- тошнота и рвота;
- частичное нарушение слуха;
- повышение артериального давления;
- аритмия, тахикардия, ощущение сердцебиения;
- сонливость и вялость;
- нарушение дыхательной функции.
Возможна полная потеря зрения, если происходит сдавливание задней артерии мозга. Вероятно проявление угасания сухожилий, ригидность затылочных мышц. Интенсивность проявления симптомов зависит от степени отека.
Тошнота и рвота обычно становятся следствием повышения артериального давления и возникновения мигрени.
Симптоматика может проявляется одновременно или постепенно. В тяжелых случаях наступает потеря сознания и кома. Отек мозга и его последствия в таких ситуациях представляют наибольшую опасность из-за неясности прогноза.
Классификация
В связи со спецификой развития отека головного мозга выделяют 4 типа:
- Цитотоксический ОГМ — развивается вследствие ишемии, гипоксии, экзо/эндогенном токсическом воздействии на мозговые клетки, вызывающих изменения проницаемости (осморегуляции) клеточных мембран и дисфункцию глиальных клеток (нарушения клеточного метаболизма). Цитотоксический отек обратим на протяжении 6-8 часов за счет реактивации ионного насоса, что достигается восстановлением церебрального кровотока.
- Вазогенный ОГМ — в его основе увеличение проницаемости гематоэнцефалического барьера. Возникает перифокально в зоне ишемии, абсцесса, опухоли, черепно-мозговой травмы, оперативного вмешательства. Основную роль играет переход жидкости из сосудов в белое мозговое вещество. В связи с повышением проницаемости капилляров жидкость частично переходит из сосудов в интерстициальное пространство), вызывая увеличение его объема.
- Осмотический ОГМ — развивается при повышении осмолярности тканей мозга без нарушения работы гематоэнцефалического барьера. Возникает при метаболических энцефалопатиях, гиперволемии, утоплении, неадекватном гемодиализе полидипсии.
- Интерстициальный ОГМ — является результатом быстрого повышения вентрикулярного давления.
- Формируется при пропотеванием стенки церебральных желудочков жидкой части ликвора в перивентрикулярной зоне.
По степени компенсации выделяют:
- Компенсированный ОГМ (характеризуется отсутствием дислокационного синдрома).
- Субкомпенсированный ОГМ (характерно наличие дислокационного синдрома при отсутствии витальных поражений структур головного мозга).
- Декомпенсированный ОГМ (наличие дислокационного синдрома и нарушений витальных функций).
Ниже в таблице приведена обобщённая классификация ОГМ и характеристика его форм.
Причины
Причины отека головного мозга достаточны многочисленны, в соответствии с чем выделяют церебральные и внецеребральные причины ОГМ.
Церебральные причины отека мозга:
- Травмы головного мозга (субдуральная гематома, ушиб головного мозга, перелом основания черепа, диффузное аксональное повреждение, внутримозговая гематома), оперативные вмешательства на головном мозге.
- Первичные опухоли головного мозга (глиома, медуллобластома, астроцитома, гемангиобластома и др.) или метастатическое поражение мозговой ткани, способствующие смещению мозговых структур/нарушающие процесс оттока цереброспинальной жидкости.
- Нарушения мозгового кровообращения — на фоне артериальной гипертензии (при инсульте ишемического/геморрагического генеза) или системного атеросклероза.
- Нейроинфекции (энцефалит, бактериальный менингит), гнойные процессы головного мозга (например, субдуральная эмпиема).
Внецеребральные причины:
- Инфекционные заболевания (грипп, скарлатина, корь, скарлатина, токсоплазмоз, паротит и др.).
- Отравление лекарствами (хинином, антидепрессантами, нейролептиками, антигистаминными средствами и др.) или различными нейротоксическими ядами (цианидами, фенолами, бензином и др.).
- Радиационное облучение.
- Развитие аллергической реакции (анафилактический шок, отек Квинке).
- Энцефалопатии вследствие печеночной/почечной недостаточности, сахарного диабета, отравления алкоголем.
- Резкий набор высоты без требующейся акклиматизации (горный отек).
У новорожденных детей отек мозга может быть обусловлен внутричерепной родовой травмой, тяжелым токсикозом беременной, затяжными родами, обвитием пуповиной.
Симптомы
Симптомы отека головного мозга у взрослых чрезвычайно вариабельны и обусловлены дисфункцией различных структур головного мозга, расстройством метаболических процессов/микроциркуляции и развивающимся увеличением объема ткани мозга, особенно сопровождаемое смещением/вклинением тех или иных мозговых структур, нарушением ликвородинамики/кровотока в сосудах мозга. Также существенную роль играет локализация отека в областях мозга, что определяет его влияние на конкретные структуры головного мозга и формирует кроме общемозговых симптомов очаговую неврологическую симптоматику в зависимости от пострадавших структур мозга. Клинические симптомы отека мозга существенно варьируют в зависимости от стадии его развития, в соответствии с которыми выделяют нижеперечисленные.
Общемозговой синдром
Клинические признаки на этой стадии обусловлены повышением ВЧД (внутричерепного давления), а их проявления/выраженность определяются скоростью его нарастания.
При медленном повышении ВЧД появляется преимущественно утренняя распирающая головная боль, на высоте которой может возникать рвота, чаще без предшествующей тошноты. Интенсивность боли после рвоты, как правило, снижается. Возможны преходящие головокружения. Частым признаком являются застойные диски зрительных нервов/появление преходящих эпизодов нарушения зрения. Помечаются изменения со стороны сердечно-сосудистой системы: брадикардия, повышение систолического АД, урежение дыхания (так называемая «триада Кушинга)». Характерны медленно нарастающие изменения со стороны психики по типу растормаживания: раздражительность, беспокойство, капризность. Объективными симптомами внутричерепной гипертензии при медленном нарастании ВЧД являются полнокровие вен/отек диска зрительного нерва, рентгенологически — истончение костей свода черепа, остеопороз турецкого седла.
При быстром увеличении ВЧД появляется сильная боль пароксизмального/приступообразного характера, часто распирающие боли, сопровождаемые рвотой, которая облегчения не приносит с последующим развитием комы. Появляются брадикардия, глазодвигательные расстройства, повышаются сухожильные рефлексы, развиваются менингеальные симптомы, замедление моторных реакций. На фоне прогрессирования ВЧД отмечаются торможения со стороны психики, что проявляется снижением памяти, выраженной сонливостью, неконтактностью пациента, замедлением речи/мышления.
Синдром рострокаудального диффузного нарастания неврологической симптоматики
Клинические признаки отека мозга на этой стадии определяются постепенным вовлечением тех или иных структур головного мозга в патологический процесс. Как правило, вначале в патологический процесс вовлекаются корковые, позже подкорковые и в конечном итоге — структуры ствола мозга. Для отека полушарий головного мозга характерным является нарушение сознания и появление клонических судорог генерализованного типа.
Распространение процесса на подкорковые/глубинные структуры головного мозга протекает с психомоторным возбуждением, развитием хватательных/защитных рефлексов, гиперкинезами, нарастанием эпилептических пароксизмов.
При переходе патологического процесса на гипоталамическую область/верхние отделы ствола мозга степень нарушения сознания резко нарастает, манифестируя комой/сопором с начальными проявлениями нарушения дыхания и функции сердечно-сосудистой системы. Формируется поза децеребрационной ригидности (установка конечностей в разгибательном положении). Судороги носят стволовой характер (опистотонус/горметония), отмечается мидриаз (расширение зрачков) с вялой реакцией на свет.
Отек покрышки моста головного мозга вызывает специфическое нарушения дыхания в виде периодического дыхания, максимальный двусторонний миоз (сужение зрачков), стволовой парез взора и приводит к исчезновению окуловестибулярного/окулоцефалического рефлексов. При переходе отека на продолговатый мозг (нижний отдел ствола) нарастают нарушения жизненно важных функций, что проявляется замедлением пульса/снижением АД и дыханием. При неврологическом обследовании — арефлексия глубоких рефлексов, диффузная мышечная гипотония, отсутствие реакции зрачков на свет, неподвижность глазных яблок.
Фаза дислокации структур головного мозга
В его основе лежит процесс дислокации и височно-теменное/затылочное вклинение мозговых структур, что проявляется характерной очаговой симптоматикой, основными из которых являются стволовые симптомы (брадикардия, децеребрационная ригидность, дисфагия и др.) с поражением глазодвигательных нервов (мидриаз, птоз, расходящиеся косоглазие). Часто появляется внезапная рвота, ригидность мышц затылка, судороги мышц разгибателей, отсутствие реакции зрачков на свет, снижение температуры тела, урежение сердечного ритма и развитие жизнеугрожающих состояний — резкое падение АД, угнетение сознания (кома), нарушения (остановка) дыхания.
Особая опасность смещений/вклинений супратенториальных структур определяется высоким риском развития сосудистых нарушений, окклюзии путей ликворооттока, что резко усиливает первичные патологические процессы, которые превращаются из нарушений потенциально обратимых в необратимые.
Отек Квинке не бывает смертельным
Ангиоотек, отек Квинке, анафилактический шок… Мы знаем, что все это острые состояния, связанные с аллергией, но большинство из нас не особенно представляет разницу между ними, не понимает, как помочь себе или другому человеку в такой ситуации. Внести ясность мы попросили профессионала
На наши вопросы отвечает
доктор медицинских наук, профессор кафедры детских болезней КИДЗ имени Н.Ф. Филатова Сеченовского университета, аллерголог-иммунолог высшей категории Ася Кудрявцева.
– Ася Валерьевна, давайте начнем с отека Квинке, именно его особенно часто обсуждают в социальных сетях. Насколько опасно такое состояние?
– Отек Квинке – это устаревшее название. Сейчас его называют ангиоотеком.
Ангиоотек и крапивница – это две параллельно текущие истории. Это состояния, связанные с выбросом гистамина из тучных клеток.
Гистамин
Органическое соединение с рядом функций, в том числе он является медиатором аллергических реакций немедленного типа. В обычных условиях гистамин находится в организме преимущественно в связанном, неактивном состоянии. При различных патологических процессах, а также при поступлении в организм некоторых химических веществ, количество свободного гистамина увеличивается.
– Как это происходит?
– При аллергии ангиоотек может быть вызван приемом лекарств, пищевого продукта, у маленьких детей после употребления в пищу молока или яйца, у более старших – рыбы, морепродуктов, орехов или арахиса. Отек может возникнуть при укусе жалящих ядом насекомых.
Иммуноглобулины класса Е – антитела, настроенные против белка, который мы называем аллергеном, они связаны с немедленными опасными аллергическими реакциями. Аллергены пристыковываются к иммуноглобулину E, как космические корабли к станции, вместе они фиксируются на тучных клетках, которые в ответ выкидывают гистамин. Гистамин, в свою очередь, попадая в ткани организма, вызывает такие симптомы, как покраснение, отек и зуд.
Если выброс гистамина произошел на территории кожи рук, живота и спины, на этих местах возникнут волдыри, такие, как мы видим при укусе комара. При крапивнице волдыри могут быть мелкими по диаметру, но иногда они увеличиваются в размерах и даже сливаются.
Ангиоотек, в отличие от крапивницы, – это выброс гистамина на той части кожи, где она хорошо снабжается кровью и склонна к отеку. Если это происходит в зоне век, губ, кистей или стоп, выглядит отек у человека угрожающе, нередко он меняет его внешность. Несмотря на то, что симптомы при крапивнице и ангиоотеке не очень похожи, суть происходящих событий одинакова.
– А разве ангиоотек не затрагивает гортань? Ведь именно такого сценария люди боятся больше всего.
– Нам кажется, что при отеке век и губ аналогичный процесс происходит и в гортани. На самом деле, это не так. Отек гортани – это крайне редкое состояние.
Я встречалась с таким недоразумением: некоторые люди считают, что ангиоотек – это губы и глаза, а вот отек Квинке – это отек языка и гортани. На самом деле, ангиоотек и отек Квинке – это разные названия одного и того же состояния.
Просто отек Квинке, как я уже сказала, – это старая терминология, существующая с конца XIX века, когда немецкий терапевт Генрих Квинке впервые его описал. Но теперь оно вышло из употребления в профессиональном языке.
Дело в том, что когда мы видим волдыри на животе, нас это не особенно пугает, а когда у ребенка или взрослого веки отекли настолько, что трудно открыть глаза, губы сильно увеличились в размере, возникает ощущение, что происходит что-то совсем ужасное, и мы начинаем бояться серьезных последствий.
Я много раз обсуждала ангиоотек с врачами-реаниматологами, спрашивала у них, насколько часто ангиоотек реально приводит к остановке дыхания. Они отвечают, что не встречались с фатальными исходами ангиоотеков, если речь шла об аллергических состояния, связанных с гистамином.
– Откуда же страхи смерти от удушья при ангиоотеке?
– Существует весьма опасное заболевание – наследственный ангионевротический отек (НАО), который, действительно, может приводить к фатальным последствиям, но он, несмотря на внешнее сходство с обычным ангиоотеком, является совершенно иным самостоятельным заболеванием, причем орфанным (очень редким). Его причиной не является аллергия.
Если при обычном ангиоотеке хорошо помогают антигистаминные препараты, то при НАО могут отекать губы и язык, сильно увеличиваясь в размере, но никакие противоаллергические средства тут не помогут. Ведущая роль здесь принадлежит не гистамину, а брадикинину, совершенно иному медиатору.
Такое состояние тоже возникает внезапно, но редко у детей, чаще у взрослых, причем провокатором его может стать внезапное сильное переживание или стресс.
Не снимут такой ангиоотек не только антигистаминные препараты, но и гормональные средства, которые применяют при сильных аллергических реакциях, поможет только переливание плазмы крови или введение специальных лекарств, которых нет в безрецептурном доступе.
Врачи умеют различать эти два состояния, но непрофессионалы, как правило, не знают о разнице между этими двумя болезнями, и волнуются о том, что с ними внезапно может случиться такой приступ, который приведет к остановке дыхания.
Получается, что опасения фатального исхода справедливы лишь в отношении наследственного ангионевротического отека, при котором язык может опухнуть до такой степени, что наступает удушье. Еще раз повторю: состояние это очень редкое, таких больных единицы.
Как правило, до того, как случается такого рода приступ, больной уже знает о своем заболевании. Не исключено, что он уже побывал на операционном столе из-за внезапно возникающих болей в животе, характерных для аппендицита. Его начинают оперировать по поводу аппендицита, но находят там отекшую брыжейку и кишечник, потому что отек у таких больных может возникать в любых частях тела.
Простой же ангиоотек лечится всеми знакомыми антигистаминными препаратами и гормонами.
– А может ли аллергический ангиоотек проявиться внезапно уже во взрослом состоянии?
– Да, такое бывает, но в отличие от НАО, это именно аллергическая реакция. У людей взрослых это, чаще всего, лекарственная аллергия, у детей – пищевая. Эти состояния, как я уже упомянула, зависят от появления в крови иммуноглобулинов класса Е, уровень которых можно после приступа посмотреть в крови и подтвердить аллергию.
Эта ситуация не фатальна, и человеку можно помочь.
Ангиоотек возникает в течение нескольких минут до двух часов после контакта с аллергеном. При аллергии на животных он может развиться у ребенка, например, если его руки облизала собака, как реакция на слюну животного. Или, например, если ребенок погладил животное, а потом этой же рукой потер глаза. Там тоже возникнет отек. Тогда речь будет идти уже об аллергенах, которые находятся в шерсти кота или собаки.
Когда цветут растения, пыльца может залететь в глаза и вызвать отек век. В этом году ольха цвела очень долго и интенсивно, и ангиоотек глаз мы, аллергологи, наблюдали довольно часто. Это всегда острая иммунозависимая реакция, то есть проявление пыльцевой аллергии (поллиноза).
– Что бы вы посоветовали в качестве первой помощи?
– Абсолютно всем людям, склонным к развитию аллергии, следует иметь в домашней или походной аптечке какой-то из антигистаминных препаратов, поскольку, действительно, дебют аллергии может случиться внезапно.
Ребенку или взрослому при ангиоотеке необходимо дать препарат, блокирующий влияние гистамина на ткани. Хочу отметить, что нередко высокой срочности в приеме лекарства нет, и, если вдруг такого препарата не оказалось под рукой, можно успеть дойти до ближайшей аптеки и купить его. Они есть в свободном доступе.
В острой фазе болезни можно использовать абсолютно любые антигистаминные препараты, в том числе и те, которые вызывают седативный эффект (супрастин или тавегил). Эти препараты всасываются уже в полости рта, действуют максимально быстро и хорошо снимают отек.
Нужно помнить, что, приняв такой препарат, человек не должен садиться за руль. Вероятнее всего, врач пропишет ему дальнейшее лечение, и тогда нужно будет использовать более современное лекарство (Кларитин, Эриус, Зиртек или Ксизал), которое принимается раз в сутки и не оказывает снотворного эффекта.
Эти препараты хорошо удерживают в крови высокую концентрацию, поэтому их действие, в отличие от лекарств первого поколения, достаточно длительное. К ним не возникает привыкание, поэтому принимать их можно долго.
– А есть еще анафилаксия. Ее стоит опасаться?
– Анафилаксия – это поражение в момент развития аллергии как минимум двух систем сразу. В подавляющем большинстве случаев это происходит с человеком, который уже некоторое время страдает от аллергии. Это состояние, при котором поражается не только кожа. Подключаются другие органы, и мы наблюдаем, например, ангиоотек и затруднение дыхания, ангиоотек и диарею, крапивницу и рвоту, и так далее.
Сама по себе анафилаксия без шока – не жизнеугрожающее состояние, а к гибели пациента приводит именно анафилактический шок, который встречается достаточно редко.
В связи с повышенной тревожностью в наши дни многие ошибочно считают, что анафилактический шок может внезапно случиться буквально у любого, что абсолютно неправильно.
Это очень редкое явление даже у тех людей, которые страдают от аллергии, не говоря уже о здоровой популяции.
Бывает это так.
Ребенок или взрослый впервые съел арахис, и у него зачесалось во рту. Во второй раз – возник отек глаз. В третий раз не только отекли глаза, но стало тяжело дышать. Когда возникает отек глаз и удушье – это уже анафилактическая реакция. Она может быть как не очень тяжелой, так и тяжелой, когда возникает потеря сознания и человек может погибнуть.
Нетяжелой считается такая реакция, когда нет резкого снижения давления и изменений со стороны сердечно-сосудистой системы. Врачи лечат такое состояние быстро действующим препаратом с адреналином.
В быту в развитых странах мира используются автоинжекторы – это шприцы в форме автоматических ручек для того, чтобы больной, почувствовав приближение анафилаксии, смог быстро вколоть себе (или больному ребенку) укол в бедро прямо через одежду. Это нужно сделать при возникновении даже нетяжелой анафилаксии, не дожидаясь шока.
Обычно человек знает, как у него развивается аллергия. Ему понятно по симптомам, что он съел что-то не то, например, в шоколаде без орехов оказались следовые количества арахиса, который является для этого больного аллергеном.
Эпипен – так называют ручку, заправленную адреналином, можно использовать абсолютно в любой ситуации, необязательно в домашних или больничных условиях. Каждому больному рекомендуется всегда иметь при себе две таких ручки.
В России Эпипен и Эпипен Джуниор (для детей) зарегистрированы, но, к сожалению, в аптеках они не продаются.
Всем, кто имеет риск развитие анафилаксии необходимо пройти обучение как делать уколы обычным шприцом в домашних условиях или автоинжектором, пока едет вызванная больному скорая помощь. Вводить адреналин обычной инъекцией – не очень хороший вариант лечения, потому что не так просто рассчитать и вколоть нужную дозу адреналина.
Сейчас такие больные и родители детей, склонных к анафилаксии, объединяются между собой, чтобы добиться от государства централизованной закупки эпипена, чтобы его можно было купить в аптеке по рецепту врача. Впрочем, многие из них покупают эпипен через интернет, что законом не запрещено.
Для обучения пользованию автоинжектором компания-производитель выпускает даже специальные ручки-тренажеры. Пациент должен быть натренирован, чтобы не волноваться о том, как он справится с уколом в острой ситуации. Ему также объясняют, какие ощущения он должен испытывать во время автоинжекции.
Нужно иметь в виду, что даже после введения Эпипена необходимо вызывать скорую помощь, и врачи должны проконтролировать состояние ребенка или взрослого после приступа анафилаксии.
Нередко родители детей с риском развития анафилаксии сами используют препарат преднизолон. В таких случаях мы, врачи, подробно их инструктируем.
Мне хочется еще раз подчеркнуть: анафилаксия – явление редкое, а анафилактический шок – еще более редкое. Я наблюдаю такой уровень тревожности людей по поводу этих явлений, который совершенно не соответствует масштабу проблемы.
Так, например, многие считают, что препараты для стоматологического наркоза чрезвычайно опасны, и буквально каждый из нас имеет шанс не встать с кресла после лечения зубов.
Есть исследования, однако, которые демонстрируют, что риск возникновения анафилаксии из-за местных анестетиков чрезвычайно низок. Бывает такое, что человек приписывает симптомы, возникающие у него после подобного укола, анафилаксии, а на самом деле они были у него в результате панической атаки.
Я веду блог «Жизнь без аллергии» в интернете. Там я привожу научные данные, например, такие: число смертельных исходов от анафилаксии – от 0,35 до 1,06 эпизодов на миллион жителей в год, при этом, за последние 10-15 лет этот показатель не меняется. Более того, гибель от анафилаксии в общей европейской популяции бывает намного реже, чем случайная смерть.
Случаи гибели от анафилаксии часто описывают СМИ, поэтому они вызывают у нас столь бурную реакцию. Сейчас люди больше, чем обычно тревожатся за свое здоровье, но я советую всем подходить к проблеме разумно и не бояться события, риск которого для подавляющего большинства людей ничтожен.
Ссылка на публикацию: miloserdie.ru
Анализы и диагностика
Отек мозга относится к ургентным состояниям, требующим срочной медицинской помощи в стационарных условиях (отделения интенсивной терапии/реанимации), поэтому первичная диагностика ОГМ должна быть максимально быстрой и проводиться на фоне лечения. Первичным ориентиром при диагностике ОГМ является клиническая симптоматика, однако, необходимо не забывать, что она на этом этапе может быть минимально выраженной. При подозрении на ОГМ проводится неврологическое/офтальмологическое обследование, во время которых оценке болевые, вербально-акустические, поведенческие реакции, глазные/зрачковые рефлексы, состояние диска зрительного нерва, показатели внутриглазного давления. Обязателен клинический/биохимический анализ крови, люмбальная пункция.
Основными методами инструментальной диагностики являются компьютерная томография ядерно-резонансная томография, которые позволяют визуализировать локализацию/распространенность области гипергидратации и выявить признаки компрессионного синдрома. По показаниям может проводиться УЗИ черепа в разных проекциях, эхоэнцефалография/электроэнцефалография, нейроофтальмоскопия, церебральная ангиография.
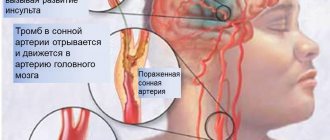
Дифференциальная диагностика проводится с тромбоэмболией мозговых сосудов, метаболическими расстройствами, эпилептическим статусом.
Диагностика отека мозга
Заподозрить отек мозга неврологу позволяет прогрессирующее ухудшение состояния пациента и нарастание нарушения сознания, сопровождающиеся менингеальными симптомами. Подтверждение диагноза возможно при помощи КТ или МРТ головного мозга. Проведение диагностической люмбальной пункции опасно дислокацией церебральных структур со сдавлением мозгового ствола в большом затылочном отверстии. Сбор анамнестических данных, оценка неврологического статуса, клинический и биохимический анализ крови, анализ результатов нейровизуализирующего исследования — позволяют сделать заключение относительно причины отека мозга.
Поскольку отек мозга является угрентным состоянием, требующим неотложной медицинской помощи, его первичная диагностика должна занимать минимум времени и проводиться в стационарных условиях на фоне лечебных мероприятий. В зависимости от ситуации она осуществляется в условиях реанимационного отделения или отделения интенсивной терапии.
Диета
Питание в первые 1-3 дня при ОГМ осуществляют парентеральным путем, для чего вводятся белковые гидролизаты, растворы глюкозы, аминокислоты, плазма, альбумин, комплекс витаминов, специальные питательные смеси. Срок начала энтеральной нутритивной поддержки через зонд определяется в зависимости от состояния пациента, однако для восстановления моторики ЖКТ она должна начинаться по возможности как можно раньше. Для этого используют специальные быстроусвояемые высококалорийные питательные смеси, обогащенные витаминами/микроэлементами, набором заменимых/незаменимых аминокислот в оптимальных дозировках (Нутризон Энергия, Нутризон, Берламин, Нутризон Протеин и др.). Рекомендуется использовать высококонцентрированные смеси, чтобы объем вводимой жидкости сократить, но при этом, обеспечить организм необходимым количеством калорий. Питание через рот пациент может начинать после регресса мозговых расстройств.
Профилактика
Какой-либо специфической профилактики отека головного мозга нет, поскольку он развивается вторично. Среди общих рекомендаций можно привести лишь необходимость соблюдать некоторые правила:
- Минимизируйте риски травматизации головы: используйте защитные приспособления при передвижениях (защитный шлем при езде на роликах/велосипеде/коньках, лыжах; ремни безопасности при езде в автомобиле, не прыгайте головой в водоем и др.).
- Своевременно лечите инфекционные/соматические заболевания.
- Контролируйте артериальное давление.
- Ведите здоровый образ жизни.
- При подъеме на высоту (в горы) не забывайте о необходимости акклиматизации к высоте.
Последствия и осложнения
Последствия отека головного мозга даже в случаях его быстрого купирования могут проявляться отдаленными последствиями (рассеянность, нарушения сна/двигательной активности, коммуникативных способностей, депрессия). В тяжелых случаях последствия отека мозга могут развиваться в виде:
- децеребрального синдрома (характеризуется стойкой разгибательной ригидностью мышц, косоглазием, грубым умственным дефектом);
- декортикационного синдрома (характеризуется нарушением/исчезновением речевых, двигательных и психических навыков;
- постгипоксической энцефалопатии (характеризуется нарушением функции коры с развитием церебрального интелектуально- мнестического дефекта).
Наиболее тяжелое осложнение — смерть от отека головного мозга.
Лечение отека головного мозга
Главными принципами терапии отека головного мозга являются:
- дегидратация;
- улучшение процессов обмена в мозге;
- этиотропное лечение;
- симптоматическая терапия.
Какие последствия отека мозга при инсульте и других патологиях будут сопровождать больного, зависит от своевременности и грамотности проведения терапии.
Дегидратационная терапия
Ее цель – выведение лишней жидкости из тканей головного мозга. В основе назначений:
- осмотические диуретики (мочегонные);
- магния сульфат и раствор глюкозы – они усиливают действие диуретиков, а также улучшают мозговое питание;
- L-лизина эсцинат – препарат не является мочегонным, но выводит жидкость.
Улучшение процессов в мозгу
С этой целью назначаются:
- метаболические препараты;
- глюкокортикостероиды;
- оксигенотерапия.
Этиотропная терапия
При лечении отека головного мозга необходимо устранить причины развития патологии и «разрушить» механизм формирования отека. Назначения:
- антибиотики;
- удаление новообразований и гематом;
- шунтирующие операции, после которых улучшается мозговое кровоснабжение
Такое лечение проводят после того, как состояние больного стабилизировалось.
Симптоматическая терапия
Она направлена на устранение судорог, рвоты, болевого синдрома и так далее. Помимо консервативной терапии, могут применить хирургическое лечение:
- декомпрессионная трепанация черепа;
- дренирование желудочков.
Прогноз
Прогноз при ОГМ может существенно варьировать в зависимости от его этиологии, выраженности, локализации, уровня внутричерепной гипертензии, наличия дислокации мозга. Отек мозга в начальной стадии представляет обратимый процесс, по мере его нарастания развиваются гибель нейронов/деструкции миелиновых волокон, приводящие к необратимым изменениям структур головного мозга.
Однако даже у выживших пациентов после перенесенного отека головного мозга в подавляющем большинстве случаев присутствуют остаточные явления, которые могут существенно варьировать от малозаметных проявлений в виде повышенного внутричерепного давления, частой головной боли, забывчивости, раздражительности, рассеянности, депрессии, нарушений сна, эмоциональных расстройств, замедления интеллектуальных процессов) до выраженных расстройств двигательных/когнитивных функций, психической сферы, приводящих к инвалидизации пациента.
Особенно часто развиваются тяжелые осложнения при инсульте и коме. Соответственно, прогноз при отеке мозга после инсульта, как и прогноз при коме неутешительный, в лучшем случае с инвалидизацией на фоне нарушения координации/двигательных расстройств и нарушений со стороны психики, в худшем — наступает смерть пациента. Показатели летальности при отеке ГМ в зависимости от этиологии и тяжести варьируют в пределах 35-70%.
Популярные вопросы и ответы
На популярные вопросы об отеке головного мозга нам ответил врач-нейрохирург высшей категории, к.м.н. Павел Трушин.
Какие могут быть последствия при отеке головного мозга?
Самое опасное – летальный исход. Происходит вклинение ствола головного мозга, соответственно, наступает сначала коматозное состояние, потом смерть.
Когда вызывать врача на дом при отеке головного мозга?
Это очень серьезное состояние, которое сопровождается нарушением сознания, человек сам не может дышать, переводится на искусственную вентиляцию легких, поэтому при первых признаках на отек нужно немедленно вызывать скорую, чтобы человека отвезли в реанимацию, под наблюдение докторов.
Можно ли лечить отек головного мозга народными средствами?
Народными средствами отек мозга никто не лечит, также, как и дома. Это критическое состояние, из которого можно выйти только с помощью медицинской помощи.
Список источников
- Павленко, А.Ю. Отек мозга: концептуальные подходы к диагностике и лечению / А.Ю. Павленко // Медицина неотложных состояний. — 2007. — № 2 (9). — С. 11-15.
- Принципы и методы диагностики и интенсивной терапии отека и набухания головного мозга: метод. рекомендации / В.И. Черний [и др.]. — Донецк, 2003. — 49 с.
- Слынько Е.И. Травматические повреждения позвоночника и спинного мозга / Е.И. Слынько, А.Н. Хонда. — К.: ПП Гамма-Принт, 2010. — 288 с.
- Мартынов В.А., Жданович Л.Г., Карасева Е.А., Агеева К.А., Хасанова Л.А. Отек-набухание головного мозга: тактика ведения больных // Инфекционные болезни: новости, мнения, обучение. 2018. – Т. 7. – № 1. – С. 124-13.
- Задворнов А.А., Голомидов А.В., Григорьев Е.В. Клиническая патофизиология отека головного мозга. Ч. 2 // Вестник анестезиологии и реаниматологии. – 2022. – Т. 14. – № 4. – С. 52- 60.
Методы профилактики
Своевременная профилактика – это основное условие сохранения здоровья почек, сердца и других органов в любом возрасте. У врачей есть несколько рекомендаций, как избежать появления отеков:
- выбирать продукты с минимальным количеством соли, специй и сахара, отказаться от жирных и жареных блюд;
- отказаться от вредных привычек – курения и употребления алкогольных напитков;
- не наедаться перед сном и не пить много жидкости;
- регулярно проходить обследование щитовидной железы и сдавать кровь на анализы;
- выбирать ортопедические подушки и матрас для сна, которые не будут ухудшать мозговое кровообращение;
- не допускать появления лишнего веса;
- ежедневно выполнять простые физические упражнения на свежем воздухе.
Клинический Институт Мозга предлагает индивидуальные программы диагностики и лечения различных заболеваний, которые сопровождаются отеками в области лица и головной болью. В нашем центре находится точное, современное оборудование, которое позволяет быстро оценить состояние внутренних органов и выполнить необходимые тесты в лабораторных условиях. Врачи – опытные специалисты узкого и широкого профиля. Они назначат грамотную схему лечения, но ее эффективность будет зависеть в том числе от выполнения всех рекомендаций в домашних условиях.