Артериальная гипертензия и сахарный диабет
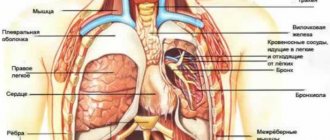
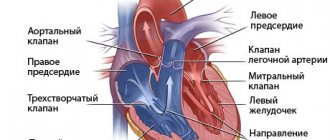
- сердце
- почки
- сосуды мозга
- сосуды сетчатки
Основными причинами высокой инвалидизации и смертности больных артериальной гипертензией с сопутствующим сахарным диабетом являются:
- ИБС
- острый инфаркт миокарда
- нарушения мозгового кровообращения
- терминальная почечная недостаточность
Сочетание АГ и сахарного диабета повышает риск развития ишемической болезни сердца, инсульта, почечной недостаточности в 2-3 раза. Поэтому крайне важно рано распознавать и диагностировать как артериальную гипертензию, так и сахарный диабет, для того, чтобы вовремя назначить соответствующее лечение и остановить развитие тяжелых сосудистых осложнений.
В основе патогенеза многих форм артериальной гипертонии лежит инсулинорезистентность — нарушение реакции организма на эндогенный или экзогенный инсулин. В результате снижается потребление глюкозы периферическими тканями. Данное состояние чаще возникает у лиц с избыточной массой тела и может явно себя не проявлять до наступления метаболических нарушений. При превышении ИМТ (идеальной массы тела) на 35-40% чувствительность к инсулину снижается на 40% . На ионном уровне инсулин оказывает воздействие на поступление кальция и натрия внутрь клетки, которые влияют на сократимость гладкомышечных волокон сосудов. В результате уменьшения чувствительности к инсулину увеличивается приток кальция в клетку и повышается напряжение гладкомышечных клеток. У таких пациентов снижается реакция коронарных артерий на физиологические раздражители (снижается способность к дилятации), что приводит к нарушению микроциркуляции.
В высоких концентрациях глюкоза оказывает прямое токсическое воздействие на эндотелий сосудов, что в свою очередь вызывает увеличение мышечного спазма, гиперплазию гладкомышечных волокон и приводит к развитию атеросклероза. Существует и обратная связь, согласно которой артериальная гипертензия ведет к появлению инсулинорезистентности. Основным в этом механизме является закрытие мелких капилляров и снижение кровотока в скелетных мышцах, что способствует уменьшению утилизации ими глюкозы, то есть инсулинорезистентности мышечной ткани.
Артериальная гипертензия является одним из факторов риска развития сахарного диабета 2-го типа и в сочетании с избыточной массой тела, нарушением липидного обмена, нарушением толерантности к углеводам может привести в 40 % случаев к этому заболеванию и в дальнейшем значительно повысить количество сердечно-сосудистых и почечных осложнений. Предотвратить развитие осложнений этих двух грозных заболеваний можно, если влиять на факторы риска и следовать рекомендациям по здоровому образу жизни: нормализация массы тела, ограничение потребления соли до 3 г/сут., отказ от курения, уделять внимание физическим упражнениям (быстрая ходьба — 30 мин в день, плавание — до 1 ч 3 раза в неделю), регулярное выполнение которых оказывает благоприятное воздействие на чувствительность к инсулину, уровень АД и липидный обмен. Однако следует учитывать, что чрезмерные физические нагрузки могут увеличить риск гипогликемии (понижение уровня сахара в крови), особенно в сочетании с приемом алкоголя.
В процессе лечения необходимо постоянно контролировать развитие обоих заболеваний и стремиться к достижению целевого уровня АД и уровня глюкозы крови, что позволяет значительно снизить риск развития осложнений. При сочетании сахарного диабета и АГ уровень целевого АД составляет менее 130/85 мм.рт.ст., уровень глюкозы крови (плазмы) 3,33-6,1ммоль/л.
Измерение артериального давления в кабинете у врача, часто дает повышенные показатели – это так называемая гипертония «белого халата», то есть кратковременное повышение артериального давления у пациента из-за переживаний по поводу визита к врачу. Контроль АД в домашних условиях способствует получению более реальных значений АД. Не стоит забывать о выборе прибора для самоконтроля. Ведущие специалисты рекомендуют использовать автоматические тонометры с современными технологиями, что гарантирует получение достоверного результата. Для контроля уровня глюкозы крови в домашних условиях идеальны портативные измерители – глюкометры, позволяющие получить быстро точный результат.
Необходимо помнить, что самоконтроль должен быть регулярным, его результаты необходимо заносить в специальный дневник и предоставлять своему лечащему врачу для контроля эффективности назначенного лечения.
У больных сахарным диабетом 2 типа (СД2) артериальная гипертензия (АГ) формируется в 80% случаев [1,2]. При этом распространенность АГ среди городского населения России составляет 40%, а среди сельского — 30% [3].
У 80% больных СД2 причинами возникновения АГ являются метаболический синдром и диабетическая нефропатия. Пусковые факторы развития АГ при метаболическом синдроме — инсулинорезистентность и гиперинсулинемия [4]. В условиях инсулинорезистентности происходит активация симпатической нервной системы и снижается активность натрий-калиевой АТФазы, что, в конечном счете, приводит к усилению тока ионов кальция внутрь гладкомышечных сосудистых клеток и их сокращению. Как симпатотония, так и сокращение гладкомышечных клеток сосудов ведут к повышению артериального давления (АД). Гиперинсулинемия стимулирует пролиферацию гладкомышечных клеток сосудов, приводя к увеличению толщины сосудистой стенки, уменьшению просвета артерий и повышению АД. Помимо этого, гиперинсулинемия ассоциируется с усилением реабсорбции ионов натрия и воды в дистальных извитых канальцах нефрона с последующим увеличением объема циркулирующей крови, что также способствует АГ. Главную роль в развитии АГ у больных с диабетической нефропатией играет усиление синтеза ангиотензина II в тканях за счет активации тканевых ренин-ангиотензиновых систем, а также в результате неренинового пути образования ангиотензина II в почках, сосудистой стенке, миокарде и других органах [5].
Другими причинами возникновения АГ у больных СД2 являются стенозирование просвета почечных артерий или сочетание СД с гипертонической болезнью, паренхиматозными заболеваниями почек, гормонально-активными опухолями надпочечников.
Наличие у больных СД2 реноваскулярной АГ или АГ, обусловленной опухолью надпочечника, требует проведения соответствующего хирургического вмешательства, которое, как правило, приводит к нормализации уровня АД или смягчению течения АГ. В остальных случаях назначают немедикаментозное и медикаментозное лечение АГ, тактика которого не зависит от конкретной причины ее возникновения.
Основные принципы терапии АГ у больных СД2 имеют некоторые отличия от таковой у пациентов без СД. Необходимо подчеркнуть, что сам факт наличия СД увеличивает вероятность возникновения угрожающих жизни осложнений АГ до уровня высокого или очень высокого риска [6]. Это означает, что в течение ближайших 10 лет у более чем 20% таких больных на фоне АГ разовьется инсульт или острый инфаркт миокарда. По этой причине наличие при СД2 АГ 1 степени тяжести является показанием к немедленному назначению медикаментозного лечения, даже при отсутствии дополнительных факторов риска и сопутствующих заболеваний. Более того, в случае обнаружения СД антигипертензивную медикаментозную терапию необходимо начинать даже у пациентов с так называемым высоким нормальным АД (і130/85 мм рт. ст.) [7].
У больных с АГ, протекающей без СД, рекомендуется стремиться к снижению АД до уровня ниже 140/90 мм рт. ст. При сочетании АГ и СД рекомендуемый целевой уровень АД зависит от выраженности протеинурии. Если ее нет или потеря белка с мочой не превышает 1 г в сутки, целесообразно снижать АД ниже 130/85 мм рт. ст. Если с мочой теряется более 1 г белка, следует поддерживать АД на уровне ниже 125/75 мм рт. ст. [7].
Фармакотерапию обязательно сочетают с немедикаментозным лечением АГ, включающим снижение избыточной массы тела, рациональное питание, ограничение потребления поваренной соли и алкоголя, борьбу с курением, малоподвижным образом жизни и стрессом [6]. Это позволяет повысить чувствительность больных к действию антигипертензивных препаратов, уменьшает выраженность побочных эффектов медикаментов, благоприятно влияет на регуляцию углеводного обмена и улучшает качество жизни. Комплексное лечение АГ у больных СД эффективно лишь в том случае, если наряду с антигипертензивной терапией проводится терапия, направленная на достижение компенсации СД.
При нормальным состоянии углеводного обмена медикаментозное лечение АГ можно начинать как с монотерапии, так и с назначения комбинации антигипертензивных препаратов [2,6,7]. При АГ на фоне СД2 с самого начала рекомендуется проводить комбинированную гипотензивную терапию [8-10]. Это позволяет обеспечить лучшую протекцию жизненно важных органов и скорее добиться достижения целевого уровня АД. Рационально подобранная комбинация препаратов с различными механизмами действия способна обеспечить потенцирование гипотензивного действия и взаимную нейтрализацию побочных эффектов используемых медикаментов [11]. Еще одной особенностью фармакотерапии АГ при СД2 является то, что в этом случае ее не рекомендуется начинать с комбинации диуретика и бета-адреноблокатора, тогда как у пациентов без СД такой способ коррекции АГ может считаться вполне оправданным и часто используется. Следует, однако, отметить, что исследования последних лет заставляют пересмотреть существующие представления о нецелесообразности сочетанного применения диуретиков и бета-адреноблокаторов при СД, о чем более подробно будет сказано ниже.
Вне зависимости от наличия СД, медикаментозное лечение АГ должно быть длительным (чаще всего пожизненным). Неприемлемо курсовое назначение антигипертензивных препаратов. Применяемые лекарственные средства должны соответствовать следующим современным требованиям клинической фармакологии:
- период полужизни антигипертензивного препарата и его активного метаболита должен составлять не менее 12 часов;
- адекватный контроль уровня АД должен достигаться при назначении препарата не чаще 2 раз в сутки;
- остаточный эффект препарата (через 24 часа после однократного приема разовой дозы) должен составлять не менее 50% от максимального эффекта.
Желательно также наличие у антигипертензивного препарата 2 путей элиминации из организма.
При наличии соответствующих показаний антигипертензивная терапия должна дополняться назначением гиполипидемических средств и/или препаратов, содержащих аспирин [6,7].
Эксперты ВОЗ и Международного общества по изучению АГ в качестве препаратов первого ряда, предназначенных для лечения АГ, рекомендуют использовать диуретики, бета-адреноблокаторы, антагонисты кальция, ингибиторы ангиотензин-превращающего фермента (ИАПФ), антагонисты рецепторов ангиотензина II и альфа-адреноблокаторы. В качестве вспомогательных средств рекомендованы препараты центрального действия, в частности, агонисты имидазолиновых рецепторов [6].
За последние 8-10 лет отношение клиницистов к использованию при СД многих антигипертензивных препаратов претерпело существенные изменения. Еще в начале 90-х гг. прошлого века считалось, что средствами выбора для лечения АГ при СД2 являются ИАПФ и альфа-адреноблокаторы. Допускалось также применение антагонистов кальция. Кроме того, уже тогда считалось, что при СД2 нежелательно использовать бета-адреноблокаторы и диуретики из-за их неблагоприятного влияния на показатели липидного и углеводного обмена [12].
В настоящее время ИАПФ сохраняют лидирующие позиции в качестве средств лечения АГ при СД [2,3,11], однако столь же эффективным и целесообразным считается использование у этой категории больных антагонистов рецепторов ангиотензина II (например, лозартана — Козаар) [13]. При отсутствии противопоказаний ИАПФ или антагонисты ангиотензиновых рецепторов должны назначаться всем пациентам у которых АГ развивается на фоне СД. Эти препараты более эффективно, чем все остальные антигипертензивные средства, уменьшают выраженность микроальбуминурии и протеинурии (на 40%). Только они при проведении многоцентровых исследований доказали свою способность в 5-6 раз замедлять темпы снижения скорости клубочковой фильтрации и предотвращать развитие хронической почечной недостаточности у пациентов с диабетической нефропатией [13-16]. Кроме того, ИАПФ и антагонисты рецепторов ангиотензина II эффективно предотвращают развитие инсульта и острого инфаркта миокарда при АГ [3,13,16], предупреждают развитие артериолонекроза и артериологиалиноза, превосходят другие препараты по способности снижать выраженность гипертрофии миокарда, являются средством выбора для лечения сопутствующей недостаточности кровообращения [3,11]. В многоцентровых исследованиях ИАПФ уменьшали выраженность атеросклеротического поражения коронарных артерий [2,16], снижали смертность при остром инфаркте миокарда среди больных с низкой фракцией выброса левого желудочка [3], оказывали антиканцерогенное действие. ИАПФ допустимо использовать у пациентов с умеренно выраженной хронической почечной недостаточностью, если уровень креатинина в плазме крови составляет менее 300 мкмоль/л. При уровне креатинина ниже 200 мкмоль/л применяют средние терапевтические дозы ИАПФ. Если содержание креатинина в плазме колеблется в пределах от 200 до 300 мкмоль/л, суточная доза ИАПФ должна быть снижена в 2-4 раза, и использование этих препаратов должно осуществляться под тщательным динамическим контролем за уровнем креатинина в плазме крови. Наиболее частым побочным эффектом ИАПФ является сухой кашель, из-за которого 5-10% больных вынуждены отказаться от их применения. В отличие от ИАПФ, антагонисты ангитензиновых рецепторов не провоцируют появление кашля.
Применение антагонистов кальция у больных с сочетанием СД2 и АГ также считается вполне оправданным, хотя по нефропротекторному действию эти препараты уступают ИАПФ или антагонистам рецепторов ангиотензина II [2,3,13]. Многоцентровые исследования FACET и STOP Hypertension-2 свидетельствуют, что у больных СД2 с АГ антагонисты кальция несколько уступают ИАПФ, с точки зрения предотвращения инсульта и острого инфаркта миокарда [17,18]. В то же время несомненными достоинствами антагонистов кальция являются способность предупреждать приступы вариантной (вазоспастической) стенокардии [2] и высокая эффективность у пожилых пациентов, включая способность вдвое снижать риск развития деменции при наличии нарушений мозгового кровообращения в анамнезе [11,19]. Кроме того, верапамил и дилтиазем уменьшают выраженность наджелудочковых аритмий, а дилтиазем повышает также выживаемость больных с острым инфарктом миокарда без зубца Q и снижения фракции выброса левого желудочка. При ситуации, когда у больного СД2, помимо АГ, имеется сопутствующая недостаточность кровообращения, выбор среди антагонистов кальция следует останавливать на амлодипине и фелодипине, безопасность применения которых при недостаточности кровообращения (в составе комбинированной антигипертензивной терапии) может сегодня считаться доказанной [2,3].
Для длительного лечения АГ у больных СД2 не следует использовать короткодействующий нифедипин, который может усиливать протеинурию, усугублять проявления недостаточности кровообращения, а в больших дозах (160-200 мг в сутки) — ухудшать прогноз у больных ИБС с постинфарктным кардиосклерозом [3].
В 2000 г. были опубликованы предварительные результаты многоцентрового исследования ALLHAT, которые показали, что, с точки зрения безопасности применения, альфа-адреноблокаторы уступают другим антигипертензивным препаратам. В частности, было установлено, что у больных с АГ и ранее перенесенными кардиоваскулярными осложнениями, принимавших альфа-адреноблокатор доксазозин в сочетании с диуретиком хлорталидоном, риск развития инсульта и недостаточности кровообращения был на 19% и 100% соответственно выше, чем у пациентов, получавших один хлорталидон и хлорталидон в сочетании с ИАПФ лизиноприлом или антагонистом кальция амлодипином [20]. Таким образом, предварительные результаты исследования ALLHAT позволяют усомниться в целесообразности использования альфа-адреноблокаторов в качестве препаратов выбора для лечения АГ (в т.ч. у пациентов с сочетанием АГ и СД).
За последние годы изменилось отношение к использованию бета-адреноблокаторов и диуретиков при СД2. В первую очередь, необходимо отметить, что современные высокоселективные пролонгированные бета-адреноблокаторы (метопролол, бисопролол, небиволол, атенолол и др.), диуретик индапамид и малые дозы гидрохлоротиазида не влияют на показатели липидного и углеводного обмена, не изменяя, в частности, уровень гликированного гемоглобина и содержание глюкозы в венозной крови [7,11,21]. Поэтому применение указанных препаратов при СД может считаться вполне безопасным. Кроме того, результаты многоцентрового исследования SHEP свидетельствуют, что у пациентов с СД2 и АГ диуретики и бета-адреноблокаторы предупреждали развитие инсульта и острого инфаркта миокарда даже более эффективно, чем у больных с АГ без СД [22]. Наконец, при проведении многоцентровых исследований (UKPDS 39, STOP Hypertension-2, IPPSH, CAPPP) установлено, что у больных с СД и АГ современные кардиоселективные бета-адреноблокаторы снижают риск инсульта, острого инфаркта миокарда и сердечно-сосудистой смерти не менее эффективно, чем ИАПФ. В совокупности все эти данные позволяют говорить о целесообразности применения кардиоселективных бета-адреноблокаторов и диуретиков для лечения АГ при СД2. Специалисты из Международного общества по изучению АГ даже рассматривают наличие СД2 у пациента с АГ в качестве дополнительного показания к назначению бета-адреноблокаторов.
Бета-адреноблокаторы обладают рядом достоинств, которых лишены другие антигипертензивные препараты. Так, например, только они уменьшают количество и продолжительность эпизодов немой ишемии миокарда. Среди антигипертензивных средств липофильные бета-адреноблокаторы (метопролол, небиволол, бетаксолол, бисопролол) предотвращают развитие фибрилляции желудочков. Только бета-адреноблокаторы и ИАПФ предотвращают развитие повторного инфаркта миокарда при АГ [2,11]. Наряду с антагонистами кальция, бета-адреноблокаторы урежают приступы стенокардии; подобно верапамилу и дилтиазему, они оказывают благоприятный эффект при наджелудочковых аритмиях. ИАПФ, бета-адреноблокаторы и диуретики являются препаратами выбора для лечения сопутствующей недостаточности кровообращения [11]. Такие бета-адреноблокаторы, как атенолол, метопролол и небиволол, продемонстрировали способность уменьшать протеинурию независимо от степени снижения АД.
К важным достоинствам диуретиков относится их способность потенцировать гипотензивный эффект большинства известных антигипертензивных препаратов, уменьшать чувствительность сосудистой стенки к действию вазопрессорных гормонов, а также высокая эффективность у пожилых пациентов [2,11].
Из диуретиков предпочтение следует отдавать индапамиду, назначаемому в средней суточной дозе. Если пациент по каким-либо причинам не может использовать индапамид, вместо него можно использовать малые дозы гидрохлоротиазида — от 6,25 до 12,5 мг в сутки [21]. При СД нецелесообразно применять триамтерен и амилорид, поскольку эти калийсберегающие диуретики обладают нефротоксическими свойствами [2].
У больных СД2 с АГ очень перспективным может быть использование агониста имидазолиновых рецепторов моксонидина, так именно у этой категории пациентов своеобразный спектр фармакологических эффектов указанного препарата может обеспечить ряд дополнительных преимуществ. В клинических исследованиях показано, что моксонидин уменьшает выраженность протеинурии и замедляет темпы снижения скорости клубочковой фильтрации при диабетической нефропатии [23]. Уникальным среди других антигипертензивных препаратов свойством моксонидина является его способность уменьшать инсулинорезистентность у больных СД2. После завершения многоцентровых клинических испытаний у моксонидина есть все шансы войти в перечень препаратов первого ряда, применяемых для лечения АГ у больных СД2.
Поскольку у больных с сочетанием СД и АГ предпочтительно применять комбинированную антигипертензивную терапию, необходимо дать сравнительную характеристику такого рода комбинаций. Наилучшим органопротекторным эффектом при СД2 в сочетании с АГ обладает комбинация ИАПФ (или антагониста рецепторов ангиотензина II) с бета-адреноблокатором, которая позволяет наиболее эффективно предотвратить поражения почек, сердца и головного мозга [2,11]. Вместе с тем, эта комбинация не всегда позволяет добиться желаемого гипотензивного эффекта. Поэтому в ряде случаев для достижения целевого уровня АД к этой комбинации целесообразно добавить диуретик. Комбинированное лечение с использованием ИАПФ и антагониста кальция (иногда с добавлением диуретика) обычно также позволяет добиться адекватного снижения АД у больных СД2 и оказывает отчетливый органопротекторный эффект [11,15,24]. В настоящее время проводится многоцентровое клиническое исследование VALUE-2, в котором у 15300 больных с АГ (у 30% из них СД2) оценивается эффективность комбинированного лечения антагонистом ангиотензиновых рецепторов и антагонистом кальция. Наконец, эффективно контролировать уровень АД позволяет сочетание ИАПФ и диуретика [2,7]. Однако, при наличии СД применение этой комбинации кажется менее рациональным, чем рассмотренных выше схем комбинированного лечения, поскольку она обладает не столь выраженным нефро- и кардиопротекторным действием.
При наличии противопоказаний к ИАПФ и антагонистам рецепторов ангиотензина II комбинированную гипотензивную терапию можно проводить с использованием антагониста кальция и бета-адреноблокатора. Менее рациональными представляются комбинации антагониста кальция и диуретика или альфа- и бета-адреноблокатора.
Для повышения эффективности любой схемы комбинированной гипотензивной терапии у больных СД2 в ее состав можно дополнительно включать моксонидин в качестве 3 или 4 компонента.
В настоящее время в 5-летнем многоцентровом исследовании ABCD-2 оценивается эффективность и безопасность комбинированного лечения больных СД2, протекающим с диабетической нефропатией и АГ, антагонистом ангиотензиновых рецепторов (вальсартан) и ИАПФ (каптоприл).
Таким образом, АГ у больных СД2 может быть обусловлена несколькими причинами, но принципы ее лечения остаются общими для всех пациентов и имеют некоторые отличия от тактики лечения больных с АГ, развивающейся на фоне нормальных показателей углеводного обмена.
Журнал «Медицина неотложных состояний» 1(8) 2007
Сахарный диабет (СД) 2-го типа и артериальная гипертензия (АГ) неотступно следуют друг за другом и приводят к чрезвычайно быстрому развитию осложнений со стороны как мелких сосудов почек и сетчатки, так и крупных сосудов сердца, мозга, периферических сосудов нижних конечностей и др [1]. Повышение артериального давления (АД) обнаруживается у 80 % больных с СД 2-го типа. При сочетании у одного и того же пациента СД и АГ риск развития ишемической болезни сердца (ИБС) повышается в 2–4 раза, инсульта — в 2–3 раза, полной потери зрения — в 10–25 раз, уремии — в 15–20 раз, гангрены нижних конечностей — в 20 раз [2].
СД ведет к развитию тяжелых, инвалидизирующих осложнений, в основе формирования которых прежде всего лежит поражение сосудов различного калибра — как капилляров и мелких артерий (диабетическая микроангиопатия), так и сосудов среднего и крупного калибра (диабетическая макроангиопатия, представляющая собой более агрессивно протекающий атеросклеротический процесс). Основными «органами-мишенями», чаще всего страдающими при СД, являются глазное дно (в результате чего развивается диабетическая ретинопатия, представляющая собой ведущую причину слепоты в современном обществе), сосуды клубочков почек (формирующаяся при этом диабетическая нефропатия, ведущая к развитию хронической почечной недостаточности, является основной причиной смертности у лиц с СД), а также магистральные сосуды — коронарные сосуды сердца, артерии, участвующие в кровоснабжении головного мозга, и периферические сосуды. Атеросклеротическое поражение сосудов приводит к повышенной заболеваемости сердечно-сосудистой патологией, смертность от которой у пациентов с СД в 2–3 раза превышает аналогичный показатель у лиц, не страдающих этим заболеванием [2].
АГ значительно чаще отмечается у больных СД по сравнению с показателем распространенности гипертензии в общей популяции. Установлено, что повышение АД является одним из важнейших факторов риска развития и прогрессирования диабетических микро- и макроангиопатий, а снижение АД, напротив, приводит к значительному снижению риска формирования указанных осложнений СД. Так, в исследовании UKPDS, явившемся наиболее крупным и важным исследованием в области СД 2-го типа, было установлено, что снижение артериального систолического давления на 10 мм рт.ст. приводит к снижению риска развития осложнений СД на 12 %, смертности, непосредственно обусловленной диабетом, — на 15 %, инфаркта миокарда — на 11 %, микрососудистых осложнений — на 13 %. Таким образом, своевременное выявление АГ и назначение адекватной терапии рассматривается в настоящее время как одно из важнейших направлений профилактики сердечно-сосудистых и микрососудистых осложнений у пациентов, страдающих СД [3].
Почему же столь стремительно развивается патология перечисленных органов-мишеней при одновременном сосуществовании СД и АГ? Причина заключается в том, что первым слоем клеток, берущих на себя как метаболический, так и гидравлический «удар», является слой клеток эндотелия сосудов. Эти клетки, подвергаясь длительному воздействию гипергликемии и дислипидемии, характерных для СД, а также механическому давлению изнутри вследствие высокого АД, постепенно «выходят из строя», начиная продуцировать факторы, ускоряющие процессы атерогенеза (рис. 1): снижается синтез эндотелиального фактора релаксации сосудов (оксида азота), повышается секреция мощного сосудосуживающего фактора эндотелина-1, активируется экспрессия молекул адгезии, усиливаются агрегация тромбоцитов, окислительный стресс, пролиферация гладкомышечных клеток. Одновременно происходит процесс неферментного гликозилирования белков сосудистой стенки, что приводит к ее утолщению, деформации, потере эластичности и повышению проницаемости для белков, липидов и других компонентов плазмы [8].
Учитывая все перечисленные факторы, ускоряющие развитие сосудистых осложнений при сочетании СД и АГ, Объединенный комитет диабетологов Европы и Американская диабетическая ассоциация установили более жесткие требования к контролю АД при СД. Согласно этим требованиям, уровень АД у больных СД не должен превышать 130/80 мм рт.ст. При этом необходимо поддерживать стабильную компенсацию углеводных нарушений (гликированный гемоглобин А1с < 7 % (при норме до 6,4 %), гликемия натощак 5,5 ммоль/л и менее, гликемия через 2 ч после еды 8 ммоль/л и менее) и проводить коррекцию липидного обмена: общий холестерин (ХС) £ 4,5 ммоль/л, ХС липопротеидов низкой плотности (ЛПНП) £ 2,6 ммоль/л, ХС липопротеидов высокой плотности (ЛПВП) > 1,0 ммоль/л, триглицериды (ТГ) <� 1,7 ммоль/л. Только при соблюдении всех трех условий (контроль АД, гликемии и липидного обмена) можно ожидать предупреждения или замедления развития сосудистой патологии при СД. В реальной жизни достичь целевых значений всех трех факторов риска сердечно-сосудистых осложнений при СД чрезвычайно сложно [5].
Пусковым моментом в развитии любого сосудистого осложнения СД является гипергликемия. При НbА1с < 6,5 % риск развития микро- и макроангиопатий минимален. Однако присоединившаяся АГ ускоряет развитие сосудистых осложнений СД даже при достижении оптимального контроля гликемии.
Исследования (UKPDS) показывают, что снижение систолического АД (САД) на 10 мм рт.ст. и диастолического АД (ДАД) на 5 мм рт.ст. достоверно более эффективно снижало риск прогрессирования любого сосудистого осложнения СД, чем снижение НbА1с на 1 %. Это говорит о том, что, если мы хотим не допустить развития осложнений СД, мы должны направить все усилия на достижение идеальной компенсации углеводного обмена. Однако если сосудистые осложнения уже есть и им сопутствует АГ, то успех лечения в большей степени зависит от качества контроля АД.
Исследования последних 10–15 лет доказали ведущую роль активации ренин-ангиотензиновой системы (РАС) в развитии АГ и сосудистых осложнений при СД — диабетической нефропатии, ретинопатии, ишемической болезни сердца. Поворотным моментом в переосмыслении значимости этой системы в развитии патологии различных органов явилось обнаружение локальных тканевых РАС, найденных в клетках почек, сердца, мозга, эндотелии сосудов и других тканях. В экспериментальных и клинических исследованиях установлено, что при СД под воздействием гипергликемии происходит гиперактивация тканевых РАС. При этом секреция основного субстрата этой системы — ангиотензина II (АТ II) — тканью почек, сердца, эндотелием сосудов при СД повышается во много раз. В частности, установлено, что локально почечная концентрация АТ II в тысячи раз превышает его содержание в плазме крови. Механизмы патогенного действия АТ II обусловлены не только его мощным вазоконстрикторным действием, но и пролиферативной, прооксидантной и протромбогенной активностью. Активируя целый комплекс цитокинов, АТ II способствует развитию фиброза и склероза ткани, в которой он локально синтезирован, будь то ткань почек, сердца, сосуды сетчатки или эндотелий сосудов (рис. 2).
Поэтому неудивительно, что в лечении сосудистых осложнений СД, ишемической болезни сердца и сердечной недостаточности, в лечении АГ и профилактике атеросклероза при СД на первый план выходят препараты, блокирующие РАС. Максимальный органопротективный эффект этих препаратов отмечается у больных СД с диабетической нефропатией [2].
В последние годы в результате проведения как экспериментальных, так и клинических исследований, в том числе крупных рандомизированных многоцентровых, было показано, что ингибирование образования или физиологического действия биологически активного вещества ангиотензина II не только оказывает весьма благоприятное воздействие в плане снижения риска развития микро- и макрососудистых осложнений, но и приводит к уменьшению заболеваемости СД 2-го типа. С целью блокирования активности системы ренин — ангиотензин используются препараты — ингибиторы ангиотензинпревращающего фермента (ИАПФ) [4].
Ингибиторы АПФ относятся к препаратам первого ряда, применяемым для лечения артериальной гипертензии у больных сахарным диабетом. Установлено, что при терапии больных с помощью этих препаратов отмечается значительное уменьшение заболеваемости инфарктом миокарда, церебральным инсультом, сердечной недостаточностью, что в конечном счете приводит к снижению смертности у пациентов с диабетом. При этом представляется весьма важным подчеркнуть, что ингибиторы АПФ оказывают свое положительное воздействие не только путем непосредственного снижения артериального давления, но, по-видимому, и за счет непосредственного «органопротекторного» эффекта. Так, в исследовании HOPE было установлено, что прием ингибитора АПФ приводил к уменьшению числа всех случаев сердечно-сосудистых заболеваний у больных сахарным диабетом на 25 %, инфаркта миокарда — на 22 %, инсульта — на 33 %, сердечно-сосудистой смертности — на 37 %, общей смертности — на 24%, необходимости проведения реваскуляризации на коронарных сосудах сердца — на 24 %, развития клинически выраженной нефропатии — на 24 %. Следует особо подчеркнуть, на наш взгляд, то обстоятельство, что у включенных в исследование пациентов не было значительно повышенных показателей АД: среднее значение давления было 142/80 мм рт.ст., а изменение показателей АД в процессе исследования под влиянием гипотензивного лечения было небольшим, что позволяет утверждать, что антигипертензивная терапия с помощью препаратов — ингибиторов АПФ оказывает кардиопротекторное действие не только за счет понижения АД. Результаты этого исследования доказывают необходимость широкого применения антигипертензивной терапии даже у тех пациентов с СД, у которых показатели САД находятся в пределах 130–140 мм рт.ст.
Ингибиторы АПФ особо показаны больным СД, поскольку положительные метаболические свойства этих препаратов — улучшение чувствительности тканей к инсулину, отсутствие отрицательного влияния на углеводный и липидный обмен — выгодно отличают их от ряда других антигипертензивных средств. Особый интерес представляют полученные в исследованиях HOPE, CAPPP данные о том, что длительное использование препаратов — ингибиторов АПФ приводит к достоверному снижению риска развития СД 2-го типа. Так, в уже упомянутом исследовании HOPE было установлено, что в группе лиц, получавших ингибитор АПФ, частота развития новых случаев СД 2-го типа снизилась на 34 %. Подобное действие этих препаратов можно, по-видимому, объяснить отмеченным в ряде исследований положительным влиянием блокады образования и действия ангиотензина II на эндотелиальную функцию, чувствительность периферических тканей к инсулину и уменьшением при этом инсулинорезистентности, а также уменьшением оксидативного стресса [4, 6, 7].
Опыт применения первых поколений ИАПФ (каптоприл, эналаприл) показывает, что при длительном (практически постоянном) приеме этих препаратов у части больных отмечается так называемый эффект ускользания, т.е. ослабление антигипертензивной активности препаратов. Наиболее вероятным объяснением этого феномена является существование альтернативного, независимого от АПФ пути образования АТ II. Этот путь обеспечивается активностью другого фермента — химазы, которая преобразует АТ I в АТ II, минуя АПФ. Активность химазы очень высока в сердце (80 %), стенке сосуда (70 %) и почках (40 %). Обнаружение этого факта привело исследователей-фармакологов к поиску возможностей блокировать действие АТ II не посредством инактивации АПФ, а путем блокады рецепторов, с которыми связывается этот пептид. Физиологические эффекты АТ II осуществляются через специфические рецепторы, главными из которых являются рецепторы АТ I и АТ II (рис. 3). Если стимуляция АТ I приводит к активации процессов, стимулирующих прогрессирование атеросклеротических изменений ткани (вазоконстрикция, пролиферация и гипертрофия клеток, активация провоспалительных цитокинов), то стимуляция АТ II рецепторов, напротив, активирует антиатерогенные процессы, обеспечивая вазодилатацию, блокаду пролиферации клеток и ремоделирования сосудов. Кроме того, было обнаружено, что при блокаде АТ I рецепторов АТ II избыточно связывается с АТ II рецепторами, что обеспечивает дополнительный ангиопротективный эффект [6].
Таким образом, важной при выборе ИАПФ является возможность блокирования тканевой РАС. Одним из наиболее перспективных и широко применяемых в настоящее время ингибиторов АПФ является представитель III класса — лизиноприл [7].
Основное действие лизиноприла достигается ингибированием плазменного и тканевого АПФ. Выраженный эффект 10 мг лизиноприла на плазменную концентрацию ангиотензина II, активность АПФ, снижение активности ренина плазмы и снижение уровня альдостерона начинается через 2–3 ч и достигает максимальной степени через 6–8 ч. Эффективная доза у больных АГ составляет 5–10 мг. Ингибирование лизиноприлом активности АПФ персистирует от 12 до 24 ч.
В соответствии с принятыми рекомендациями оптимальная антигипертензивная терапия должна обеспечивать 24-часовую эффективность при однократном режиме дозирования и сохранять как минимум 50% эффективность остаточного АД к максимальному в конце междозового интервала (показатель Т/Р). Использование препаратов с однократным приемом в сутки при соблюдении требований к продолжительности действия в соответствии с указанным отношением Т/Р имеет, помимо хороших показателей приверженности больных к лечению, более мягкий и продолжительный эффект, приводящий к снижению риска внезапной смерти в ранние утренние часы.
Прием пищи не влияет на скорость всасывания лизиноприла, при прекращении лечения лизиноприлом синдром отмены не развивается. В отличие от большинства других ингибиторов АПФ лизиноприл не нуждается в биотрансформации для образования активного вещества и не требует связи с белками плазмы для транспортировки к органам-мишеням.
Поэтому представляло интерес изучение эффективности и безопасности применения препарата, содержащего лизиноприла дигидрат, под торговым названием Лоприл («Bosnalijek», Сараево) у больных с СД и АГ. На базе эндокринологического отделения Харьковской областной клинической больницы проведено изучение клинической эффективности и фармакодинамических эффектов этого препарата.
В исследовании участвовало 28 пациентов (18 женщин и 10 мужчин) с СД 2-го типа и АГ II ст., средний возраст которых составил у женщин 54,8 ± 6,2 года, у мужчин — 56,2 ± 7,2 года. У 21 пациента АГ сочеталась с ИБС, стенокардией напряжения 1–2 ФК, у 26 пациентов (16 женщин и 10 мужчин) имели место проявления диабетической ангиопатии в виде диабетической нефропатии — у 16 (5 мужчин и 11 женщин), ретинопатии — у 21 (8 мужчин и 13 женщин), нейропатии — у 22 пациентов (8 мужчин и 14 женщин).
Проводили общеклиническое обследование, измеряли уровень глюкозы в крови, гликозилированного гемоглобина, гликемический и глюкозурический профиль, определяли липидный спектр крови, уровень протеинурии, показатели микроальбуминурии, показатели функционального состояния почек; осуществляли суточное мониторирование АД, ЭКГ, эхокардиографию.
Антигипертензивную эффективность, переносимость и безопасность препарата Лоприл двукратно оценивали при помощи контроля АД у пациентов, получавших 5–20 мг препарата 1 раз в день в течение 2-недельного периода. Доза препарата титровалась в зависимости от ответной реакции пациента благодаря дозозависимому эффекту Лоприла после начальной дозы в 10 мг, через неделю приема препарата доза повышалась до 15–20 мг в сутки. Средняя доза препарата составила 12,5 мг, максимальная — 20 мг у пациентов с АГ ІІ стадии, СД 2-го типа, с диабетической нефропатией.
При анализе данных суточного мониторирования АД установлено, что через 2 недели терапии среднесуточное, среднедневное САД и ДАД снизилось существенно и достоверно (до лечения САД 177,5 ± 5,9 мм рт.ст. и ДАД 98,6 ± 3,5 мм рт.ст.). В дальнейшем отмечено нарастание антигипертензивного действия препарата. К концу периода лечения среднее значение САД и ДАД у большинства больных соответствовало нормальным показателям (САД 125,3 ± 5,7 мм рт.ст. и ДАД 79,2 ± 2,4 мм рт.ст.). Монотерапия оказалась эффективной у 77 % больных. Лоприл проявил способность надежно контролировать АД в утренние часы. Так, через 2 недели терапии утреннее повышение САД уменьшилось на 41 %, ДАД — на 37 % (рис. 4). Полученные результаты свидетельствуют, что Лоприл является эффективным и безопасным антигипертензивным средством. При его применении отмечена положительная динамика практически всех показателей суточного мониторирования АД. Лоприл надежно контролировал как САД, так и ДАД, при этом более чем в 2 раза уменьшилась нагрузка давлением. Нормализовался циркадный ритм АД у больных с его исходным нарушением, нормальный суточный ритм АД не изменятся. Этот факт клинически значим, поскольку у пациентов с недостаточным снижением АД в ночные часы риск возникновения сердечно-сосудистых осложнений в несколько раз выше, чем у больных с нормальным профилем АД.
Наряду со снижением средних показателей АД Лоприл существенно уменьшал его вариабельность, особенно САД, которая до лечения значительно превышала норму. Отмечено выраженное уменьшение под влиянием Лоприла величины утреннего повышения АД и его скорости. Повышение АД в период с 6 до 12 часов является одним из основных факторов, формирующих «утренний всплеск» частоты возникновения инфаркта миокарда, мозгового инсульта, а также внезапной смерти.
По данным биохимического исследования крови не было выявлено существенного влияния Лоприла на показатели уровня глюкозы в крови, в то время как при анализе липидного спектра крови отмечена тенденция к снижению уровней общего холестерина, триглицеридов, что может быть связано с соблюдением гиполипидемической диеты и уменьшением массы тела пациентов.
За период наблюдения не отмечено повышения уровня азотемических показателей, трансаминаз, что свидетельствует об отсутствии токсического эффекта препарата.
В ходе проведенного наблюдения ни в одном из клинических случаев не было отмечено побочных эффектов терапии.
Таким образом, исследование клинической эффективности и переносимости препарата Лоприл демонстрирует существенное и продолжительное антигипертензивное действие, что позволяет применять его 1 раз в сутки в дозе 5–15 мг, тем самым обеспечивая высокий комплайенс терапии. Хорошая переносимость и доступная цена препарата являются важным фактором, повышающим готовность больных к длительному антигипертензивному лечению. Исходя из особенностей фармакокинетики и фармакодинамики, Лоприл приоритетен при сочетании АГ с СД, у лиц с различной степенью выраженности гепатоцеллюлярной недостаточности и хроническими заболеваниями гепатобилиарной системы. Метаболическая нейтральность позволяет рекомендовать Лоприл для лечения пациентов с проявлениями метаболического синдрома и ожирением (гидрофильное вещество).
Факторы риска
Гипертония и диабет 2 типа также имеют схожие факторы риска. К ним относятся:
- наличие избыточного веса и жировых отложений
- нездоровая диета
- малоподвижный образ жизни, стрессы и плохой сон
- курение
- пожилой возраст
- низкий уровень витамина D
Наличие в семейном анамнезе гипертонии увеличивает риск развития гипертонии, в то время как семейный анамнез диабета увеличивает риск развития диабета, особенно 2 типа.
Наличие гипертонии увеличивает риск развития диабета 2 типа, а наличие диабета 2 типа увеличивает риск развития гипертонии. Кроме того, наличие одного или обоих состояний увеличивает риск различных осложнений, в том числе таких как:
- сердечный приступ или инсульт
- снижение функции почек, прогрессируя до проблем с диализом
- повреждение кровеносных сосудов в глазах, что приводит к потере зрения
- заболевание периферических сосудов
Другие факторы, повышающие риск развития гипертонии, включают:
- диета с высоким содержанием жиров или натрия
- высокое потребление алкоголя
- низкий уровень калия
- другие хронические заболевания, такие как апноэ во сне, заболевания почек или воспалительный артрит
Выбор здорового образа жизни с раннего возраста может предотвратить как диабет 2 типа, так и гипертонию. Люди с диабетом могут снизить риск высокого кровяного давления и сердечно-сосудистых заболеваний, контролируя уровень сахара в крови.
Может ли диабет вызвать гипертонию?
У человека с диабетом либо недостаточно инсулина для переработки глюкозы, либо его инсулин работает неэффективно. Инсулин — это гормон, который позволяет организму перерабатывать глюкозу из пищи и использовать ее в качестве энергии. В результате этого глюкоза не может проникать в клетки для обеспечения энергией, и вместо этого она накапливается в кровотоке. Поскольку кровь с высоким уровнем глюкозы циркулирует по организму, она может нанести серьезный вред, в том числе кровеносным сосудам и почкам. Эти органы играют ключевую роль в поддержании здорового кровяного давления. Если они будут повреждены, кровяное давление может повыситься, увеличивая риск дальнейшего вреда и осложнений.
Профилактика
Факторы образа жизни имеют решающее значение для управления как уровнем глюкозы в крови, так и артериальным давлением.
Здоровый вес
Для людей с избыточным весом даже небольшое снижение веса может снизить риск как высокого артериального давления, так и диабета. Если человек теряет 3-5% от своего веса, это может улучшить показатели артериального давления. Снижение 5-7% тела может предотвратить переход преддиабета в диабет. Это соответствует 4 – 5 кг для человека, который весит более 80 кг.
Активность
Регулярная физическая активность может снизить кровяное давление и помочь контролировать уровень сахара в крови, а также принести много других преимуществ для здоровья. Врачи рекомендуют всем выполнять не менее 150 минут аэробных упражнений умеренной интенсивности каждую неделю или 75 минут интенсивных упражнений. Умеренные физические нагрузки включают ходьбу и плавание.
Диагностика диабета
Не все люди с диабетом имеют симптомы. Если симптомы высокого уровня сахара в крови действительно появляются, то они следующие:
- чрезмерная жажда
- частые позывы к мочеиспусканию
- учащенное ночное мочеиспускание
- слабость и усталость
- затуманенное зрение
Человек также может заметить, что чаще имеет инфекционные заболевания, включая инфекции мочевыводящих путей, молочницу и инфекции верхних дыхательных путей. Люди также могут заметить, что раны и инфекции заживают дольше.
Анализы покажут, что у человека высокий уровень сахара в моче и крови. Уровень глюкозы после голодания в течение 8 часов может быть:
- Норма
: менее 100 миллиграммов на децилитр (мг/дл) - Преддиабет
: между 100-125 мг/дл - Диабет
: показатель 126 мг/дл или выше
Разновидности диабета
Существует три вида диабета, каждый из которых имеет разные причины:
Диабет 1 типа
, как правило, проявляется в детстве или подростковом возрасте, но может проявиться и позже. Симптомы могут проявляться относительно внезапно или в течение нескольких недель. Диабет тип 1 возникает, когда иммунная система атакует клетки поджелудочной железы, вырабатывающие инсулин. Нет никакого способа избежать диабета 1 типа.
Развитие диабета 2 типа
может занять годы, и большинство людей не замечают симптомов. Обычно человек узнает, что у него преддиабет и диабет 2 типа, когда проходит обследование или возникают осложнения, такие как невропатия или проблемы с почками.
Врачи рекомендуют проводить скрининг всем лицам старше 45 лет, если у них имеются факторы риска, такие как ожирение. Эта мера предосторожности связана с тем, что у человека с ранним диагнозом больше шансов замедлить прогрессирование заболевания и избежать осложнений. Один из способов сделать это — придерживаться образа жизни, который врачи рекомендуют при гипертонии.
Гестационный диабет
возникает только во время беременности, но может увеличить риск развития диабета 2 типа в более позднем возрасте. Если обычный скрининг показывает высокий уровень сахара в крови во время беременности, врач будет следить за состоянием женщины до родов. Он будут продолжать делать это в течение нескольких недель после родов, но уровень сахара в крови обычно падает. Гестационный диабет может привести к различным осложнениям, включая преэклампсию, основным симптомом которой является очень высокое артериальное давление.