Среди заболеваний билиарного тракта первое место принадлежит дискинетическим расстройствам.
Под дисфункциями желчевыводящих путей (ранее их называли дискинезиями) подразумеваются нарушения моторно-эвакуаторной функции желчного пузыря, протоков, а также нарушение тонуса сфинктера Одди. Эти изменения приводят к нарушению процесса образования и выделения желчи, а в дальнейшем – и к её застою. Дисфункции билиарного тракта – это функциональные расстройства длительностью более 3-х месяцев. Они могут носить периодический, кратковременный или затяжной характер, проявляясь в виде болей в правом подреберье.
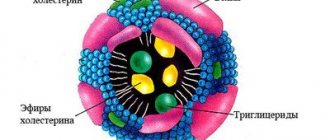
Желчь выполняет важную роль в процессе пищеварения. Она нужна для “размыления“ жиров до состояния эмульсии. Затем она в кишечнике обрабатывается ферментами, расщепляется и всасывается. Желчь представляет собой водяной раствор, состоящий на 70% из солей желчных кислот (холевая и хенодиоксихолевая), на 22% – из фосфолипидов (лецитина), на 4% – из холестерина, на 3% – из белка и на 0,3% – из билирубина. При недостаточном количестве желчных кислот – лецитина и холестерина – появляется нерастворимый холестерин, и желчь становится литогенной. При застойных явлениях в билиарном тракте происходят изменения состава желчи, развивается воспалительный процесс и появляется осадок в желчи – билиарный сладж, что в дальнейшем может привести к образованию конкрементов.
Причины дисфункции билиарного тракта
Первичная дискинезия желчевыводящих путей может возникнуть у детей из-за: несогласованной работы симпатической и парасимпатической нервной системы: снижается тонус сфинктера Одди и желчного пузыря. Также различные стрессы, неправильный режим питания или погрешности в еде (употребления большого количества жирной пищи, переедание или нерегулярный прием пищи) приводят к тому, что нервно-мышечный аппарат желчного пузыря становится раздражённым и плохо сокращается.
Вторичная дискинезия желчевыводящих путей появляется из-за: хронических болезней пищеварительной системы, глистной инвазии; врождённых пороков развития желчевыводящих путей; эндокринных нарушений, воспалительных заболеваний пищеварительной системы.
Симптомы дисфункции билиарного тракта
Клинические проявления дисфункциональных расстройств билиарного тракта достаточно широки и могут носить неспецифический характер. Жалобы многосимптомны, как правило, связаны с психосоциальными факторами. Их можно условно разделить на три группы.
Абдоминальные боли
Для гипертонической формы дисфункции желчного пузыря характерны острые приступообразные, колющие, сжимающие кратковременные боли в правом подреберье или вокруг пупка, сопровождающиеся, как правило, тошнотой, отрыжкой или даже рвотой, но без подъема температуры.
Для гипотонической формы характерны ноющие, давящие, тупые боли, приобретающие постоянный характер и связанные с приемом пищи, физической нагрузкой или эмоциональным напряжением. Отмечается горечь во рту, тошнота.
Для спазма сфинктера Одди в сочетании со сниженным тонусом желчного пузыря характерны тупые, ноющие боли в животе. При недостаточности сфинктера Одди, характерны ранние боли после приема жирной пищи, они могут быть и острыми и ноющими, в сочетании с проявлениями диспепсии.
Диспептические расстройства
Наблюдаются тошнота, рвота, отрыжка, изжога, горечь во рту, чувство тяжести в эпигастрии, изменение характера и частоты стула. Все это связано с несвоевременным выделением желчи в двенадцатиперстную кишку и нарушением переваривания жиров, с дуоденогастральным и гастроэзофагальными рефлюксами.
Неврологические и вегетативные нарушения
Головная боль, чувство кома в горле, потливость, сонливость, быстрая утомляемость, кардиалгия, похолодание конечностей, изменение поведения, тревожность, истерия, снижение способности к обучению и работоспособности.
Методы диагностики дисфункции билиарного тракта
Обилие и многообразие симптомов дисфункциональных расстройств билиарного тракта вызывает затруднения в постановке диагноза, что требует дополнительного обследования.
Скрининговые методы диагностики
К скриниговым методам диагностики относятся: биохимические исследования сыворотки крови, УЗИ органов брюшной полости и ЭГДС.
Уточняющие методы
Для уточнения диагноза используются УЗИ с определением функции желчного пузыря и сфинктера Одди, динамическая холесцинтиграфия, ЭРХПГ.
Записаться на диагностику Чтобы точно продиагностировать заболевание, запишитесь на прием к специалистам сети «Семейный доктор».
Почему развивается болезнь
Признаки заболевания могут развиться у пациента любого возраста и пола, но более предрасположены к проявлению патологии женщины. Предрасполагающими факторами могут стать психоэмоциональные перегрузки, заболевания эндокринной системы, наследственность и прочие причины, но основными из них врачи считают следующие.
Доброкачественные и злокачественные новообразования. Независимо от этиологии опухоли, их формирование является препятствием для нормального оттока желчи из полости печени и пузыря, из-за чего возникают первые симптомы билиарной гипертензии. Новообразование может локализоваться в самом желчном протоке либо в соседних органах, из-за чего поражаются конкретные участки желчевыводящей системы. Наиболее распространенной причиной этого ряда считается раковая опухоль головки поджелудочной железы.
Оседание гельминтов и прочих видов паразитов в протоках желчного пузыря. Когда скопление паразитов мешает нормальному оттоку секрета, возникают симптомы, схожие с холециститом, что усложняет своевременную диагностику и подбор верного метода лечения. В действительности у пациента усугубляется желчная гипертензия токсическо-паразитарного характера, а терапия проводится против воспаления желчной системы.
Аномальное строение печеночных протоков. Из-за подобной проблемы нарушается отток желчного секрета по всем уровням системы. Протоки могут быть просто чересчур узкими или быть совершенно непроходимыми, и чем больше выражена аномалия, тем более экстренным должно быть оперативное вмешательство. Системные заболевания печени, желчного пузыря и их протоков. На их фоне формируются камни, полипы и развивается механическая желтуха одновременно с повышением уровня билиарного давления.
Также симптоматика заболевания может проявиться после тяжелой интоксикации печени, обструкции желчных путей и в результате хронического венозного застоя в печеночной системе. Зачастую начальные признаки билиарной гипертензии проявляются после длительного лечения определенными группами медикаментов – это антидепрессанты, бета-адреноблокаторы, гормональные препараты.
В большинстве случаев у организма человека достаточно собственных ресурсов, чтобы побороть начальную стадию заболевания. Но при наличии одного или нескольких факторов, перечисленных выше, этих возможностей становится недостаточно, из-за чего симптоматика болезни становится все более выраженной.
Нет рекламы 2
Методы лечения дисфункции билиарного тракта
Лечение дисфункциональных расстройств билиарного тракта должно быть комплексным и направлено на нормализацию оттока жёлчи и секреции поджелудочной железы. Для этого необходимо нормализовать режим и характер питания. Пища является стимулятором сокращения желчного пузыря, поэтому питание должно быть дробным, до 5 раз в день, небольшими порциями, при этом прием пищи желательно проводить в одно и то же время. Рацион должен быть выстроен так, чтобы на первую половину дня приходилось 55-60% от его суммарной калорийности. Из рациона исключаются: газированные напитки, наваристые бульоны, жирные сорта мяса, копчености, острые, жареные и консервированные продукты, концентраты. Рекомендуется свежеприготовленная пища в тёплом отварном, паровом или тушенном виде. Лечебное питание назначается не менее чем на 1 год, а при сохранении длительно болевого синдрома – до 1,5-2 лет.
Особая роль в лечении дискинезий билиарной системы принадлежит желчегонным средствам, которые условно подразделяются на:
- холеретики, стимулирующие образование желчи за счет усиления функциональной активности гепатоцитов. Это препараты, содержащие желчь: аллохол, холензим, лиобил; синтетические препараты: никодин, оксафеномид, циквалон; препараты растительного происхождения: экстракт кукурузных рылец, экстракт расторопши, артишок, дымянки, фламин, холагол, хофитол, холосас, гепабене, и др.
- холекинетики, стимулирующие желчевыделение, вызывающие повышение тонуса желчного пузыря, снижение тонуса желчных путей и способствующие усиленному поступлению желчи в ДПК: сульфат магния, сорбит, ксилит.
Для купирования болевого синдрома применяют миотропные спазмолититки (галидор, дротаверин, баралгин, мебеверин, и др). Могут назначаться также холелитические средства (производные деоксихолевой кислоты), нормализующие выработку холестерина, и гепатопротективные средства, обладающие комплексным действием на гепатобилиарную систему (спазмолитическое, противовоспалительное и холеретическое).
Для улучшение оттока желчи хорошо проводить дюбажи по Демьянову (слепое зондирование), с сульфатом магния (0,2-0,4 г/кг), минеральной водой «Донатом магния», 1-2 раза в неделю (на курс до 4-8 процедур).
Достаточно часто дисфункции билиарного тракта являются следствием невроза. С этой целью показана вегетотропная терапия. Предпочтение отдается лекарствам растительного происхождения:
- седативные препараты: корень валерианы, бром, пустырник, шалфей.
- тонизирующие препараты: экстракт элеутерококка, настойка аралии, китайского лимонника, свежезаваренный чай и пр.
Профилактика
Профилактика дисфункциональных расстройства билиарного тракта заключается в назначении рационального питания, соблюдении режима питания, исключении стрессов, санации вторичных очагов инфекции, назначении дозированных физических нагрузок.
Диспансерное наблюдение
За детьми с дисфункциями билиарного тракта сроком на 2 года устанавливается диспансерное наблюдение. Ребёнок должен проходить профилактические курсы терапии в весенне-осенние периоды и в период ремиссии: фитотерапию, водолечение и бальнеолечение.
Записаться на прием Не занимайтесь самолечением. Обратитесь к нашим специалистам, которые правильно поставят диагноз и назначат лечение.
Оцените, насколько был полезен материал
Спасибо за оценку
Билиарный панкреатит
Термином «хронический панкреатит» (ХП) обозначают группу хронических заболеваний поджелудочной железы (ПЖ) различной этиологии, преимущественно воспалительной природы, с фазово–прогрессирующими очаговыми, сегментарными или диффузными дегенеративными или деструктивными изменениями ее экзокринной ткани, атрофией железистых элементов (панкреоцитов) и замещением их соединительной (фиброзной) тканью; изменениями в протоковой системе ПЖ с образованием кист и конкрементов, с различной степенью нарушения экзокринной и эндокринной функций [1]. Во всем мире за последние 30 лет наблюдается увеличение заболеваемости острым и хроническим панкреатитом более чем в 2 раза. В России отмечен более интенсивный рост заболеваемости ХП. Так, распространенность заболеваний ПЖ среди взрослых за последние 10 лет увеличилась в 3 раза, а среди подростков – более чем в 4 раза [2]. Билиарная патология – наиболее частая причина развития острого и обострения хронического панкреатита. Одной из причин формирования билиарного (билиарнозависимого) панкреатита (БП) является желчнокаменная болезнь (ЖКБ). Частота выявления панкреатита у больных ЖКБ, по разным оценкам, составляет 25–90% и более. Причины формирования билиарного панкреатита Причинно–следственные взаимоотношения между ЖКБ и панкреатитом общеизвестны. Главными механизмами формирования БП являются заброс и задержка желчи в протоках ПЖ, она взаимодействует с панкреатическими ферментами и бактериями. В связи с этим происходят высвобождение связанных желчных кислот, активация панкреатических ферментов в протоковой системе ПЖ. В результате этого повреждается ее защитный барьер, поражается паренхима ПЖ аналогично патологическим процессам, развивающимся при панкреато–билиарных рефлюксах и сопровождающимся формированием ферментативного холецистита [3]. Как известно, препятствием для развития билиарно–панкреатического рефлюкса является более высокое секреторное давление в главном панкреатическом протоке по сравнению с общим желчным протоком. Поэтому пусковым механизмом развития БП является повышение давления в протоковой системе желчных путей, которое может быть обусловлено как функциональной (диссинергизм в работе сфинктерного аппарата дистальных отделов желчных путей и главного панкреатического протока, гипертонус сфинктера Одди), так и органической патологией (мелкие конкременты, сгустки замазкообразной желчи, стриктуры в терминальном отделе общего желчного протока, высокое панкреато–билиарное соустье, стенозирующий папиллит и др.), часто сопровождающей течение ЖКБ. Следует отметить, что билиарные дисфункции и, в частности, дисфункции сфинктера Одди являются неотъемлемым атрибутом ЖКБ. Функциональные нарушения при дисфункции сфинктера Одди способствуют развитию билиарно–панкреатического рефлюкса в результате разницы давления в общем желчном и панкреатическом протоках. Даже при небольшой билиарной гипертензии сфинктер главного панкреатического протока не способен предохранить протоковую систему ПЖ от патологического рефлюкса [4]. При ЖКБ билиарный сладж либо конкременты из желчного пузыря или общего желчного протока, попадая в ампулу фатерова сосочка, также могут быть причиной развития БП в связи с созданием препятствия для оттока желчи и панкреатического секрета. Характер клинических проявлений и степень функциональных нарушений со стороны ПЖ при этом могут существенно различаться. В случае быстрого прохождения камня в двенадцатиперстную кишку (ДПК) воспалительные явления в ПЖ достаточно быстро стихают. При ущемлении конкремента в ампуле большого дуоденального сосочка признаки обострения панкреатита нарастают. Развивающийся вокруг камня спазм гладкой мускулатуры усугубляет степень билиарной гипертензии и, как следствие, течение панкреатита. Нередко в таких случаях появляются признаки механической желтухи – за счет нарушения проходимости вследствие обтурации камнем протоковой системы и сдавления общего желчного протока увеличенной головкой ПЖ. В последние годы все большее значение в развитии БП придают билиарному сладжу (БС). В результате дестабилизации физико–химического состояния желчи происходят преципитация ее основных компонентов и формирование БС в желчном пузыре. Важными факторами, способствующими персистенции БС, являются гипотония желчного пузыря и гипертонус сфинктера Одди. Постоянный пассаж БС по желчным путям приводит к повреждению слизистой оболочки, главным образом в области сфинктера Одди. Травматизация слизистой оболочки происходит микролитами, составляющими основную часть БС. В результате этого вначале развивается вторичная дисфункция сфинктера Одди, а в последующем формируется стенозирующий папиллит. Благоприятные условия для возникновения билиарно–панкреатического рефлюкса при дисфункции сфинктера Одди возникают при высоком соединении общего желчного и панкреатического протоков или аномалиях их слияния [4]. Риск возникновения панкреатита значительно выше у пациентов с длинным и широким общим желчным протоком, диаметром дистального отдела главного панкреатического протока более 2,5 мм, а также при наличии кист в общем желчном протоке. Учитывая тесную связь между БС и развитием острого панкреатита, в настоящее время принято считать, что диагноз идиопатического панкреатита может быть поставлен только после исключения микролитиаза в билиарном тракте [5]. Частота выявления БС у больных с так называемым идиопатическим панкреатитом составляет 30–75%. При исследовании желчи в течение первых суток от начала панкреатической атаки частота обнаружения БС достигает 80% [6]. Рецидивам БП способствует не только миграция мелких камней и БС по общему желчному протоку, но и обострение заболеваний гастродуоденальной зоны, часто сопутствующих ЖКБ. Так, частота сочетания ЖКБ и эрозивно–язвенных поражений гастродуоденальной зоны, по нашим данным, достигает 25–27%. В этих ситуациях гиперацидность желудочного сока, обусловленная гипергастринемией, является чрезмерным стимулом для ПЖ, что в условиях затрудненного оттока ее секрета приводит к внутрипротоковой гипертензии и обострению патологического процесса [7,8]. Особенностью БП, отличающего его от других форм панкреатита, является сочетание экзокринной недостаточности ПЖ с хронической билиарной недостаточностью, что отражается на качестве пищеварительного процесса. Клиника Клиническая картина требует в первую очередь исключения синдромосходных заболеваний, таких как гастродуоденальные язвы, карциномы желудка и ободочной кишки, хронический антральный гастрит, хроническая артериомезентериальная компрессия, острый вирусный гепатит и обострение хронического вирусного гепатита, обострение хронического холецистита, опухоль ПЖ, которая может вызывать острый панкреатит и поддерживать течение ХП на неопределенный период, и др. В этой связи необходимы обследование больных для исключения перечисленных заболеваний и воздействие на них как на фактор, поддерживающий течение ХП [1]. Клинические проявления БП включают в себя абдоминальный болевой синдром, симптомы внешнесекреторной и инкреторной недостаточности ПЖ, билиарной недостаточности. Болевой синдром является доминирующим в клинической картине заболевания в 80–90% случаев. Клинические признаки обострения БП характеризуются появлением болей в эпигастрии с иррадиацией в спину, правое или левое подреберье. Боли могут быть связаны с перееданием, приемом острой, жирной, жареной пищи, появляются обычно через 1,5–2 ч после еды или возникают спонтанно ночью. Реже боли возникают сразу после приема пищи, особенно холодных шипучих напитков и, как правило, связаны со спазмом сфинктера Одди. В период приступа возможна умеренная лихорадка. Из диспепсических расстройств наиболее часто встречаются тошнота, рвота, а также горечь во рту. Выраженная клиника острого панкреатита развивается при ущемлении конкремента в ампуле большого дуоденального сосочка с нарушением оттока панкреатического секрета и присоединением клинических симптомов механической желтухи. Диагностика Диагностика носит комплексный характер и включает в себя анализ жалоб, данных анамнеза, объективный осмотр, лабораторные и инструментальные методы исследования. В клиническом анализе крови выявляют лейкоцитоз, при биохимическом исследовании отмечаются изменение функциональных проб печени (повышение активности трансаминаз, ЩФ, ГГТП), а также повышение уровня сывороточной амилазы и липазы. Следует отметить, что изменения печеночных функциональных тестов при БП более выражены, чем при панкреатите алкогольной или другой этиологии [9]. Наиболее ранним проявлением внешнесекреторной недостаточности ПЖ является наличие эластазы в кале в сочетании со стеатореей, нейтральным жиром и мылами. Основным инструментальным методом диагностики является УЗИ. При трансабдоминальной ультрасонографии (ТУС) выявляют конкременты и/или различные варианты БС в желчном пузыре и общем желчном протоке. Следует отметить, что чувствительность и специфичность ТУС в выявлении патологии общего желчного протока не превышают 60%. В случаях плохой визуализации общего желчного протока при ТУС (выраженный метеоризм, тучность больного и др.) применяют эндоскопическую ультрасонографию (ЭУС). Общий желчный проток может быть нормальных размеров, расширение его происходит при ущемлении камня в терминальном отделе или ампуле большого дуоденального сосочка. Вирсунгов проток нормальных размеров или умеренно расширен. Изменения в паренхиме ПЖ зависят от стадии процесса. На ранних этапах изменений в ПЖ выявить не удается. В дальнейшем при УЗИ определяются неоднородность ее структуры, неровность контуров. При обострении панкреатита выявляются ультразвуковые признаки отека ПЖ. Для определения проходимости желчных путей показана динамическая холесцинтиграфия, которая позволяет проследить весь процесс перераспределения желчи в билиарной системе, время поступления ее в ДПК, а также дать оценку функционального состояния печени [10]. Эндоскопическая ретроградная холангиопанкреатография (ЭРХПГ) позволяет выявить патологические изменения в большом дуоденальном сосочке, общем желчном и панкреатическом протоках. При необходимости во время исследования одновременно выполняется папиллотомия или папиллосфинктеротомия. ЭРХПГ неэффективна при наличии конкрементов в общем желчном протоке менее 5 мм в диаметре, замазкообразной желчи. У 1/3 пациентов исследование может вызвать ЭРХПГ–индуцированный панкреатит [11], поэтому у больных с подозрением на БП данное исследование должно применяться с большой осторожностью, с диагностическими целями чаще следует использовать ЭУС. При наличии стенозирующего папиллита или билиарных стриктур во время ЭРХПГ восстанавливают желчеотток с помощью сфинктеротомии или стентирования. Эндоскопическое дренирование с помощью стентов дает хорошие ближайшие результаты, однако у пациентов с кальцификатами головки ПЖ эффективность его в 17 раз ниже [12]. В последнее время в клиническую практику внедряется магнитно–резонансная холангиопанкреатикография, позволяющая одновременно оценить состояние желчных и панкреатического протоков. При эзофагогастродуоденоскопии (ЭГДС) оцениваются изменения со стороны слизистой оболочки верхнего отдела пищеварительного тракта, в особенности характер патологических изменений парафатериальной зоны и непосредственно большого дуоденального сосочка. Чрескожная чреспеченочная холангиография применяется в случаях неинформативности других методов визуализации и невозможности выполнения ЭРХПГ. Для подбора адекватной кислотосупрессивной терапии и определения продолжительности курса лечения показана компьютерная рН–метрия желудка. Лечение Важную роль в лечении больных БП играет диетотерапия. Строгое соблюдение диеты приводит к снижению функциональной нагрузки на желчный пузырь и сфинктерный аппарат желчных путей, создает условия для максимального функционального покоя ПЖ. При выраженном обострении в первые 3 дня пациенту назначается полный голод с употреблением щелочных минеральных вод без газа. В дальнейшем пациент переходит на диету № 5. Необходимо ограничение жиров до 60–70 г/сут., белка – до 100–110 г/сут. При тяжелых обострениях панкреатита, сопровождающихся рвотой, целесообразно прибегнуть к голоданию в течение 1–3 сут. и коррекции водно–электролитного баланса парентеральным введением раствора Рингера, глюкозы и др. После уменьшения болей и прекращения рвоты возвращаются к пероральному питанию, которое должно быть не менее 5–6 раз/сут. Медикаментозная терапия не отличается от лечения других форм панкреатита и должна преследовать следующие цели [13]: • купирование боли, уменьшение и снятие интоксикации, которая переводит процесс из локально–органного в мультиорганный – распространенный; • купирование прогрессирования отечно–интерстициальной стадии панкреатита с целью предотвращения развития «хирургических» осложнений при неосложненном и ограниченном неинфицированном панкреонекрозе; • стабилизация клинической ситуации, которая достигается созданием функционального покоя ПЖ с постепенным переходом к функциональным нагрузкам; • лечение осложнений острого периода – несостоятельности внешне– и внутрисекреторной недостаточности функций ПЖ; • лечение хирургических осложнений и предотвращение рецидивирования при сохраняющемся причинном факторе; • реабилитация больных ХП. Основной причиной боли при БП является гипертензия в протоковой системе ПЖ. При этом боль может быть купирована мероприятиями, направленными на снижение давления в протоках и уменьшение отека и воспалительной инфильтрации ПЖ, без применения анальгетиков. Для подавления секреции ПЖ назначают ранитидин, фамотидин, омепразол, октреотид. Лечение целесообразно начинать с октреотида по 100 мгк 3 раза/сут. подкожно. Средний курс лечения составляет 5 дней. При недостаточном клиническом эффекте суточную дозу препарата увеличивают до 600 мкг (по 200 мкг через каждые 8 ч). Синтетические аналоги октреотида подавляют экзокринную функцию ПЖ, секрецию гастрина, соляной кислоты, секретина и других биологически активных веществ гастропанкреатической системы. Продолжительность курса лечения определяют в зависимости от распространенности патологического процесса, вовлечения клетчатки забрюшинного пространства, тяжести состояния больного. Одновременно больным показано назначение блокаторов желудочной секреции (Н2–блокаторы гистаминовых рецепторов, ингибиторы протонной помпы) парентерально 3–5 дней, затем per os до восстановления структурно–функциональной активности ПЖ, в общей сложности – 3–4 мес. Показаны антациды с высокой кислото–нейтрализующей активностью через каждые 2–3 ч. Однако следует учитывать, что применение антацидов в высоких дозах уменьшает биодоступность целого ряда препаратов, например, снижается абсорбция антибиотиков группы тетрациклина, блокаторов гистаминовых Н2–рецепторов и других препаратов, с которыми антациды образуют нерастворимые соединения. Уменьшают тяжесть течения панкреатита низкомолекулярные гепарины, гепариноиды, реополиглюкин и др. Эффект обусловлен улучшением микроциркуляции, а в 70% случаев – и рассасыванием микротромбов. Следует иметь в виду и тот факт, что билиарная гипертензия и воспаление уменьшают доставку лекарственных средств в патологический очаг. В связи с этим гепаринизация низкомолекулярными гепаринами за счет улучшения микроциркуляции повышает эффективность лекарственной терапии. Для купирования болей применяют дротаверин, папаверин, платифиллин и др. Хорошо зарекомендовал себя как средство для снятия болей парацетамол. Однако максимальная доза парацетамола не должна превышать 4 г/сут. Из ненаркотических анальгетиков применяют трамадол по 1–2 ампулы (по 50 мг) внутримышечно или внутривенно (медленно) или по 1–2 капсулы (по 50 мг) внутрь 1–3 раза/сут. Используют также бупренорфин в дозе 300 мкг в ампуле и 200 мкг в таблетке. При выраженной и резистентной боли назначают наркотические анальгетики: 1 мл 1–2% раствора промедола подкожно или внутримышечно 1–3 раза/сут., обычно в течение не более 3 дней. Последние исследования показали, что при дисфункции сфинктера Одди и дискинетических расстройствах кишечника, вносящих свою лепту в формирование болевого абдоминального синдрома при ХП, хороший эффект оказывает селективный миотропный спазмолитик мебеверин (Дюспаталин). По показаниям назначают полиглюкин 400 мл/сут., гемодез 300 мл/сут., 10% раствор альбумина 100 мл/сут., 5–10% раствор глюкозы 500 мл/сут. с адекватным количеством инсулина внутривенно. При тяжелых атаках необходимы коррекция гемодинамических нарушений, борьба с эндотоксикозом. Для создания длительного функционального покоя ПЖ целесообразно в течение 3 мес. продолжать прием ингибиторов желудочной секреции. При этом препаратами выбора являются блокаторы протонной помпы, которые максимально и на длительный срок подавляют продукцию соляной кислоты, что приводит к снижению синтеза холецистокинина–панкреозимина и секретина, обеспечивая тем самым необходимый функциональный покой ПЖ. По последним данным, у больных после холецистэктомии для купирования обострения билиарнозависимого панкреатита рекомендуется длительная (на протяжении 48 нед.) кислотосупрессивная терапия эзомепразолом – 40 мг/сут. [14]. При наличии БС показана литолитическая терапия препаратами урсодеоксихолевой кислоты. Дозу подбирают в зависимости от массы тела, курс лечения – до 3 мес. Диету расширяют постепенно, «под прикрытием» ферментных препаратов, которые играют важную роль в терапии БП. Одним из патогенетических обоснований применения заместительной ферментной терапии при ХП является установленный факт, свидетельствующий о том, что у больных ХП сниженная секреция панкреатических ферментов при внешнесекреторной недостаточности является причиной гиперстимуляции ПЖ высокими уровнями холецистокинина–панкреозимина в плазме крови и, как следствие, способствует усилению болевого абдоминального синдрома. Терапия ферментными препаратами при ХП имеет большую историю. За это время апробировано множество различных по фармацевтической форме и составу ферментных препаратов, что позволило сформулировать наиболее важные требования к ним [15]: • иметь оптимальный состав ферментов в физиологической пропорции; • быть кислотоустойчивым в отношении желудочного сока; • равномерно и быстро перемешиваться с пищей; • одновременно с пищей поступать через привратник в ДПК; • оказывать оптимальное действие в интервале рН 4–7; • быстро и полно высвобождать ферменты в ДПК; • не оказывать побочных эффектов. Одним из факторов, снижающих эффективность заместительной ферментной терапии, является асинхронное поступление из желудка пищевого комка и ферментных препаратов в виде драже или таблеток в кишечнорастворимых оболочках, размер которых составляет 5 мм и более. Экспериментальными исследованиями установлено, что лучше перемешиваются с пищей в желудке и одновременно покидают его частицы диаметром 1–1,5 мм, т.е. эффективность ферментного препарата определяется не только содержанием ферментов в одной таблетке или капсуле, но и его лекарственной формой. Изложенным требованиям наиболее полно отвечает Креон. По данным многочисленных международных исследований, двухоболочечный препарат Креон обладает свойством осуществлять пассаж вместе с пищей, так как капсулы, содержащие мини–микросферы, покрытые кишечнорастворимой оболочкой, быстро растворяются в желудке, высвобождая сотни мини–микросфер (от 280 до 500 частиц диаметром 1,0–1,2 мм), которые более равномерно распределяют ферменты после их высвобождения внутри кишечного содержимого. Когда мини–микросферы достигают ДПК, кишечнорастворимая оболочка разрушается, происходит высвобождение ферментов с липолитической, амилолитической и протеолитической активностью, приводящей к дезинтеграции жиров, крахмала и липидов. Таким образом, Креон благодаря особой лекарственной форме создает наиболее оптимальные условия для полостного пищеварения. Второе преимущество Креона перед другими ферментными препаратами заключается в его высокой ферментативной активности, что особенно важно при БП, течение которого сопровождается дефицитом желчных кислот, принимающих непосредственное участие в активации ферментов ПЖ. Ферментный состав Креона оптимально сбалансирован для замещения экзокринной недостаточности ПЖ. Как известно, при заместительной ферментной терапии главное значение имеет липазная активность препаратов. Поэтому при подборе ферментного препарата для заместительной терапии определяющим свойством является активность липазы. Это связано с тем, что при БП продукция и секреция липазы нарушаются раньше, чем у амилолитических и протеолитических ферментов; липаза быстрее и более выраженно инактивируется при закислении ДПК из–за снижения продукции панкреатических бикарбонатов; при снижении рН в ДПК происходит преципитация желчных кислот, что усугубляет нарушение всасывания жира [16]. Креон выпускается в различных вариантах: Креон 10000, Креон 25000 и Креон 40000, которые содержат 10000, 25000 и 40000 ЕД липазы соответственно, что позволяет индивидуально подбирать дозу препарата в зависимости от степени внешнесекреторной недостаточности ПЖ. Адекватно подобранные дозы Креона обеспечивают полноценное полостное пищеварение, что сопровождается уменьшением давления в ДПК и тем самым способствует улучшению оттока желчи и панкреатического секрета и уменьшению болей. Кроме того, Креон у больных БП, сопровождающимся панкреатической недостаточностью, уменьшает болевой синдром по типу обратной связи. Назначение ферментных препаратов для купирования боли считается ранним показанием, так как ферментная недостаточность проявляется только после длительного течения ХП (например, при длительном камненосительстве, особенно у лиц с множественными мелкими конкрементами в желчном пузыре), а боль возникает сразу. Антиболевой эффект Креона связан с высоким содержанием протеаз (трипсина) в составе ферментного препарата. Протеазы разрушают рилизингпептиды (холецистокинин–панкреозимин и секретин), высвобождающиеся в начальных отделах ДПК и стимулирующие панкреатическую секрецию. Таким образом, протеазы вызывают уменьшение панкреатической секреции и обеспечивают функциональный покой ПЖ. Креон обладает самой высокой активностью трипсина: Креон 10000 содержит 600 F. I. P. протеаз, Креон 25000 – 1000 F. I. P. протеаз. Последними исследованиями показано, что Креон способен подавлять воспалительный процесс в ПЖ. Это подтверждается снижением в крови уровня провоспалительных (IL–8, TNFα) и повышением уровня противовоспалительных (IL–10) цитокинов, а также снижением показателей TGF–β, отражающего процессы фиброгенеза. Длительный прием Креона достигает не только заместительной цели, но и замедляет прогрессирование развития соединительной ткани в паренхиме ПЖ при БП [17]. Подбор доз панкреатических ферментов проводится индивидуально. При тяжелой степени панкреатической недостаточности рекомендуется принимать во время основного приема пищи препарат с содержанием липазы не менее 25 000–40 000 ЕД, в промежуточные приемы пищи – дополнительно 10 000– 5 000 ЕД [18]. Креон обладает высоким индексом безопасности, что позволяет применять его в педиатрической практике, в том числе у детей грудного возраста. Препарат разрешен к применению у лиц, исповедующих ислам. Таким образом, многочисленные наблюдения демонстрируют разнообразные клинические эффекты Креона, что позволяет считать его «золотым стандартом» при лечении больных БП. Для профилактики холангита и абсцессов ПЖ применяют антибиотики широкого спектра действия. Кроме того, антибактериальная терапия способствует восстановлению нарушенного при ЖКБ кишечного микробиоценоза, а также препятствует обострению хронического калькулезного холецистита. Показаны ципрофлоксацин, имипенем, цефуроксим, цефотаксим и др. Ограничением для применения цефтриаксона является образование БС при его приеме. Следует учитывать, что ряд антибактериальных препаратов токсически действуют на ацинарные клетки ПЖ (тетрациклин, рифампицин, изониазид, амфотерицин). У пациентов с ЖКБ, а также после холецистэктомии выявляется синдром избыточного бактериального роста (СИБР) в тонкой кишке. По нашим данным, в группе больных, перенесших холецистэктомию, СИБР выявлен в 58%, а среди пациентов с ЖКБ – в 28% случаев. Полученные результаты можно объяснить тем, что после холецистэктомии снижаются концентрация желчных кислот в желчи и ее бактерицидные свойства [19]. По данным А.И. Пастухова, у больных с хроническим билиарнозависимым панкреатитом после холецистэктомии СИБР выявлялся в 33% случаев [14]. Наши исследования показывают, что наилучшим клиническим эффектом в этих ситуациях обладает рифаксимин в суточной дозе 800–1200 мг, продолжительность приема – 7 дней. Доза и длительность антибактериальной терапии определяются тяжестью состояния больного, лабораторными показателями и данными инструментальных методов исследования. При дисфункции сфинктерного аппарата желчных путей показаны гимекромон или мебеверин в обычных дозировках (курс лечения – 2–4 нед.); при наличии холедохолитиаза – баллонная дилатация, папиллосфинктеротомия с извлечением камней. Восстановление оттока желчи и панкреатического сока – одно из главных и непременных условий при терапии БП. С целью профилактики БП необходимо проведение адекватной терапии ЖКБ на ранних стадиях, а на стадии калькулезного холецистита – своевременной холецистэктомии. Литература 1. Минушкин О.Н. Хронический панкреатит: некоторые аспекты патогенеза, диагностики и лечения // Consilium Medicum. 2002. Т. 4. № 1. С. 23–26. 2. Маев И.В., Казюлин А.Н., Кучерявый Ю.А. и др. Некоторые вопросы эпидемиологии хронического панкреатита // Клинико–эпидемиологические и этно–экологические проблемы заболеваний органов пищеварения: Материалы III Восточно–Сибирской гастроэнтерологической конференции / Под ред. проф. В.В. Цуканова. Красноярск, 2003. С. 9–52. 3. Ильченко А.А. Ферментативный холецистит // Экспериментальная и клиническая гастроэнтерология. 2009. № 7. С. 70–73. 4. Ильченко А.А. Болезни желчного пузыря и желчных путей: Рук–во для врачей. 2–е изд., перераб. и доп. М.: ООО «Издательство «Медицинское информационное агентство», 2011. 880 с. 5. Сhebli J.M., Ferrari Junior A.P., Silva M.R. et al. Biliary microcristals in idiopathicacute pancreatitis: clue for occult underlying biliary etiology // Arg. Gastroenterol. 2002. Apr–Jun. Vol. 37 (2). Р. 93–101. 6. Ильченко А.А. Диагностика билиарного сладжа в практике врача–терапевта поликлиники. Справочник поликлинического врача. 2009. № 10. С. 59–63. 7. Селезнева Э.Я., Ильченко А.А. Клинические особенности течения желчнокаменной болезни, сочетающейся с язвенной болезнью двенадцатиперстной кишки и патогенетические особенности их развития // Экспериментальная и клиническая гастроэнтерология. 2011. № 4. С. 31–36. 8. Селезнева Э.Я., Ильченко А.А. Желчнокаменная болезнь, сочетающаяся с язвенной болезнью двенадцатиперстной кишки. Обзор литературы // Экспериментальная и клиническая гастроэнтерология. 2008. № 2. С. 48–55. 9. Болезни печени и желчных путей. Рук–во для врачей / Под. ред. В.Т. Ивашкина. М.: ООО «Издательский дом «М–Вести», 2002. 416 с. 10. Ильченко А.А., Шибаева Л.О., Ходарев Н.Н. и др. Значение динамической холесцинтиграфии при желчнокаменной болезни // Российский гастроэнтерологический журнал. 2000. № 2. C. 13–20. 11. Ильченко А.А. Эндоскопическая ретроградная холангиопанкреатикография: возможна ли эффективная профилактика ЭРХПГ–индуцированного панкреатита? // Экспериментальная и клиническая гастроэнтерология. 2008. № 3. С. 62–71. 12. Khal S., Zimmermann S., Genz I. et al. Risk factors for failure of endoscopic stenting of biliary strictures in chronic pancreatitis: a prospective follow–up study // Am. J. Gastroenterol. 2003. Vol. 98. P. 2448–2453. 13. Минушкин О.Н. Хронический панкреатит: вопросы патогенеза, диагностики и лечения // Трудный пациент. 2003. Т. 1. № 3. С. 26–30. 14. Пастухов А.И. Результаты комплексного лечения хронического билиарнозависимого панкреатита после холецистэктомии: Автореф. дисс. … канд. мед. наук. М., 2010. 23 с. 15. Ильченко А.А. Билиарный панкреатит // Экспериментальная и клиническая гастроэнтерология. 2005. № 5. С. 10–16. 16. Маев И.В. Болезни двенадцатиперстной кишки / И.В. Маев, А.А. Самсонов. М.: МЕДпресс, 2005. 511 с. 17. Маев И.В., Кучерявый Ю.А. Болезни поджелудочной железы. В 2 т. Т. 2. / И.В. Маев, Ю.А. Кучерявый. М.: Медицина, 2008. 558 с. 18. Рекомендации Научного общества гастроэнтерологов России по диагностике и лечению хронического панкреатита // Экспериментальная и клиническая гастроэнтерология. 2011. № 7. С. 122–129. 19. Мечетина Т.А., Ильченко А.А. Эффективность рифаксимина (Альфа Нормикса) при синдроме избыточного бактериального роста у больных после холецистэктомии // Экспериментальная и клиническая гастроэнтерология. 2010. № 4. С. 100–104.