Открытый общий атрио-вентрикулярный канал
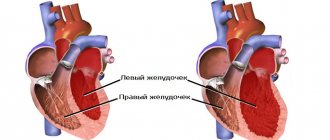
Анатомически этот порок — отсутствие участка перегородок, разделяющих правое и левое предсердия в их нижнем отделе, а желудочки — в их верхнем отделе. Вместо нормального сращения межпредсердной и межжелудочковой перегородок образуется большое общее отверстие между всеми четырьмя камерами сердца. Дело еще осложняется тем, что именно тут находится зона прикрепления к перегородкам предсердно-желудочковых клапанов: в левом — митрального, в правом — трехстворчатого. Крепиться им некуда
, и они срастаются друг с другом, образуя
общие для обоих желудочков створки
. Над ними остается дефект между предсердиями, а под ними — дефект между желудочками. Возникает так называемая
«полная форма»
АВК.
Если створки прирастают к межжелудочковой перегородке, то под ними межжелудочкового дефекта не будет. Остается только межпредсердное сообщение. Тогда говорят о «неполной форме»,
или первичном дефекте межпредсердной перегородки. Представить себе это очень просто — нарисуйте крест, а потом сотрите участок соединения вертикальной и горизонтальной линий. Вертикальная линия — межпредсердная (вверху) и межжелудочковая (внизу) перегородки, горизонтальная — клапаны, а пунктир — общие их створки: Это полная форма. А теперь соедините две горизонтальные линии с нижней вертикалью — получится буква «Y» с только одним отверстием сверху — это неполная форма порока.
В отличие от дефектов межжелудочковой перегородки, самостоятельно закрытие АВК не произойдет никогда.
Поговорим вначале о неполной форме порока. Его называют первичным дефектом межпредсердной перегородки потому, что это только большой дефект в ее нижней части. Но к нему присоединяется еще одно внутрисердечное нарушение — «расщепление
» передней створки митрального клапана, две половины которой не срастаются между собой (и между ними образуется щель). Возникает
недостаточность митрального клапана
, т.е. при каждом сокращении через это расщепление часть крови из левого желудочка забрасывается обратно в левое предсердие. То есть, помимо дефекта межпредсердной перегородки, появляется еще одна причина, увеличивающая остаточный объем крови в полостях сердца и нагрузку на все его отделы.
Жалобы и клиническая симптоматика очень похожи на те, которые описаны для изолированных дефектов межпредсердной перегородки, но развиваются они раньше и с большей скоростью. Обычно в возрасте первых 3-6 месяцев жизни уже есть прямые показания к хирургической операции. Некоторые больные попадают к хирургам уже вполне взрослыми, но вероятность того, что они будут страдать нарушениями ритма даже после полного устранения дефекта, достаточно высока.
Суть операции заключается в закрытии дефекта с помощью заплаты (как правило, из собственного перикарда, т.е. плотной сумки, окружающей сердце) и ушивания расщепленной створки митрального клапана. Понятно, что это — вмешательство на открытом сердце и с помощью искусственного кровообращения. Операция хорошо разработана и риск ее такой же, как и при закрытии обычного межпредсердного сообщения, т.е. практически ничтожен.
С полной формой порока
дело обстоит сложнее. Имеется несколько составляющих: дефект межпредесердной перегородки и дефект межжелудочковой перегородки, сливающиеся в одно огромное отверстие, и одно общее для обоих желудочков клапанное кольцо, регулирующееся двумя большими общими створками. Все отделы сердца работают с огромной перегрузкой, постоянно увеличенным объемом крови. Особенно оказывается переполненным малый круг. Давление в нем, естественно, повышается и, как и при больших ДМЖП, опасность быстрого развития необратимых изменений легочных сосудов очень высока.
Клинически порок протекает тяжело. Симптомы сердечной недостаточности появляются уже в первые месяцы жизни, и состояние ребенка требует постоянной лекарственной поддержки. Сердце быстро увеличивается в размерах — все его четыре камеры перегружены и с трудом справляются с работой. Ребенок очень болен, плохо ест и развивается, постоянно «подхватывает» простудные заболевания, часто заканчивающиеся воспалением легких. Состояние не критическое, но очень опасное. Операция необходима
вскоре после точного установления диагноза.
При наличии условий для хирургического лечения можно устранить порок одномоментно в первые месяцы жизни, а если таких условий нет, можно разбить лечение на два этапа, т.е. вначале сузить легочную артерию (как при ДМЖП), а через несколько месяцев сделать радикальную операцию.
Суть коррекции порока состоит вот в чем. В условиях «открытого сердца» рассекают общие створки клапана пополам, чтобы создать два отдельных входа в правый и левый желудочки. Затем с помощью заплаты закрывают дефект межжелудочковой перегородки. К этой заплате пришивают рассеченные ранее части общих створок, создавая тем самым правое и левое предсердно-желудочковые отверстия. Затем, отдельной заплатой закрывают межпредсердную часть бывшего дефекта.
Работы тут много, и требуется достаточно длительное время и на саму операцию, и на использование аппарата искусственного кровообращения. Вместе с тем, возможности ведущих клиник, специализирующихся на хирургическим лечении пороков у грудных детей, позволяют делать эту операцию в младенческом возрасте. Операции на ранних сроках абсолютно оправданы, т.к. позволяют избегнуть многих осложнений, которые уже трудно или невозможно исправить. Сегодня операция достаточно отработана и стандартна, а результаты ее хорошие.
Однако… Вечное это «однако» в медицине… Когда хирург работает на створках клапана, которые особенно у маленьких детей представляют собой тончайшие прозрачные лепестки, то любой, даже самый тонкий материал для швов, оказывается слишком грубым. Кроме того, ребенок будет расти, а сердце — и его клапанные отверстия — увеличиваться по мере роста. Поэтому, чем раньше сделана операция, тем более вероятно, что когда-нибудь его атрио-вентрикулярные клапаны, особенно митральный, будут работать несовершенно, т.е. появится их недостаточность. Это может произойти даже после идеально сделанной первой операции. В какой-то момент подростковой или уже взрослой жизни может быть поставлен вопрос об устранении недостаточности хирургическим путем: пластикой или протезированием клапана. Но это, если и будет, то гораздо позже. Здесь мы хотим подчеркнуть, что ребенка, удачно оперированного по поводу полной формы АВК надо регулярно показывать кардиологу и следить за функцией его клапанов, которая с годами может меняться.
Это совсем не означает, что нужно ограждать ребенка от физических нагрузок и внушать ему, что у него больное сердце, ни в коем случае. Но заниматься, например, большим спортом, который сегодня подразумевает нагрузки на грани возможностей здорового человека, ему, наверное, все-таки не стоит. Впрочем, наблюдение за ним грамотным детским кардиологом является залогом того, что все будет сделано вовремя.
Следует добавить, что в отличие от ранее описанных операций по поводу открытого артериального протока, дефекта межжелудочковой или межпредсердной перегородки, коарктации, неполной формы АВК, хирургия полной формы АВК, особенно у детей раннего возраста, — это особо тонкая и сложная процедура, требующая отличной подготовки всей хирургической команды и достаточного опыта. Не так давно она сопровождалась значительной смертностью даже в лучших специализированных центрах. Сегодня это не так, и результаты, как непосредственные, так и отдаленные, — отличные.
Один из создателей кардиохирургии доктор Джон Кирклин однажды сказал: «По-моему, это самая красивая операция из всех, что делаются по поводу врожденных пороков сердца». И пусть она будет для вашего ребенка не только самой красивой, но и самой удачной.
Как попасть на лечение в Научный центр им. А.Н. Бакулева?
Онлайн-консультации
Публикации в СМИ
Открытый атриовентрикулярный канал (АВК) — группа врождённых аномалий, характеризующаяся наличием сливающихся между собой ДМЖП и дефекта межпредсердной перегородки (ДМПП) и нарушением развития АВ-клапанного аппарата. Статистические данные • 5% всех ВПС в возрасте до 1 года • 2–6% всех ВПС, из них 70% — частично открытый АВК, 30% — полная и промежуточные формы открытого АВК • В 25–30% сочетается с синдромом Дауна.
Этиология: причины, вызывающие ВПС (см. Тетрада Фалло).
Патогенез. Полная форма (общий ОАВК) характеризуется первичным ДМПП, сливающимся с дефектом мембранозной части межжелудочковой перегородки, и высоко расположенным ДМЖП, АВ-клапаны имеют общие створки для левого и правого предсердно-желудочковых отверстий. Частично открытый АВК — сочетание первичного ДМПП с расщеплением передней створки митрального и/или створки трёхстворчатого клапана. Промежуточные формы (косые каналы, или дефекты Гербоде) характеризуются потоком крови из левого желудочка в правое предсердие, что приводит к перегрузке правого желудочка, расширению ствола лёгочной артерии. Нарушения гемодинамики складываются из сочетания таковых при ДМЖП и ДМПП (см. Дефект межжелудочковой перегородки, Дефект межпредсердной перегородки).
Клиническая картина
• Жалобы: см. Дефект межпредсердной перегородки, Недостаточность митрального клапана.
• Объективно • Бледность кожных покровов •• Выраженный цианоз у детей старше 4 лет при полной форме открытого АВК •• Границы сердца расширены влево и вправо •• Усиленный верхушечный толчок •• Толчок правого желудочка •• Систолическое дрожание •• Усиление I тона над верхушкой сердца и II тона над лёгочной артерией (при частично открытом АВК отсутствует) •• Пансистолический шум над всей областью сердца с максимумом в третьем и/или четвёртом межрёберных промежутках, проводящийся в межлопаточную и подкрыльцовую области (при полной и промежуточных формах) •• Для неполной формы характерен систолический шум во втором межрёберном промежутке слева (шум ДМПП) в сочетании с шумом митральной недостаточности на верхушке сердца.
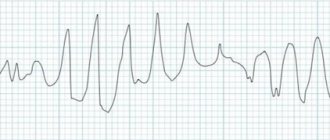
Инструментальная диагностика • ЭКГ: см. Дефект межжелудочковой перегородки, Дефект межпредсердной перегородки, Недостаточность митрального клапана • ЭхоКГ: см. Дефект межжелудочковой перегородки, Дефект межпредсердной перегородки, Недостаточность митрального клапана • Рентгенография органов грудной клетки: см. Дефект межжелудочковой перегородки, Дефект межпредсердной перегородки, Недостаточность митрального клапана • Катетеризация полостей сердца: см. Дефект межжелудочковой перегородки, Дефект межпредсердной перегородки, Недостаточность митрального клапана • Левые и правые атриография и вентрикулография, коронарная ангиография: см. Дефект межжелудочковой перегородки, Дефект межпредсердной перегородки, Недостаточность митрального клапана.
Медикаментозное лечение: профилактика инфекционного эндокардита и терапия сердечной недостаточности.
Хирургическое лечение • Показания •• В раннем возрасте — рефрактерные к консервативному лечению варианты порока, сопровождающиеся клинической симптоматикой •• Общий открытый АВК •• В дошкольном возрасте —открытый АВК, независимо от наличия клинических симптомов (в связи с высоким риском инфекционного эндокардита и большой частотой прогрессирования сердечной недостаточности в школьном возрасте) • Противопоказания: см. Дефект межпредсердной перегородки • Методы оперативного лечения •• При неполном открытом АВК — пластика митрального клапана, пластика ДМПП заплатой из аутоперикарда или синтетического материала •• При необходимости экстренной коррекции общего открытого АВК у детей с массой тела менее 3 кг, сопутствующих пороках сердца и при малом опыте клиники по радикальной коррекции порока в раннем возрасте — сужение лёгочного ствола •• В остальных случаях — одномоментная пластика ДМЖП, ДМПП, митрального и трёхстворчатого клапанов •• При промежуточных формах открытого АВК — пластика ДМЖП, при необходимости — аннулопластика трёхстворчатого клапана.
Специфические послеоперационные осложнения • Неадекватная коррекция порока (чаще всего митральной недостаточности) • АВ-блокады • Инфекционный эндокардит.
Прогноз • Тяжёлые формы проявляют себя в первые месяцы жизни, при лёгких формах общее состояние не нарушено • Средняя продолжительность жизни — 15 лет • При неполном открытом АВК средняя продолжительность жизни неоперированных больных — 20 лет • Хирургическая летальность — менее 6,7% • При общем открытом АВК и естественном течении порока 95% больных погибают к 5-летнему возрасту • Послеоперационная летальность — до 32% • Пациенты с промежуточными формами открытого АВК имеют относительно благоприятный прогноз, однако всем необходимо хирургическое лечение.
Синонимы: Дефекты эндокардиальных валиков; Предсердно-желудочковое сообщение; Персистирующее общее предсердно-желудочковое отверстие.
Сокращения. АВК — атриовентрикулярный канал.
МКБ-10. Q21.2 Дефект предсердно-желудочковой перегородки
Врожденные пороки сердца
В
рожденные пороки сердца (ВПС) — достаточно распространенная патология среди заболеваний сердечно-сосудистой системы, которая является основной причиной смерти детей первого года жизни. Частота ВПС составляет 30% от всех пороков развития. Лечение врожденных сердечных аномалий возможно только хирургическим путем. Благодаря успехам кардиохирургии стали возможны сложные реконструктивные операции при ранее неоперабельных ВПС. В этих уcловиях основной задачей в организации помощи детям с ВПС является своевременная диагностика и оказание квалифицированной помощи в хирургической клинике.
Этиология
Основными причинами рождения детей с ВПС являются: хромосомные нарушения — 5%; мутация 1-го гена — 2–3%; влияние внешних факторов (алкоголизм родителей, прием лекарственных препаратов, перенесенные вирусные инфекции во время беременности и т.д.) — 1–2% ;полигенно-мультифокальное наследование — 90%.
Помимо этиологических выделяют факторы риска рождения ребенка с ВПС. К ним относятся: возраст матери, эндокринные заболевания супругов, токсикоз и угроза прерывания I триместра беременности, мертворожденные в анамнезе, наличие детей с врожденными пороками развития у ближайших родственников. Количественно оценить риск рождения ребенка с ВПС в семье может только генетик, но дать предварительный прогноз и направить родителей на медико-биологическую консультацию может каждый врач.
Классификация
Встречается более 90 вариантов ВПС и множество их сочетаний. В Институте сердечно-сосудистой хирургии им. А.Н. Бакулева АМН СССР была разработана классификация, основанная на распределении ВПС с учетом анатомических особенностей порока и гемодинамических нарушений.
Для практикующих врачей-кардиологов удобнее пользоваться более упрощенным делением ВПС на 3 группы:
1. ВПС бледного типа с артериовенозным шунтом:
дефект межжелудочковой перегородки (ДМЖП), дефект межпредсердной перегородки (ДМПП), открытый артериальный проток (ОАП); открытый атриовентрикулярный канал (АВК).
2. ВПС синего типа с веноартериальным шунтом:
транспозиция магистральных сосудов (ТМС), тетрада Фалло (ТФ), триада Фалло, атрезия трикуспидального клапана (АТК) и т.д.
3. ВПС без сброса, но с препятствием на пути кровотока из желудочков
(стенозы легочной артерии и аорты). Такое деление охватывает 9 наиболее распространенных ВПС.
Нарушение гемодинамики при врожденных пороках сердца
Не случайно во всех предложенных классификациях большое внимание уделено оценке нарушений гемодинамики при ВПС, так как степень этих нарушений тесно связана с анатомической тяжестью порока, от них зависит тактика медикаментозного лечения и сроки выполнения операции.
ВПС вызывает ряд изменений компенсаторного характера, которые заставляют перестраиваться весь организм ребенка, но при длительном существовании порока процессы компенсации ведут к выраженным деструктивным изменениям органов и систем, что приводит к гибели больного.
В зависимости от состояния малого круга кровообращения в организме больного с ВПС наблюдаются следующие патологические изменения:
• при наличии увеличенного кровотока в легких (пороки бледного типа с артериовенозным шунтом) развивается гиперволемия и гипертензия малого круга кровообращения;
• при наличии обедненного кровотока в легких (пороки синего типа с веноартериальным шунтом) у больного развивается гипоксемия;
• при увеличении кровотока в малом круге кровообращения развивается гиперволемия и легочная гипертензия.
Примерно 50% детей первого года жизни с большим сбросом крови в малый круг кровообращения без хирургической помощи погибают при явлениях сердечной недостаточности. Если ребенок переживает этот критический период, то к году в результате спазма легочных артериол уменьшается сброс крови в малый круг и состояние ребенка стабилизируется, однако это улучшение касается только самочувствия больного, так как одновременно начинают развиваться склеротические процессы в сосудах легких. Существует много классификаций легочной гипертензии. Для практики наиболее удобной является классификация, разработанная в ИССХ им. А. Н. Бакулева АМН СССР (В.И. Бураковский и соавт., 1975). Она основана на величине давления в легочной артерии, степени сброса крови и соотношении общелегочного сопротивления к показателям большого круга кровообращения (табл. 1).
Согласно этой классификации, больные делятся на 4 группы, где I и III стадия разделены на подгруппы А и Б.
Больные IА
группы имеют небольшие нарушения гемодинамики и нуждаются в наблюдении кардиолога.
У больных IБ и II группы
ставится вопрос об операции. Легочная гипертензия в этих группах носит функциональный характер.
У больных III группы
при большом сбросе крови в малый круг изменения в легочных сосудах значительно более выражены. При
IIIА гемодинамической группе
возможна радикальная коррекция порока, и давление после операции снижается. В
IIIБ и IV группе
хирургическое лечение не показано. Дифференциальный диагноз между IIIА и Б группами сложен, и нередко для решения вопроса об операбельности порока необходимо выполнить внутрисосудистое ультразвуковое исследование и/или биопсию легкого для изучения морфологических изменений в легочных сосудах. Для оценки этих изменений наиболее часто используется классификация, предложенная Д. Хитом и Дж. Эдвардсом в 1958 г. (табл. 2).
При цианотических формах ВПС наличие сброса венозной крови в артериальную или смешение крови ведут к увеличению объема крови в большом круге кровообращения и уменьшению в малом, что приводит к снижению насыщения крови кислородом (гипоксемии) и к появлению цианоза кожи и слизистых. Для улучшения доставки кислорода к органам и повышения эффективности вентиляции происходит развитие коллатерального кровообращения между сосудами большого и малого круга кровообращения. Перестройка коллатеральной сети кровообращения происходит в сосудах всех органов. Особенно это выражено в сосудах сердца, легких и головного мозга.
Благодаря компенсаторным механизмам состояние больного с цианотическими формами ВПС, несмотря на тяжелые нарушения гемодинамики, может быть длительно удовлетворительным, но постепенно компенсаторные механизмы истощаются, длительная гиперфункция миокарда приводит к развитию тяжелых необратимых дистрофических изменений в сердечной мышце. Поэтому оперативное вмешательство при цианотических пороках (радикальное или паллиативное) показано в самом раннем детском возрасте.
Диагностика
Первичная диагностика ВПС основывается на данных неинвазивных методов исследования. Большое значение для диагностики имеет целенаправленный сбор анамнеза у родителей ребенка. При бледных пороках сердца необходимо выяснить, часто ли болеет ребенок респираторными инфекциями, были ли у него пневмонии, так как это говорит о большом сбросе крови слева-направо. С другой стороны, прекращение респираторных инфекций у больного с большим сбросом крови в малый круг говорит о начале развития легочной гипертензии. Это должно быть поводом для направления больного к кардиохирургу. Естественное течение ВПС может осложниться развитием инфекционного эндокардита, поэтому необходимо выяснить, бывают ли у ребенка подъемы температуры тела без признаков респираторной инфекции. Следует также выяснить, не было ли у больного синкопальных состояний, судорожного синдрома, которые могут быть следствием аритмий сердца.
При осмотре ребенка с подозрением на ВПС необходимо отметить цвет кожных покровов и слизистых. Цианоз может быть периферическим и генерализованным. Важно отметить наличие или отсутствие цианоза на всех 4 конечностях, так как при некоторых ВПС наблюдается дифференцированный цианоз (предуктальная коарктация аорты, транспозиции магистральных сосудов в сочетании с перерывом дуги аорты). При осмотре грудной клетки необходимо отметить деформацию грудной клетки в области сердца — появление так называемого сердечного горба (по величине и локализации которого можно косвенно судить о сложности ВПС и/или развитии легочной гипертензии).
При пальпации грудной клетки у больного с ВПС можно отметить смещение верхушечного толчка, изменение его площади, наличие “дрожания” над областью сердца. Пальпация позволяет оценить размеры печени и селезенки. Методом перкуссии определяют размеры сердца, печени и селезенки.
Аускультация является наиболее информативным методом физикального обследования больных с ВПС.
При аускультации можно отметить изменение тонов сердца (усиление, ослабление или расщепление), появление шумов, а также их локализацию, иррадиацию и место максимального выслушивания. Интенсивность шума не всегда коррелирует с тяжестью порока, например, при ВПС с легочной гипертензией и синих пороках со стенозом легочной артерии эта зависимость носит обратный характер. При аускультации легких можно выявмть признаки застоя в малом круге.
Физикальное исследование дополняется проведением неинвазивного инструментального обследования, которое включает электрокардиографию (ЭКГ), фонокардиографию (ФКГ) и рентгенографию органов грудной клетки.
ЭКГ
позволяет судить о гипертрофии различных отделов сердца, патологических отклонениях электрической оси, наличии нарушений ритма и проводимости. Изменения на ЭКГ не являются специфичными для какого-либо порока, но в сочетании с данными, полученными при клиническом обследовании и с помощью других неинвазивных методов, позволяют судить о тяжести порока. Разновидностью метода ЭКГ является
холтеровское суточное ЭКГ-мониторирование
, которое помогает выявить скрытые нарушения ритма и проводимости.
Следующим неинвазивным методом обследования кардиологических больных является ФКГ
, которая воспроизводит данные аускультации сердца и позволяет более детально и количественно оценить характер, продолжительность и локализацию сердечных тонов и шумов.
Рентгенография
органов грудной клетки дополняет предыдущие методы и позволяет оценить: состояние малого круга кровообращения (наличие артериального или венозного застоя, снижение наполнения сосудов легких); расположение, форму, размеры сердца и его отдельных камер; изменения со стороны других органов и систем (легкие, плевра, позвоночник, а также расположение внутренних органов).
Сочетание ЭКГ, ФКГ и рентгенография органов грудной клетки позволяет диагностировать большинство изолированных пороков и предположить наличие сложных ВПС.
Наиболее высокоинформативным неинвазивным методом исследования является эхокардиография (ЭХОКГ). С появлением данной методики, особенно двухмерной ЭХОКГ, значительно расширились возможности диагностики ВПС. Этот метод позволяет провести анатомически точную диагностику дефектов перегородок сердца, поражения атриовентрикулярных и полулунных клапанов, размеры и расположение камер сердца и магистральных сосудов, а также оценить сократительную способность миокарда. При определенных пороках (неосложненные ДМПП, ДМЖП, ОАП, частично открытый АВК, коарктация аорты) можно выполнить операцию без проведения катетеризации сердца. Однако в ряде случаев при сложных ВПС и сопутствующей легочной гипертензии необходимо провести катетеризацию сердца и ангиокардиографию
, так как эти методы позволяют провести точную анатомическую и гемодинамическую диагностику ВПС. Проведение катетеризации сердца возможно только в условиях специализированной кардиохирургической клиники. В настоящее время при проведении катетеризации сердца в случае необходимости выполняется электрофизиологическое исследование для уточнения механизма аритмий сердца, оценки функции синусового и атриовентрикулярного узлов, а также проводятся различные
эндоваскулярные операции:
баллонная ангиопластика при стенозах легочной артерии и аорты; эмболизация небольших ОАП, коронаросердечных фистул, аортолегочных коллатералей; баллонная атриосептостомия при простой ТМС и стентирование легочных сосудов при периферических стенозах.
Тактика хирургического лечения
Тактика оказания помощи больным с ВПС строится с учетом течения порока, эффективности консервативного лечения, возможности и риска проведения хирургического лечения. После установления диагноза необходимо решить:
1. Как лечить больного (медикаментозно или хирургически)?
2. Определить сроки выполнения операции.
Ответить на эти вопросы помогает классификация, предложенная J. Kirklin и соавт. (1984).
0-я группа
– больные с ВПС, с незначительными нарушениями гемодинамики, которые не нуждаются в операции.
1-я группа
– больные, состояние которых позволяет провести операцию в плановом порядке ( через год и более).
2-я группа
– больные, которым операция показана в ближайшие 3–6 мес.
3-я группа
– больные с тяжелыми проявлениями ВПС, которых необходимо оперировать в течение нескольких недель.
4-я группа
– больные, нуждающиеся в экстренной операции (в течение 48 ч после госпитализации).
Наиболее сложная проблема в кардиохирургии – операция у детей первого года жизни с ВПС. Хирургическая летальность в последние годы значительно снижена и отличается от высокой естественной смертности при ВПС. Операция у детей первого года жизни выполняется в том случае, если консервативными методами не удается достичь стабилизации состояния. Большинство неотложных операций выполняются у детей с цианотическими ВПС.
Если у новорожденного с ВПС отсутствуют признаки сердечной недостаточности, цианоз выражен умеренно, то консультация кардиохирурга может быть проведена позднее. Наблюдение за такими детьми осуществляет кардиолог по месту жительства. Такая тактика позволяет провести обследование больного в более благоприятных условиях, снизить риск проведения инвазивных методов исследования и оперативного вмешательства.
В более поздней возрастной группе хирургическая тактика при ВПС зависит от тяжести патологии, предполагаемого прогноза, возраста и массы тела больного. K.Turley и соавт. в 1980 г. предложили разделить ВПС на 3 группы, в зависимости от вида возможной операции.
К 1-й группе
относятся такие наиболее часто встречающиеся пороки, как ОАП, ДМЖП, ДМПП, частично открытый АВК, коарктация аорты, стеноз и недостаточность митрального и аортального клапанов. При установлении данных пороков единственным выбором может быть операция. Она может быть отложена, если нарушения гемодинамики нерезко выражены, а возраст ребенка и масса тела слишком малы (более поздний возраст и достаточная масса тела снижают риск выполнения кардиохирургических вмешательств).
Во 2-ю группу
входят сложные цианотические пороки, такие, как тетрада Фалло, стеноз легочной артерии, атрезия легочной артерии 1-го типа, транспозиция магистральных сосудов и др. Выбор между радикальной и паллиативной операцией зависит от анатомической тяжести порока, степени гипоксемии и массы тела ребенка.
К 3-й группе
относятся ВПС, при которых возможна только паллиативная или гемодинамическая коррекция порока. К ней относятся различные варианты сложных пороков: атрезия трикуспидального и митрального клапанов, двухкамерное сердце, синдром гипоплазии правого и левого сердца, единственный желудочек сердца и др.
Радикальная коррекция простых неосложненных пороков не представляет технических трудностей для специализированной кардиохирургической клиники. При ДМЖП и ДМПП выполняется ушивание или пластика дефектов заплатой
, при ОАП —
перевязка или пересечение протока
. При выраженной гипоксемии первым этапом у больного с ВПС проводится паллиативная операция —
наложение различных межсистемных анастомозов
. После проведения операции улучшается насыщение крови кислородом, что позволяет ребенку развиваться в более благоприятных условиях. Выполнение двухэтапных операций, по данным различных авторов, не только не увеличивает риск вмешательства, но уменьшает летальность при радикальной коррекции.
При некоторых анатомически сложных ВПС, когда отсутствуют или недоразвиты различные отделы сердца (атрезия трикуспидального и митрального клапанов, единственный желудочек сердца, двухкамерное сердце и т.д.) выполнение радикальной операции не представляется возможным и единственной операцией может быть гемодинамическая коррекция внутрисердечной гемодинамики
, которая позволяет разделить артериальные и венозные потоки крови, не устраняя полностью анатомические пороки. К ним относятся различные модификации гемодинамической коррекции по методу Фонтена, Мастарда и Сенинга.
Список литературы Вы можете найти на сайте https://www.rmj.ru
Литература:
1. Бураковский В.И., Бухарин В.А. Константинов С.А. и др. Врожденные пороки сердца. В кн. Частная хирургия болезней сердца и сосудов / Под ред. В.И. Бураковского и С.А.Колесникова. М.: Медицина, 1967; 315—23.
2. Бураковский В.И., Бухарин В.А., Плотникова Л.Р. Легочная гипертензия при врожденных пороках сердца. М. Медицина, 1975; 247.
3. Амосов Н.М., Бендет Я.А. Терапевтические аспекты кардиохирургии. Киев: Здоровье, 1983; 33—96.
4. Белоконь Н.А., Кубергер М.Б. Болезни сердца и сосудов у детей. Руководство для врачей. В 2 томах. — М. Медицина, 1987; 918.
5. Бураковский В.А., Бухарин В.А., Подзолков В.П. и др. Врожденные пороки сердца. В кн. Сердечно-сосудистая хирургия / Под ред. В.И. Бураковского, Л.А. Бокерия. М. Медицина, 1989; 345—82.
6. Иваницкий А.В., Роль рентгенологического исследования в диагностике пороков сердца у детей. Педиатрия. 1985; 8 (7) 55—7.
7. Н.А.Белоконь, В.П. Подзолков. Врожденные пороки сердца. М. Медицина, 1991; 352.
Формы и типология
В зависимости от области поражения, имеющихся внешних проявлений и степени развития данная патология может классифицироваться.
В настоящее время различают три формы атриовентрикулярной коммуникации, которые распознаются в зависимости от анатомических особенностей патологии:
- неполная форма атриовентрикулярной коммуникации – при ней наблюдается наличие первичного дефекта межпредсердной перегородки и при этом расщепление передней створки митрального клапана;
- при интермитирующей форме наблюдается присутствие первичного дефекта межпредсердной перегородки, общего расщепления передней створки митрального клапана и створки септальной трехстворчатого клапана;
- полная форма атриовентрикулярной коммуникации, которая характеризуется наличием общего кольца атриовентрикулярных клапанов, первичным дефектом межпредсердной перегородки и приточным дефектом межжелудочковой перегородки.
При этом полная форма подразделяется на три подвида:
- тип А характеризуется наличием разделения створки на левую половину и правую, которые делятся посредством креплений хорд: они идут из правого в левый желудочек;
- тип В – хорды идут из одного желудочка к одной створке;
- тип с подразумевает отсутствие хорд в передней общей створке.
Перечислим причины, которые могут вызывать возникновение рассматриваемой патологии.