Результаты
Все группы достоверно не различались по частоте хронической почечной недостаточности, сахарного диабета, хронической обструктивной болезни легких (табл. 1). Гипертоническую болезнь III стадии, ишемическую болезнь сердца обнаруживали чаще в 1-й и 2-й группах. Порок митрального клапана во 2-й и 3-й группах чаще развивался на фоне инфекционного эндокардита, который является одной из причин двухклапанного поражения (p
<0,05).
Таблица 1. Сравнительная характеристика больных Примечание. МОС — максимальная объемная скорость по сравнению с нормой; ЛП — левое предсердие; БЦА — брахицефальные артерии; ХОБЛ — хроническая обструктивная болезнь легких; СД — сахарный диабет; СКФ — скорость клубочковой фильтрации; ИБС — ишемическая болезнь сердца; ГБ — гипертоническая болезнь; ОФВ1/ЖЕЛ— объем формированного выдоха за 1 с, жизненная емкость легких по сравнению с нормой. Здесь и в табл. 2, 3 и 4: ПАК — протезирование аортального клапана, ПМК — протезирование митрального клапана; МР — митральная регургитация;*— р<0,05 по сравнению с 1-й группой.
В 1-й группе преобладал стеноз аортального клапана склеродегенеративного характера. Дооперационные значения объемной скорости выдоха по разным сегментам трахеобронхиального дерева и ЖЕЛ были ниже у больных с выраженной митральной недостаточностью по сравнению с контрольной группой (p
<0,05). Отмечена взаимосвязь вентиляционных нарушений с давлением в легочной артерии в этих группах (см. табл. 1). Аналогичная тенденция наблюдалась относительно объема левого предсердия, что отражает перегрузку по малому кругу кровообращения.
У больных 2-й и 3-й групп имели место более высокие дооперационные уровни ферментов печени, однако средние значения этого показателя не превышали нормы во всех группах (табл. 2). Уровень креатинина был выше у больных с митральной регургитацией, в том числе после протезирования митрального клапана (см. табл. 2). В соответствии с этим снижена скорость клубочковой фильтрации, что говорит о наличии исходно худшей функции почек у этих больных. Все эти особенности отражают явления циркуляторной недостаточности по большому кругу кровообращения, которая чаще развивалась при наличии поражения митрального клапана. Разницы по этим параметрам между 2-й и 3-й группами не получено.
Таблица 2. Биохимические показатели крови больных до операции
Интраоперационные данные демонстрируют большую продолжительность операции у больных 3-й группы (табл. 3), что связано с большим объемом реконструкции.
Таблица 3. Интраоперационные параметры Примечание. СЗП — свежезамороженная плазма; ИК — искусственное кровообращение; ИМ — ишемия миокарда; КШ — коронарное шунтирование;* — р<0,05 по сравнению с 1-й группой.
Продолжительность ИМ и ИК во 2-й группе была достоверно больше, чем у больных контрольной группы. Возможной причиной считаем продолжительную декальцинацию клапанных структур и стенок аорты у этих больных.
Интраоперационная кровопотеря была выше в 3-й группе по сравнению с 1-й группой. При этом 1-я и 2-я группы достоверно не различались по объему кровопотери (см. табл. 3).
Во время операции во 2-й и 3-й группах интраоперационный гематокрит был ниже, чем у больных контрольной группы (p
<0,05). Увеличенная потребность в переливании СЗП для коррекции гипокоагуляции в этих группах, вероятно, связана с этой особенностью (см. табл. 3).
В нашем исследовании отмечено снижение СКФ и сопутствующее повышение уровня креатинина во 2-й и 3-й группах. По частоте развития послеоперационных осложнений, в том числе по показателю послеоперационной летальности, во всех группах результаты были схожи (табл. 4). Это говорит о возможности выполнять больший объем операции с удовлетворительными результатами.
Таблица 4. Послеоперационные результаты Примечание. ОПН — острая почечная недостаточность; СКФ — скорость клубочковой фильтрации; * — р<0,05 по сравнению с 1-й группой.
Мы оценили до- и послеоперационные эхокардиографические параметры объемов сердца, а также их динамику в раннем послеоперационном периоде.
Исходные значения конечного диастолического объема (КДО), конечного систолического объема (КСО), фракции выброса (ФВ) и ударного объема (УО) не имели статистически значимых различий во всех группах больных (рис. 1). Сравнение значений давления в легочной артерии выявило достоверно более выраженную легочную гипертензию у больных с тяжелой митральной недостаточностью по сравнению с пациентами контрольной группы.
Рис. 1. Дооперационные эхокардиографические параметры. Здесь и на рис. 2: * — статистическая значимость при p<0,05.
Объем левого предсердия (ЛП) был значительно больше у больных во 2-й и 3-й группах (см. рис. 1).
При анализе ранних послеоперационных данных выявлена достоверная разница в значениях ФВ, которая была выше в 1-й группе по сравнению с 3-й группой (рис. 2). Во 2-й группе показатели ФВ не отличались от таковых в 1-й группе. Подобная эхокардиографическая картина была характерна и для значений УО. В 1-й и 2-й группах разницы в показателях УО выявлено не было.
Рис. 2. Послеоперационные эхокардиографические параметры.
Значения КДО и КСО после операции не различались во всех группах. Объем Л.П. в 3-й груп-пе оставался больше, чем у больных 1-й группы (см. рис. 2).
При наличии митральной недостаточности протезирование митрального клапана (3-я группа) способствовало нормализации давления в легочной артерии. Оно было достоверно ниже, чем у больных 2-й группы, что связано с радикальной коррекцией порока при двухклапанном вмешательстве.
В 1-й и 3-й группах обратное ремоделирование миокарда протекало динамичнее. КДО в 1-й и 3-й группах при контрольном исследовании изменился более выраженно, чем у больных с некорригированной митральной недостаточностью, что свидетельствует о высокой преднагрузке миокарда у этих больных (см. рис. 2).
КСО уменьшился у больных с сопутствующей митральной недостаточностью быстрее, чем у пациентов 1-й группы. В группе сочетанной клапанной коррекции динамика КСО достоверно не отличалась от показателей во 2-й группе (рис. 3).
Рис. 3. Разница между до- и послеоперационными эхокардиографическими параметрами.
Объем ЛП после операции уменьшился у больных 2-й и 3-й групп. Для больных 1-й группы динамика была незначительной. Это, скорее всего, объясняется исходно меньшими размерами ЛП у больных без митральной недостаточности.
Выраженное снижение легочной гипертензии отмечено у больных после протезирования аортального и митрального клапанов (в среднем на 20 мм рт.ст.), в то время как в 1-й и 2-й группах изменения давления в легочной артерии имели более умеренный характер и достоверно не различались, при этом только во 2-й группе исходно имелась легочная гипертензия (см. рис. 1).
Обсуждение
Хроническое воспаление считается ключевым независимым фактором формирования сердечно-сосудистой патологии у пациентов с ревматическими заболеваниями, однако взаимосвязи между воспалением, традиционными факторами риска, генетическими предиспозициями и влиянием медикаментозной терапии до сих пор четко не обозначены [3]. Помимо воспаления к добавочным факторам ССР относится анемия. Несмотря на доказанную негативную роль анемии в прогрессировании поражения миокарда у пациентов кардиологического профиля, четкие позиции в отношении анемического синдрома при воспалительных заболеваниях позвоночника не определены.
Ведущей причиной развития анемии у пациентов с аксСпА является цитокин-индуцированное нарушение метаболизма железа в рамках персистирующего системного воспаления [11]. Частота встречаемости анемического синдрома при спондилоартритах варьирует, по разным данным, от 11,1% до 39,3%, преобладающим патогенетическим вариантом является анемия хронических заболеваний с истинным железодефицитным компонентом или без такового [12, 13]. Вклад анемии в формирование ремоделирования миокарда обусловлен следующими патогенетическими механизмами. Гемическая гипоксия, возникающая на фоне анемии, запускает гемодинамические и не ассоциированные с нарушениями гемодинамики адаптивные механизмы, позволяющие на ранних стадиях компенсировать недостаточный газообмен.. Гемодинамические механизмы реализуются в повышении сократительной способности миокарда, снижении постнагрузки за счет индуцированного гипоксией снижения сосудистого сопротивления ввиду повышенной секреции оксида азота, увеличения преднагрузки в результате повышения венозного возврата, а также положительного хроно- и инотропного влияния [14]. При длительно существующем анемическом синдроме данные процессы приводят к дезадаптивному ремоделированию миокарда ЛЖ и развитию сердечной недостаточности.
В ряде исследований показана отягощающая роль анемии у пациентов как с наличием, так и без имеющихся сердечно-сосудистых заболеваний (ССЗ). В исследовании ARIC (Atherosclerosis Risk in Communities) с участием 14 410 лиц без ССЗ было продемонстрировано самостоятельное значение анемии в качестве неблагоприятного прогностического маркера развития кардиоваскулярной патологии [15]. Снижение уровня гемоглобина выявлялось практически у каждого второго пациента с ХСН вне зависимости от ФВ ЛЖ, по данным анализа когорты MAGGIC (Metaanalysis Global Group in Chronic Heart Failure), и было ассоциировано с увеличением функционального класса заболевания и смертности от всех причин [16].
Патогенетические механизмы, лежащие в основе развития АГ у пациентов с аутоиммунными ревматическими заболеваниями, являются многофакторными.. Установлено, что иммунная дисрегуляция и хроническое воспаление играют ключевую роль в формировании АГ в результате запуска генерализованной эндотелиальной дисфункции, увеличения артериальной ригидности, преждевременного развития и прогрессирования атеросклеротического поражения сосудистой стенки [17]. Следует отметить, что, по данным исследования H. Midtbø et al. [18], увеличение встречаемости ремоделирования ЛЖ у пациентов с анкилозирующим спондилитом выявлялось независимо от наличия таких традиционных факторов ССР, как АГ, ожирение и сахарный диабет. В нашем исследовании у всех пациентов 1-й группы с изменением геометрии сердца отсутствовали другие факторы ССР, помимо высокоактивного системного воспаления.. В то же время частота встречаемости ремоделирования миокарда ЛЖ закономерно нарастала у пациентов с более длительным течением аксСпА, для которых было характерно накопление традиционных факторов ССР, прежде всего АГ, ожирения и дислипидемии.
Наше исследование имело некоторые ограничения. Небольшая выборка пациентов, вероятно, не позволила обнаружить статистически значимые различия частоты встречаемости ремоделирования миокарда ЛЖ в исследуемых группах, в связи с чем полученные результаты следует считать предварительными.. Требуется дальнейшее исследование и анализ взаимосвязей между наличием анемии и развитием ремоделирования сердца на большей когорте пациентов, а также изучение самостоятельного вклада анемии в развитие и прогрессирование сердечно-сосудистой патологии у пациентов со спондилоартритами.
Как диагностируется и можно ли остановить патологию?
Диагностика данного заболевания проводится при помощи снятия электрокардиограммы сердца. На ней, в случае изменения геометрии левого желудочка миокарда, будет наблюдаться повышение ST и снижение зубца R.
Предотвратить развитие ремоделирования миокарда можно, если своевременно диагностировать гипертонию (для нее характерны частые скачки давления вверх, головные боли, ухудшение общего состояния здоровья).
Современная медицина доказывает, что уже даже появившаяся патология может быть уменьшена с помощью медикаментозных средств и не только. Уменьшить толщину стенок и снизить массу левого желудочка возможно с помощью антигипертензивных препаратов.
Тормозят ремоделирование и улучшают геометрию левого желудочка миокарда бета-адреноблокаторы. Кроме того, в первые сутки после приступа инфаркта, с целью предупреждения сердечной недостаточности и предотвращения рецидива назначаются ингибиторы ангиотензинпревращающего фермента. Эффективны для ограничения раннего постинфарктного ремоделирования нитраты, а также, антагонисты кальция (они предусматривают длительный курс терапии).
Также, важно снизить употребление в пищу соли и солений, соблюдать специально разработанную диету и взять под контроль собственный вес (провести профилактику образования избыточных килограммов).
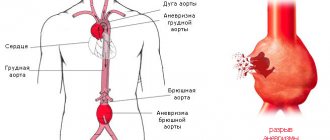
Ремоделирование миокарда на примере изменений после инфаркта
Для более понятного представления о патологическом процессе, рассмотреть основные моменты патофизиологии ремоделирования миокарда, можем на примере структурного изменения его после инфаркта. В первую очередь изменилась форма левого желудочка. Если раньше его формой был эллипс, то теперь он больше похож на сферу. Очень ярко наблюдается истончение и растяжение миокарда, часто увеличивается площадь некроза участка сердечной мышцы (даже, в тех случаях, когда повторных ишемических некрозов не было). Проявляется и множество других патологических нарушений, которые могут привести к неприятным последствиям.
Взаимосвязь процессов, в ходе которых в сердечной мышце развивается структурное изменение, налицо: сначала повысилось давление, сердце в ответ на него старается адаптироваться, в результате чего, прямо пропорционально, происходит утолщение стенки желудочка, а вместе с этим увеличивается вес мышцы и некоторые другие, соответствующие данному состоянию, изменения.
Данный пример разъясняет, как происходит ремоделирование миокарда и почему оно может оказаться опасным, усугубить положение, увеличивая риск развития осложнений после перенесенного инфаркта. Именно поэтому, после приступа больной проходит длительный срок реабилитации, ему назначаются специальные препараты (некоторые из них постоянного применения), в качестве предотвращения развития рецидива.
Ремоделирование сердца
Нет ничего сложнее, нежели перенести тяжелую болезнь сердца, которая приводит также к определенным последствиям. Одной из таковых является ремоделирование сердца. Ремоделирование сердца — это структурные изменения органа, разрушающие его свойства в ответ на внешние воздействия и другие патологические процессы в организме человека.
Ремоделирование сердца проишодит под воздействием негативных факторов и заболеваний