Статья подготовлена специалистом исключительно в ознакомительных целях. Мы настоятельно призываем вас не заниматься самолечением. При появлении первых симптомов — обращайтесь к врачу.
Мегалобластная анемия – это одна из разновидностей анемий, характеризующаяся нарушениями в системе кроветворения при которых в костном мозге начинают формироваться эритроциты, имеющие низменную структуру. Также мегалобластную анемию называют В12-дефицитной анемией.
В общей структуре анемий, мегалобластная анемия встречается в 9-12% случаев. Она с одинаковой частотой развивается как у мужчин, так и у женщин, но люди пожилого возраста страдают от патологии чаще.
Без лечения мегалобластная анемия будет прогрессировать и приведет к серьезным последствиям для здоровья человека.
Причины мегалобластной анемии
Развивается мегалобластная анемия по причине нехватке в организме фолиевой кислоты (витамин В9) и витамина В12 (цианокобаламин).
Привести к снижению уровня витамина В9 способны следующие факторы:
- Погрешности в питании, когда человек резко ограничивает себя в пище.
- Нарушение всасывания витамина В9 в кишечнике. Это происходит при различных патологиях органов пищеварительного тракта, например, энтерит, колит, целиакия.
- Перенесенная резекция желудка или кишечника.
- Определенные периоды в жизни человека, когда потребность в фолиевой кислоте резко возрастает, например, период вынашивания плода и период грудного вскармливания.
- Некоторые разновидности гемолитических анемий.
- Эксфолиативный дерматит.
- Паразитарные инвазии, в частности, дифиллоботриоз.
- Проведение внепочечного очищения крови.
- Патологии печени: гепатит и цирроз.
- Воспаление поджелудочной железы хронического течения.
- Алкоголизм.
- Прием некоторых лекарственных препаратов: оральных гормональных контрацептивов, противосудорожных средств и пр.
Дефицит витамина В12 в организме может развиваться по следующим причинам:
- Отказ от пищи животного происхождения и приверженность вегетарианству.
- Онкологическое поражение желудочной стенки или наличие в желудке полипов.
- Перенесенная резекция желудка и тонкого кишечника.
- Аденома поджелудочной железы ульцерогенная.
- Вынашивание ребенка и кормление его грудью.
- Целиакия.
- Болезнь Крона.
- Патологии печени: гепатиты и цирроз.
- Дефицит транскобаламина II.
Витамин В12 и витамин В9 принимают непосредственное участие в процессе формирования ДНК и РНК человека, причем в первую очередь будут страдать клетки красного костного мозга и слизистых оболочек органов пищеварительной системы. Именно они в организме делятся быстрее остальных. Клетки-предшественники эритроцитов при такой патологии не в состоянии совершить полноценный переход к более зрелой форме. При этом они не погибают, их цитоплазма продолжает расти и развиваться. Как итог, в крови начинают циркулировать крупные неполноценные эритроциты, которые специалисты называют мегалобластами.
Витамин В12 в организм попадает вместе с пищей. Его основным источником являются продукты животного происхождения. В желудке он вступает во взаимодействие с особым веществом, которое называется гастромукопротеин. С ним витамин В12 образует комплексное соединение и в такой связке проникает в тонкую кишку, где всасывается в кровь. Каждый день здоровый человек должен получать от 3 до 7 мкг витамина В12. В печени, в норме, его содержится от 3 до 5 мг – это депо цианокобаламина. Фолиевой кислоты в сутки организм должен получать больше – около 100 мкг. Каждый день (при стандартном рационе) человек употребляет от 300 до 750 мкг фолиевой кислоты. В депо организма содержится около 5-10 мг этого вещества.
Витамин В12 в своем составе содержит 2 кофермента. Если наблюдается дефицит первого кофермента, то ДНК не в состоянии нормально формироваться, что приводит к сбою в выработке эритроидных клеток и появлению в крови мегалобластов. Также страдает процесс синтеза лейкоцитов и тромбоцитов, но не в такой мере, как эритроцитов.
Кроме того, нехватка первого кофермента не дает организму продуцировать аминокислоту (метионин), которая входит в состав миелиновых оболочек, покрывающих нервные стволы и клети. Поэтому нарушается работа нервной системы в целом.
Дефицит второго кофермента, входящего в состав витамина В12, приводит к тому, что в организме нарушается метаболизм жирных кислот. В нем начинают скапливаться токсины, которые поражают клетки спинного мозга. Эта патология носит название фуникулярный миелоз.
B12 анемия: причины
Ежедневная потребность человеческого организма в витамине В12 составляет от одного до пяти микрограммов. Она удовлетворяется за счёт его потребления с пищей: после попадания в желудок витамин отделяется от белка под воздействием ферментов. Для того, чтобы организм полноценно его усвоил, должен произойти процесс соединения с гликопротеином и другими факторами. Всасывание витамина в кровь происходит в нижней части подвздошной кишки, откуда он и поступает к тканям. Факторы, способные инициировать развитие анемии делят на две группы:
- Алиментарные – несбалансированное питание, не способное обеспечить поступление требуемого количества В12 в организм. Нередко такое случается, если пациент практикует голодание, вегетарианство или диеты, сводящие к минимуму или исключающие потребление животного белка;
- Эндогенные – сбои в процессе усвоения витамина из-за дефицита белка, связывающего витамин и переводящий его в усвояемую форму. Подобное явление может быть инициировано: врождённым отсутствием внутреннего фактора Касла;
- воспалительными процессами слизистой желудка в хронической форме;
- состоянием после проведения операции по иссечению желудка;
- состоянием после частичного удаления подвздошной или 12-типерстной кишки;
- воспалением тонкого кишечника (энтерит), поджелудочной железы (панкреатит);
- глютеновой энтеропатией;
- гранулёматозным воспалением отделов пищеварительного тракта (заболевание Крона);
- выпячиваниями кишечной стенки – (дивертикулами);
- новообразованиями тощей кишки злокачественной природы;
- глистными инвазиями, вызываемые разными видами гельминтов.
Причины могут крыться в физической и психической зависимости от приёма алкоголя, в применении «Колхицина», «Неомицина», а также ряда пероральных контрацептивов.
Симптомы мегалобластной анемии
Чаще всего мегалобластная анемия развивается по причине нехватки в организме именно витамина В12. Все симптомы этого нарушения объединены в четыре больших группы:
- Симптомы, связанные с нарушениями в работе органов пищеварительной системы. При мегалобластной анемии происходят атрофические изменения в слизистых оболочках желудка и кишечника, а также наблюдается недостаточность выработки необходимых для нормального переваривания пищи ферментов. Это приводит к тому, что пациенты предъявляют следующие жалобы:
- Отсутствие желания принимать пищу.
- Отвращение к мясным блюдам.
- Болезненные ощущения в области языка, искажение вкуса. Язык может стать яркого цвета, покрыться блестящей пленкой (атрофический глоссит Гюнтера).
- Жалобы на тошноту, которая периодически может заканчиваться рвотой.
- Нарушения стула (диарея).
- Симптомы фуникулярного миелоза.
- Головные боли.
- Расстройства чувствительности в виде «ползания мурашек по коже», покалывания кожи и пр.
- Ощущение холода в конечностях, ухудшение их чувствительности.
- Изменения в походке человека.
- Снижение мышечной силы, а при тяжелом течении анемии у пациента развивается паралич.
- Циркулярно-гипоксический синдром. Его проявления:
- Ощущение постоянной слабости.
- Повышенная утомляемость.
- Появление одышки. Сперва она возникает на фоне физической активности, а затем начинает беспокоить, даже когда человек отдыхает.
- Учащенное сердцебиение.
- Болезненные ощущения в груди (болит сердце).
- Кожные покровы становятся неестественно бледными, либо даже желтушными.
- Симптомы, обусловленные нарушения в работе нервной системы:
- У человека усиливается раздражительность, он становится очень нервным.
- Возможно возникновение галлюцинаций.
- Периодически возникают судороги.
- Умственные способности ухудшаются.
В начале развития анемии человек может не предъявлять каких-либо жалоб, так как патологические симптомы в этот период будут отсутствовать. Возможно незначительное ухудшение самочувствия, усталость и слабая диспепсия. Как правило, в этот период к врачам пациенты не обращаются. Хотя уже в это время достаточно сделать анализ крови, чтобы выявить развивающуюся анемию.
По мере прогрессирования заболевания симптомы начинают набирать силу. Если у человека уже имеются какие-либо патологии хронического течения, то их клиника будет усугубляться. Например, это справедливо в отношении стенокардии и аритмии. Также на ногах и руках, а еще на лице появляются отеки.
В пожилом возрасте анемия чаще всего имеет скрытое течение. Пациенты не указывают врачу на свое плохое самочувствие, что затрудняет диагностику.
Роль витамина В12 в развитии анемии
Состав витаминов в организме зависит от процессов «внутреннего производства», количества, поступившего с пищевыми продуктами, возможности усвоения. В12 и фолиевая кислота не синтезируются самостоятельно. Средний уровень в крови В12 поддерживается за счет достаточного накопления (ежедневно усваивается по 4 мкг).
Для возникновения дефицита нужно, чтобы он не поступал с пищей годами или резко усилился процесс разрушения. Важность для биохимических процессов связана с наличием в формуле витамина двух незаменимых коферментов (метилкобаламина и дезоксиаденозилкобаламина).
Метилкобаламин необходим для синтеза ДНК, а через этот процесс обеспечивают нормальный процесс кроветворения, «дозревание» эритроцитов, лейкоцитов и тромбоцитов. Его недостаток приводит к мегалобластному типу. Дезоксиаденозилкобаламин является активным ферментом жирового обмена. При дефиците нарушается структура нервных корешков спинного мозга.
Все оболочки спинного мозга переходят на нервные корешки, недостаток витамина вызывает разрушение защитного покрытия
Чтобы компоненты витамина освободились из пищевых продуктов, нужны ферменты протеазы поджелудочной железы. Только они способны разрушить заблокированные белком молекулы. Для дальнейшего усвоения в толстом кишечнике необходима постоянная кислотность, ионы кальция. В виде транскобаламина он доставляется в клетки печени и костный мозг.
Печень накапливает витамин и выделяет его с желчью в кишечник. Дефицит В12, кроме анемии и неврологической симптоматики, способствует нарушению работы желудка и кишечника.
Как обнаружить мегалобластную анемию?
Поиск верного диагноза начинается со сбора анамнеза и выслушивания жалоб пациента. Заподозрить анемию опытный врач может уже на этом этапе.
Осмотр пациента включает в себя следующие шаги:
- Осмотр кожных покровов: они бледные, иногда с желтоватым оттенком («пергаментная кожа»).
- Язык красный и блестящий, болезненный и слегка припухший.
- При выслушивании сердцебиения диагностируются систолические шумы и тахикардия.
- Во время прощупывания брюшины пальпируется увеличенная в размерах селезенка.
- Также имеются признаки фуникулярного миелоза.
Следующим этапом диагностики является сдача крови на клинический анализ. В результатах исследования будет обнаружено уменьшение численности эритроцитов и гемоглобина, цветовой показатель крови превышает отметку 1,1. Иногда анемия сопровождается тромбопенией и лейкопенией. Также в крови визуализируются макроциты и мегалобласты. Клетки крови изменяют свою нормальную форму и размер. Еще один признак мегалобластной анемии – это наличие в крови колец Кеббота и телец Жолли. Уровень ретикулоцитов понижен.
Также наблюдается дефицит фолиевой кислоты и витамина В12 в сывороточной части крови. Показатели сывороточного железа остаются в пределах нормы, либо повышаются, что обуславливается ускоренным разрушением эритроцитов. Это факт также провоцирует скачок билирубина в крови.
Изучение костного мозга, который добывают путем выполнения стернальной пункции, позволяет уточнить диагноз. Исследование необходимо проводить заранее, то есть перед началом лечения. Дело в том, что прием витамина В12 уже через 1-2 суток вернет состав костного мозга в норму, а признаки мегалобластной анемии будут купированы.
У подавляющей части пациентов диагностируется поражение слизистых оболочек органов пищеварительной системы с их атрофическими изменениями. В желудке снижается выработка соляной кислоты.
Таким образом, диагностика мегалобластной анемии состоит из 3 основных этапов:
- Забор крови на общий анализ.
- Выполнение пункции костного мозга.
- Сбор анамнеза и изучение состояния органов пищеварительной системы, в том числе, печени, селезенки и пр.
Обязательно нужно исключить факт наличия у пациента паразитарной инвазии.
Мегалобластные анемии: этиология, патогенез, клиника, классификация, диагностика, лечение
Мегалобластные анемии (МА) – группа анемий, основной причиной которых является дефицит фолиевой кислоты и витамина В12 и связанное с этим нарушение синтеза ДНК (при этом страдают прежде всего быстро обновляющиеся ткани – кроветворная и эпителий ЖКТ).
Морфологически при МА деление клеток замедляется, цитоплазма созревает нормально, в результате клетки становятся крупными, содержание РНК превышает ДНК; эритропоэз неэффективный, т.к. на уровне костного мозга образуются мегалобласты – предшественники эритроцитов, разрушающиеся в самом костном мозге.
Классификация мегалобластных анемий:
а) В12-дефицитная анемия
б) Фолиеводефитиная анемия
в) МА, обусловленная наследственным дефицитом ферментов, участвующих в синтезе пуриновых и пиримидиновых оснований (дигидрофолиевой редуктазы, формиминотрансферазы и др.)
г) МА, поддающаяся лечению витамином В1 (врожденное аутосомно-рециссивное заболевание)
д) МА, обусловленная дефицитов витамина С (он участвует в метаболизме фолиевой кислоты)
е) острая мегалобластная болезнь (быстрое развитие МА вследствие действия различных причин – закиси азота, гемодиализа, длительного парентерального питания и др.)
Этиология мегалобластных анемий:
1. Причины дефицита витамина В12:
а) недостаточное поступление его с пищей
б) нарушение его всасывания при недостатке внутреннего фактора Касла (на уровне желудка), поражении дистальных отделов ileum, конкурентном поглощении витамина В12 при дифиллоботриозе, применении некоторых лекарственных средств (аминосалициловая кислота, неомицин)
2. Причины дефицита фолиевой кислоты:
а) недостаточное поступление с пищей (особенно у алкоголиков, подростков, грудных детей)
б) период повышенной потребности в фолиевой кислоте (беременность, грудной возраст, злокачественные опухоли, гемолитическая анемия, гемодиализ)
в) нарушение всасывания (болезни тонкого кишечника: целиакия, спру; применение некоторых ЛС: барбитураты, фенитоин)
г) нарушения метаболизма фолиевой кислоты (применение ингибиторов дигидрофолатредуктазы — метотрексата, триметоприма; алкоголь; недостаточность дигидрофолатредуктазы) и др.
Патогенез мегалобластных анемий:
Фолиевая (птероилглутаминовая) кислота – источник для человека – зеленые овощи и фрукты, минимальная потребность – 50 мкг/сут (при беременности увеличивается в несколько раз), резерв в организме 5-20 мг (половина резерва содержится в печени); в пище находится в конъюгированной форме в виде полиглютамата; основная функция — перенос метильной или формильной группы от одного вещества к другому.
Метаболизм фолиевой кислоты: полиглютамат + γ-глютамилгидролаза в просвете кишечника ® моноглютамат ® всасывание в проксимальном отделе тонкой кишки ® попадание с помощью переносчика в клетку ® потеря метильной группы (при участии витамина В12) ® повторное образование полиглютамата ® использование на нужды клетки.
При дефиците фолиевой кислоты нарушается синтез ДНК в кроветворных клетках из-за нарушения синтеза пуриновых и пиримидиновых оснований.
Витамин В12 (кобаламин) – источник для человека – продукты животного происхождения (мясо, молоко, яичные желтки); минимальная потребность – 2,5 мкг/сут, резерв в организме: 2 мг в печени + 2 мг в других тканях (поэтому дефицит развивается лишь через 3-6 лет после прекращения поступления в организм);
Метаболизм кобаламина: высвобождение кобаламина из пищи в желудке + желудочный R-белок ® комплекс В12+R-белок поступает в ДПК ® соединение с внутренним фактором Касла (вырабатывается париетальными клетками желудка) ® расщепление образовавшегося комплекса в энтероцитах концевого отдела подвздошной кишки ® связь кобаламина с транскобаламином II (переносчиком) ® перенос кровью к костному мозгу и печени.
Атрофия желудка с нарушением образования внутреннего фактора Касла и развитием МА – болезнь Адиссона-Бирмера (пернициозная анемия, в 60% при ней обнаруживают АТ к париетальным клеткам желудка или к внутреннему фактору Касла)
Клиническая картина В12-дефицитной анемии:
а) поражение пищеварительной системы – чаще всего самые ранние признаки заболевания:
— снижение или отсутствие аппетита, ощущение тяжести и полноты в подложечной области после еды, отрыжка съеденной пищей и воздухом, боль и жжение в языке, в области десен, губ, иногда в области прямой кишки (из-за глоссита, атрофического гастрита и атрофии слизистой кишечника)
— воспалительно-атрофические изменения слизистой полости рта и языка (слизистая рта бледная, с признаками афтозного стоматита; гладкий «лакированный» язык с атрофированными сосочками, потрескавшийся, с участками воспаления ярко-красного цвета, иногда с изъязвлениями — глоссит Hunter)
— пальпаторно — неинтенсивная боль в эпигастральной области, иногда – гепатоспленомегалия
б) поражение кроветворной системы – чаще всего ведущие признаки заболевания:
— общеанемический синдром (как при ЖДА)
— кожа бледная, часто с лимонно-желтым оттенком (в связи с гипербилирубинемией из-за гемолиза), легкая иктеричность склер
— несколько одутловатое лицо, часто – пастозность в области голеней и стоп
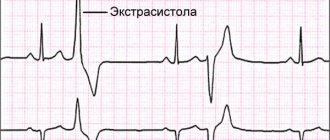
— синдром миокардиодистрофии (тахикардия, экстрасистолия, небольшое расширение границ сердца влево, приглушенность тонов сердца, негромкий систолический шум в области верхушки)
в) поражение нервной системы – фуникулярный миелоз – возникает при тяжелом и длительном течении болезни, характеризуется поражением задних и боковых столбов спинного мозга с демиелинизацией и дегенерацией нервных волокон в спинном мозге и спинномозговых нервах:
1) при преимущественном поражении задних столбов:
— жалобы на слабость в ногах, особенно при подъеме по лестнице, при быстрой ходьбе, ощущение ползания мурашек по ногам, онемение ног; больным кажется, что они не чувствуют при ходьбе опоры под ногами, что нога наступает не на твердую землю, а на что-то рыхлое, мягкое, как вата (больные неоднократно как бы «пробуют землю ногой»)
— снижение сухожильных рефлексов, атрофия мышц нижних конечностей
— нарушение функции тазовых органов (недержание мочи, недержание кала)
2) при преимущественном поражении боковых столбов:
— нижний спастический парапарез с резким повышением сухожильных рефлексов и тонуса мышц нижних конечностей
— нарушение функции тазовых органов (задержка мочеиспускания и дефекации)
Клиническая картина фолиеводефицитной анемии отличается от В12-дефицитной анемии отсутствием поражения пищеварительной и нервной системы.
Диагностика В12-дефицитной анемии:
1. Лабораторные исследования:
а) ОАК: гиперхромная (ЦП > 1,1) макроцитарная анемия, анизоцитоз (разная величина эритроцитов, наряду с макроцитами имеются эритроциты нормальных размеров), пойкилоцитоз (изменение формы эритроцитов);
тельца Жолли, кольца Кебота, базофильная пунктация (остатки ядра в мегалоцитах); лейкопения, нейтропения, эозинопения, относительный лимфоцитоз, гиперсегментированные нейтрофилы (большие сегментоядерные нейтрофилы с полисегментированным ядром); умеренная тромбоцитопения
б) миелограмма (пункцию необходимо делать до начала лечения!): раздражение красного кроветворного ростка, его гиперплазия; клетки красного ряда преобладают над клетками белого ряда, отношение лейкоциты/эритроциты 1:2 — 1:3 (при норме 3:1-4:1); мегалобластный тип кроветворения (гиганская клетка с эксцентрично расположенным ядром без ядрышек, нежной хроматиновой сетью) с преобладанием в разгар болезни базофильных мегалобластов («синий костный мозг»); изменение клеток миелоидного ряда; нарушение созревания мегакариоцитов
в) БАК: признаки гемолиза (неконьюгированная гипербилирубинемия, умеренное повышение СЖ)
г) тест Шеллинга — позволяет оценить всасывание витамина В12 в кишечнике в присутствии гастромукопротеина или без него и сделать заключение о патогенетическом варианте В12-дефицитной анемии:
1) Шеллинг – I: больному дают принять внутрь витамин В12, меченный 60Со и через 1-6 часов в/м вводят «ударную дозу» немеченого витамина В12 для насыщения печеночного депо, затем измеряют содержание радиоактивного витамина В12 в суточной моче; снижение его экскреции указывает на нарушение всасывания витамина В12 в кишечнике
2) Шеллинг – II: повторяется тест Шеллинг-I с использованием гастромукопротеина, меченого радиоактивным кобальтом; повышение экскреции радиоактивного витамина В12 указывает на дефицит гастромукопротеина в качестве основного механизма развития В12-дефицитной анемии; если экскреция радиоактивного витамина В12 не увеличилась, причина развития МА — нарушение всасывания витамина
В12 в кишечнике.
2. Инструментальные исследования: ФГДС с биопсией (атрофические изменения слизистой ЖКТ); исследование желудочной секреции (резкое уменьшение количества желудочного сока, ахилия) и др.
Диагностика фолиеводефицитной МА:
а) ОАК – те же признаки, что и при В12-дефицитной анемии
б) миелограмма – те же признаки, что и при В12-дефицитной анемии; при окраске пунктата по Кассу (ализариновым красным) мегалобласты окрашиваются только при В12-дефицитной анемии и не окрашиваются при фолиеводефитиной анемии
в) БАК: признаки гемолиза (неконьюгированная гипербилирубинемия, умеренное повышение СЖ)
г) проба с гистидином — больной принимает 15 г гистидина, после чего определяется экскреция с мочой формиминглутаминовой кислоты за 8 ч после приема гистидина; в норме основная часть гистидина превращается при участии фолиевой кислоты в глутаминовую кислоту, с мочой выводится от 1 до 18 мг формиминглутаминовой кислоты; при фолиеводефицитной анемии выделение формиминглутаминовой кислоты значительно увеличивается ( до 1500 мг)
Лечение МА:
При В12-дефицитной анемии — препараты витамина В12 (цианокобаламин, оксикобаламин) 400-500 мкг/сут в/м (30-40 инъекций), затем – поддерживающая доза 500 мкг 1 раз в неделю 3 месяца, затем 500 мкг 1 раз в 2 недели еще 3 мес.
При фуникулярной миелозе 1000 мкг/сут + кобамид (кофермент витамина) 500 мкг/сут в/м до исчезновения признаков поражения спинного мозга.
При фолиеводефицитной анемии: фолиевая кислота внутрь по 10-15 мг/сут до 6 недель.
Мегалобластные анемии (МА) – группа анемий, основной причиной которых является дефицит фолиевой кислоты и витамина В12 и связанное с этим нарушение синтеза ДНК (при этом страдают прежде всего быстро обновляющиеся ткани – кроветворная и эпителий ЖКТ).
Морфологически при МА деление клеток замедляется, цитоплазма созревает нормально, в результате клетки становятся крупными, содержание РНК превышает ДНК; эритропоэз неэффективный, т.к. на уровне костного мозга образуются мегалобласты – предшественники эритроцитов, разрушающиеся в самом костном мозге.
Классификация мегалобластных анемий:
а) В12-дефицитная анемия
б) Фолиеводефитиная анемия
в) МА, обусловленная наследственным дефицитом ферментов, участвующих в синтезе пуриновых и пиримидиновых оснований (дигидрофолиевой редуктазы, формиминотрансферазы и др.)
г) МА, поддающаяся лечению витамином В1 (врожденное аутосомно-рециссивное заболевание)
д) МА, обусловленная дефицитов витамина С (он участвует в метаболизме фолиевой кислоты)
е) острая мегалобластная болезнь (быстрое развитие МА вследствие действия различных причин – закиси азота, гемодиализа, длительного парентерального питания и др.)
Этиология мегалобластных анемий:
1. Причины дефицита витамина В12:
а) недостаточное поступление его с пищей
б) нарушение его всасывания при недостатке внутреннего фактора Касла (на уровне желудка), поражении дистальных отделов ileum, конкурентном поглощении витамина В12 при дифиллоботриозе, применении некоторых лекарственных средств (аминосалициловая кислота, неомицин)
2. Причины дефицита фолиевой кислоты:
а) недостаточное поступление с пищей (особенно у алкоголиков, подростков, грудных детей)
б) период повышенной потребности в фолиевой кислоте (беременность, грудной возраст, злокачественные опухоли, гемолитическая анемия, гемодиализ)
в) нарушение всасывания (болезни тонкого кишечника: целиакия, спру; применение некоторых ЛС: барбитураты, фенитоин)
г) нарушения метаболизма фолиевой кислоты (применение ингибиторов дигидрофолатредуктазы — метотрексата, триметоприма; алкоголь; недостаточность дигидрофолатредуктазы) и др.
Патогенез мегалобластных анемий:
Фолиевая (птероилглутаминовая) кислота – источник для человека – зеленые овощи и фрукты, минимальная потребность – 50 мкг/сут (при беременности увеличивается в несколько раз), резерв в организме 5-20 мг (половина резерва содержится в печени); в пище находится в конъюгированной форме в виде полиглютамата; основная функция — перенос метильной или формильной группы от одного вещества к другому.
Метаболизм фолиевой кислоты: полиглютамат + γ-глютамилгидролаза в просвете кишечника ® моноглютамат ® всасывание в проксимальном отделе тонкой кишки ® попадание с помощью переносчика в клетку ® потеря метильной группы (при участии витамина В12) ® повторное образование полиглютамата ® использование на нужды клетки.
При дефиците фолиевой кислоты нарушается синтез ДНК в кроветворных клетках из-за нарушения синтеза пуриновых и пиримидиновых оснований.
Витамин В12 (кобаламин) – источник для человека – продукты животного происхождения (мясо, молоко, яичные желтки); минимальная потребность – 2,5 мкг/сут, резерв в организме: 2 мг в печени + 2 мг в других тканях (поэтому дефицит развивается лишь через 3-6 лет после прекращения поступления в организм);
Метаболизм кобаламина: высвобождение кобаламина из пищи в желудке + желудочный R-белок ® комплекс В12+R-белок поступает в ДПК ® соединение с внутренним фактором Касла (вырабатывается париетальными клетками желудка) ® расщепление образовавшегося комплекса в энтероцитах концевого отдела подвздошной кишки ® связь кобаламина с транскобаламином II (переносчиком) ® перенос кровью к костному мозгу и печени.
Атрофия желудка с нарушением образования внутреннего фактора Касла и развитием МА – болезнь Адиссона-Бирмера (пернициозная анемия, в 60% при ней обнаруживают АТ к париетальным клеткам желудка или к внутреннему фактору Касла)
Клиническая картина В12-дефицитной анемии:
а) поражение пищеварительной системы – чаще всего самые ранние признаки заболевания:
— снижение или отсутствие аппетита, ощущение тяжести и полноты в подложечной области после еды, отрыжка съеденной пищей и воздухом, боль и жжение в языке, в области десен, губ, иногда в области прямой кишки (из-за глоссита, атрофического гастрита и атрофии слизистой кишечника)
— воспалительно-атрофические изменения слизистой полости рта и языка (слизистая рта бледная, с признаками афтозного стоматита; гладкий «лакированный» язык с атрофированными сосочками, потрескавшийся, с участками воспаления ярко-красного цвета, иногда с изъязвлениями — глоссит Hunter)
— пальпаторно — неинтенсивная боль в эпигастральной области, иногда – гепатоспленомегалия
б) поражение кроветворной системы – чаще всего ведущие признаки заболевания:
— общеанемический синдром (как при ЖДА)
— кожа бледная, часто с лимонно-желтым оттенком (в связи с гипербилирубинемией из-за гемолиза), легкая иктеричность склер
— несколько одутловатое лицо, часто – пастозность в области голеней и стоп
— синдром миокардиодистрофии (тахикардия, экстрасистолия, небольшое расширение границ сердца влево, приглушенность тонов сердца, негромкий систолический шум в области верхушки)
в) поражение нервной системы – фуникулярный миелоз – возникает при тяжелом и длительном течении болезни, характеризуется поражением задних и боковых столбов спинного мозга с демиелинизацией и дегенерацией нервных волокон в спинном мозге и спинномозговых нервах:
1) при преимущественном поражении задних столбов:
— жалобы на слабость в ногах, особенно при подъеме по лестнице, при быстрой ходьбе, ощущение ползания мурашек по ногам, онемение ног; больным кажется, что они не чувствуют при ходьбе опоры под ногами, что нога наступает не на твердую землю, а на что-то рыхлое, мягкое, как вата (больные неоднократно как бы «пробуют землю ногой»)
— снижение сухожильных рефлексов, атрофия мышц нижних конечностей
— нарушение функции тазовых органов (недержание мочи, недержание кала)
2) при преимущественном поражении боковых столбов:
— нижний спастический парапарез с резким повышением сухожильных рефлексов и тонуса мышц нижних конечностей
— нарушение функции тазовых органов (задержка мочеиспускания и дефекации)
Клиническая картина фолиеводефицитной анемии отличается от В12-дефицитной анемии отсутствием поражения пищеварительной и нервной системы.
Диагностика В12-дефицитной анемии:
1. Лабораторные исследования:
а) ОАК: гиперхромная (ЦП > 1,1) макроцитарная анемия, анизоцитоз (разная величина эритроцитов, наряду с макроцитами имеются эритроциты нормальных размеров), пойкилоцитоз (изменение формы эритроцитов);
тельца Жолли, кольца Кебота, базофильная пунктация (остатки ядра в мегалоцитах); лейкопения, нейтропения, эозинопения, относительный лимфоцитоз, гиперсегментированные нейтрофилы (большие сегментоядерные нейтрофилы с полисегментированным ядром); умеренная тромбоцитопения
б) миелограмма (пункцию необходимо делать до начала лечения!): раздражение красного кроветворного ростка, его гиперплазия; клетки красного ряда преобладают над клетками белого ряда, отношение лейкоциты/эритроциты 1:2 — 1:3 (при норме 3:1-4:1); мегалобластный тип кроветворения (гиганская клетка с эксцентрично расположенным ядром без ядрышек, нежной хроматиновой сетью) с преобладанием в разгар болезни базофильных мегалобластов («синий костный мозг»); изменение клеток миелоидного ряда; нарушение созревания мегакариоцитов
в) БАК: признаки гемолиза (неконьюгированная гипербилирубинемия, умеренное повышение СЖ)
г) тест Шеллинга — позволяет оценить всасывание витамина В12 в кишечнике в присутствии гастромукопротеина или без него и сделать заключение о патогенетическом варианте В12-дефицитной анемии:
1) Шеллинг – I: больному дают принять внутрь витамин В12, меченный 60Со и через 1-6 часов в/м вводят «ударную дозу» немеченого витамина В12 для насыщения печеночного депо, затем измеряют содержание радиоактивного витамина В12 в суточной моче; снижение его экскреции указывает на нарушение всасывания витамина В12 в кишечнике
2) Шеллинг – II: повторяется тест Шеллинг-I с использованием гастромукопротеина, меченого радиоактивным кобальтом; повышение экскреции радиоактивного витамина В12 указывает на дефицит гастромукопротеина в качестве основного механизма развития В12-дефицитной анемии; если экскреция радиоактивного витамина В12 не увеличилась, причина развития МА — нарушение всасывания витамина
В12 в кишечнике.
2. Инструментальные исследования: ФГДС с биопсией (атрофические изменения слизистой ЖКТ); исследование желудочной секреции (резкое уменьшение количества желудочного сока, ахилия) и др.
Диагностика фолиеводефицитной МА:
а) ОАК – те же признаки, что и при В12-дефицитной анемии
б) миелограмма – те же признаки, что и при В12-дефицитной анемии; при окраске пунктата по Кассу (ализариновым красным) мегалобласты окрашиваются только при В12-дефицитной анемии и не окрашиваются при фолиеводефитиной анемии
в) БАК: признаки гемолиза (неконьюгированная гипербилирубинемия, умеренное повышение СЖ)
г) проба с гистидином — больной принимает 15 г гистидина, после чего определяется экскреция с мочой формиминглутаминовой кислоты за 8 ч после приема гистидина; в норме основная часть гистидина превращается при участии фолиевой кислоты в глутаминовую кислоту, с мочой выводится от 1 до 18 мг формиминглутаминовой кислоты; при фолиеводефицитной анемии выделение формиминглутаминовой кислоты значительно увеличивается ( до 1500 мг)
Лечение МА:
При В12-дефицитной анемии — препараты витамина В12 (цианокобаламин, оксикобаламин) 400-500 мкг/сут в/м (30-40 инъекций), затем – поддерживающая доза 500 мкг 1 раз в неделю 3 месяца, затем 500 мкг 1 раз в 2 недели еще 3 мес.
При фуникулярной миелозе 1000 мкг/сут + кобамид (кофермент витамина) 500 мкг/сут в/м до исчезновения признаков поражения спинного мозга.
При фолиеводефицитной анемии: фолиевая кислота внутрь по 10-15 мг/сут до 6 недель.
Как лечить?
Лечение должно базироваться на причинах, приведших к развитию анемии. Возможно потребуется прием противопаразитарных препаратов, устранение полипов или иных новообразований органов пищеварительной системы, лечение болезней кишечника, помещение пациента в наркологическую клинику, если он страдает от алкогольной зависимости и пр.
Обязательно нужно откорректировать рацион больного. В его меню необходимо ввести мясо, печень, кисломолочные продукты, свежие овощи и фрукты.
Для ликвидации дефицита витамина В12 возможно внутримышечное или внутривенное введение цианокобаламина. В сутки может быть назначено от 200 до 1000 мкг препарата, что зависит от степени тяжести анемии.
После того как показатели крови придут в норму, дозировка лекарственного средства может быть уменьшена, либо сокращается кратность постанови инъекций. То есть вводят препарат 1 раз в 2 суток, а затем 2 раза в 7 дней.
Улучшение наступает уже спустя неделю от начала лечения, что характеризуется развитием ретикулоцитарного криза. В крови на 2-3% повышается уровень молодых эритроцитов. На эффективность проводимой терапии указывает нормализация показателей крови.
Иногда прием витамина В12 назначают на всю оставшуюся жизнь, например, при анемии Аддисона-Бирмера. При фуникулярном миелозе требуется ежедневно вводить пациенту от 800 до 100 мг цианокобаламина. Уменьшить дозировку препарата можно будет лишь после того, как удастся полностью избавить пациента от неврологической симптоматики.
Иногда мегалобластная анемия протекает очень тяжело, а сам больной может впасть в кому. В этом случае ему требуется переливание эритроцитарной массы.
Когда основной для развития анемии являются аутоиммунные заболевания, пациенту требуется введение глюкокортикостероидов. Дозировка лекарственного средства должна быть минимальной, а курс лечения непродолжительным.
При фолиеводефицитной анемии назначают прием Фолиевой кислоты. Суточная доза составляет от 1 до 5 мг лекарственного средства, в зависимости от тяжести течения болезни. После того, как все симптомы анемии будут купированы, потребуется курсовой прием фолиевой кислоты, чтобы не допустить повторного возникновения болезни. Но дозу препарата следует уменьшить.
Схема кроветворения. Нормобластический и мегалобластический эритропоэз.
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ОБРАЗОВАНИЯ ЧИТИНСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ
Кафедра Патологической физиологии
Реферат
Патофизиология системы крови.
ТЕМА: Количественные и качественные изменения в
Системе «Эритрон». Анемии.
Выполнил: Доржиева Г. Ш.
Студент 349 гр.
Содержание
1. Понятие «Эритрон».
2. Регуляция эритропоэза.
3. Схема кроветворения. Нормобластический и мегалобластический эритропоэз.
4. Морфологическая характеристика клеток крови, их функциональные особенности .
5. Гематологическая норма показателей периферической крови.
6. Анемии.
Понятие «Эритрон».
Понятие «эритрон» введено английским терапевтом Каслом для обозначения массы эритроцитов, находящихся в циркулирующей крови, в кровяных депо и костном мозге. Принципиальная разница между эритроном и другими тканями организма заключается в том, что разрушение эритроцитов осуществляется преимущественно макрофагами за счет процесса, получившего наименование «эритрофагоцитоз». Образующиеся при этом продукты разрушения и в первую очередь железо используются на построение новых клеток. Таким образом, эритрон является замкнутой системой, в которой в условиях нормы количество разрушающихся эритроцитов соответствует числу вновь образовавшихся.
Развитие эритроцитов происходит в замкнутых капиллярах красного костного мозга. Как только эритроцит достигает стадии ретикулоцита, он растягивает стенку капилляра, благодаря чему сосуд раскрывается и ретикулоцит вымывается в кровоток, где и превращается за 35—45 ч в молодой эритроцит — нормоцит. В норме в крови содержится не более 1—2% ретикулоцитов.
В кровотоке эритроциты живут 80—120 дней. Продолжительность жизни эритроцитов у мужчин несколько больше, чем у женщин.
Регуляция эритропоэза
Для нормального эритропоэза необходимо железо. Последнее поступает в костный мозг при разрушении эритроцитов, из депо, а также с пищей и водой. Взрослому человеку для нормального эритропоэза требуется в суточном рационе 12—15 мг железа. Железо откладывается в различных органах и тканях, главным образом в печени и селезенке. Если железа в организм поступает недостаточно, то развивается железодефицитная анемия.
Всасыванию железа в кишечнике способствует аскорбиновая кислота, переводящая Fe3+ в Fe2+, который сохраняет растворимость при нейтральных и щелочных значениях рН. На участке слизистой оболочки тонкой кишки имеются рецепторы, облегчающие переход железа в энтероцит, а оттуда в плазму. В слизистой оболочке тонкой кишки находится белок-переносчик железа — трансферрин. Он доставляет железо в ткани, имеющие трансферриновые рецепторы. В клетке комплекс трансферрина и железа распадается, и железо вступает в связь с другим белком-переносчиком — ферритином. Клетки-предшественники зрелых эритроцитов накапливают железо в ферритине. В дальнейшем оно используется, когда клетка начинает образовывать большое количество гемоглобина.
Важным компонентом эритропоэза является медь, которая усваивается непосредственно в костном мозге и принимает участие в синтезе гемоглобина. Если медь отсутствует, то эритроциты созревают лишь до стадии ретикулоцита. Медь катализирует образование гемоглобина, способствуя включению железа в структуру гема. Недостаток меди приводит к анемии.
Для нормального эритропоэза необходимы витамины и в первую очередь витамин B12 и фолиевая кислота. Эти витамины оказывают сходное взаимодополняющее действие на эритропоэз. Витамин B12 (внешний фактор кроветворения) синтезируется микроорганизмами, лучистыми грибками и некоторыми водорослями. Для его образования необходим кобальт. В организм человека витамин B12 поступает с пищей — особенно его много в печени, мясе, яичном желтке.
Для всасывания витамина В12 требуется внутренний фактор кроветворения, который носит наименование «гастромукопротеин». Это вещество является комплексным соединением, образующимся в желудке.
Фолиевая кислота, или витамин В7, является водорастворимым витамином, содержащимся во многих растительных продуктах, а также в печени, почках, яйцах.
Витамин В12 и фолиевая кислота принимают участие в синтезе глобина. Они обусловливают образование в эритробластах нуклеиновых кислот, являющихся одним из основных строительных материалов клетки.
Немаловажную роль в регуляции эритропоэза играют другие витамины группы В, а также железы внутренней секреции. Все гормоны, регулирующие обмен белков (соматотропный гормон гипофиза, гормон щитовидной железы — тироксин и др.) и кальция (паратгормон, тиреокальцитонин), необходимы для нормального эритропоэза. Мужские половые гормоны (андрогены) стимулируют эритропоэз, тогда как женские (эстрогены) — тормозят его, что обусловливает меньшее число эритроцитов у женщин по сравнению с мужчинами.
Особо важную роль в регуляции эритропоэза играют специфические вещества, получившие наименование «эритропоэтины». Еще в 1906 г. показано, что сыворотка крови кроликов, перенесших кровопотерю, стимулирует электропоэз. В дальнейшем было установлено, что эритропоэтины присутствуют в крови животных и людей, испытывающих гипоксию — недостаточное поступление к тканям кислорода, что наблюдается при анемиях, подъеме на высоту, мышечной работе, снижении парциального давления кислорода в барокамере, заболеваниях сердца и легких. В небольшой концентрации эритропоэтины обнаружены в крови здоровых людей, что позволяет считать их физиологическими регуляторами эритропоэза. Вместе с тем при анемиях, сопровождающих заболевания почек, эритропоэтины отсутствуют или их концентрация значительно снижается. Эти данные позволили предположить, что местом синтеза эритропоэтинов являются почки. Эритропоэтины образуются также в печени, селезенке, костном мозге. Получены факты, свидетельствующие о том, что мощной эритропоэтической активностью обладают полипептиды эритроцитов, молекулярная масса которых не превышает 10 000.
Схема кроветворения. Нормобластический и мегалобластический эритропоэз.
Эритропоэтины оказывают действие непосредственно на клетки-предшественники эритроидного ряда (КОЕ-Э – колониеобразующая единица эритроцитарная). Функции эритропоэтинов сводятся к следующему:
1) ускорение и усиление перехода стволовых клеток костного мозга в эритробласты;
2) увеличение числа митозов клеток эритроидного ряда;
3) исключение одного или нескольких циклов митотических делений;
4) ускорение созревания неделящихся клеток — нормобластов, ретикулоцитов.
Ряд гемопоэтических факторов образуется стромой костного мозга и костномозговыми фибробластами. «Микроокружение» костного мозга является важнейшей частью кроветворного механизма. Эритроидные предшественники, размещенные на ячеистой сети костномозговых фибробластов, быстро развиваются и втискиваются между ними. Это объясняется тем, что для дифференцировки эритроидных клеток требуется их плотное прикрепление (адгезия) к окружающим структурам. Кроме того, фибробласты и эндотелиальные клетки являются источником ростковых факторов кроветворения.
На эритропоэз действуют соединения, синтезируемые моноцитами, макрофагами, лимфоцитами и другими клетками, получившие название «интерлейкины». Согласно международной классификации, они обозначаются арабскими цифрами (ИЛ-1, ИЛ-2 и т. д.). На полипотентную стволовую клетку (ПСК) непосредственно влияют и способствуют ее дифференцировке ИЛ-3, ИЛ-6, ИЛ-11 и ИЛ-12.
В частности, активированные макрофаги выделяют ИЛ-1, а также фактор некроза опухолей (ФНО). ИЛ-1 и ФНО стимулируют фибробласты и эндотелиальные клетки, благодаря чему они усиленно продуцируют так называемый белковый фактор Стила, оказывающий влияние непосредственно на ПСК и способствующий ее дифференцировке. Кроме того, фибробласты, эндотелиальные клетки и активированные Т-лимфоциты способны выделять ИЛ-6, ИЛ-11 и гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ). Фактор Стила, ИЛ-3, ИЛ-6, ИЛ-11, ИЛ-1 и ГМ-КСФ относятся к раннедействующим гемопоэтическим ростовым факторам. По мере того как родоначальники нескольких линий кроветворных клеток дифференцируются в родоначальники одной линии, в реакцию вступают позднедействующие гемопоэтические ростовые факторы и эритропоэтин.
Важная роль в эритропоэзе принадлежит ядерным факторам — ГАТА-1 (внутриядерный регулятор транскрипции в эритроне) и НФЕ-2. Отсутствие ГАТА-1 предотвращает образование эритроцитов, недостаток НФЕ-2 нарушает всасывание железа в кишечнике и синтез глобина.
Мегалобластический тип эритропоэза отличается от нормобластического рядом особенностей:
1. дефект синтеза ДНК приводит к резкому замедлению темпов деления эритрокариоцитов, сокращению числа митозов, в результате чего образуются очень крупные клетки, получившие название мегалобластов (от греч. megas — «большой», biastos — «росток»), из которых образуются мегалоциты;
2. нарушается синхронность созревания ядра и цитоплазмы эритроцитов. Удлинение времени клеточного деления, уменьшение количества митозов в связи с затруднениями в редупликации ДНК приводят к тому, что созревание цитоплазмы и синтез гемоглобина в эритрокариоцитах идут обычными темпами, а скорость созревания ядра снижается. В результате появляются клетки с незрелым ядром и широкой, зрелой цитоплазмой;
3. Ррезко увеличивается доля неэффективного эритропоэза. Продолжительность жизни мегалобластов невелика. Значительная часть мегалобластов не созревает до зрелых форм и погибает в костном мозге. Только оставшаяся небольшая часть мегалобластов дозревает до мегалоцитов, которые с трудом поступают в периферическую кровь. Усиленный распад мегалобластов, не успевших превратиться в эритроциты, наряду с их замедленной дифференциацией приводит к тому, что процессы кроветворения не компенсируют процессы кроворазрушения;
4. жизненный цикл мегалоцитов укорочен, он примерно в 3-4 раза меньше по сравнению с эритроцитами и составляет всего 30-40 дней. Они менее устойчивы к различным воздействиям и быстрее разрушаются. В связи с этим резко снижается количество эритроцитов в периферической крови.
Схема кроветворения
Форменные элементы крови
К форменным элементам крови относятся эритроциты, лейкоциты, тромбоциты. Гемограмма
взрослого человека в норме (средние показатели): эритроциты – 4,0-5,5 х 1012/л, лейкоциты – 4,0-8,0 х 109/л, тромбоциты – 200-400 х 109/л.
1. Эритроциты – самые многочисленные клетки крови, утратившие в процессе дифференцировки ядро и практически все органеллы. Большинство эритроцитов (75-85 %) имеют форму двояковогнутого диска для обеспечения большей площади поверхности, способности к обратимой деформации при прохождении через капилляры. При нарушении осмотического равновесия или целостности цитоскелета изменяется форма эритроцита, что может свидетельствовать о старении клетки или патологии.Функции эритроцитов:
1. Перенос газов (преимущественно кислорода) с помощью гемоглобина;
2. Перенос других веществ на своей поверхности (иммуноглобулинов, гормонов, биологически активных веществ и др.).
Ретикулоциты – молодые формы эритроцитов. Созревание ретикулоцитов происходит в течение двух суток после выхода из красного костного мозга и заключается в завершении синтеза гемоглобина и разрушении остатков органелл, которые выявляются в ретикулоцитах при специфической окраске. В норме ретикулоциты составляют до 1% всех эритроцитов.
1. Лейкоциты – полиморфная группа клеток, их классификация основана на наличии или
2. отсутствии гранул в цитоплазме.
Классификация лейкоцитов
1) Гранулоциты
: нейтрофилы, базофилы, эозинофилы;
2) Агранулоциты:
моноциты, лимфоциты.
Свои функции большинство лейкоцитов выполняют в тканях, мигрируя через стенки микрососудов.
Лейкоцитарная формула – процентное соотношение различных форм лейкоцитов (приведена в таблице). Всего 100% – 4-8 х 109/л.
Лейкоцитарная формула
| Лейкоциты4-8 х 109/л – 100% | ||||||
| эозинофилы | нейтрофилы | базофилы | моноциты | лимфоциты | ||
| 1-5% | юные | палочкоядерные | сегментоядерные | 0-1% | 6-8% | 20-35% |
| 0-1% | 3-5% | 60-65% | ||||
Нейтрофилы – гранулярные лейкоциты 10-12 мкм в диаметре. Являются самой многочисленной группой лейкоцитов и представлены клетками с разным уровнем дифференцировки. Юные нейтрофилы
имеют ядро бобовидной формы со светлым содержимым.
Палочкоядерные нейтрофилы
имеют ядро в виде палочки или подковы, с большим содержанием гетерохроматина.
Сегментоядерные нейтрофилы –
наиболее зрелые формы, содержат дольчатое ядро, состоящее из 2-5 сегментов, соединенных перетяжками. У 3% нейтрофилов женщин выявляется дополнительный сегмент в виде барабанной палочки (тельце Барра). Считается, что это неактивная Х-хромосома.
В процессе дифференцировки нейтрофилов, кроме сегментации ядра происходит накопление гликогена, уменьшение органелл синтетического аппарата и накопление гранул
: а)
первичные
(азурофильные, неспецифичные) – аналоги лизосом содержат катепсин – антимикробное вещество с широким спектром действия; лизоцим – фермент, разрушающий клеточную стенку бактерий; эластазу и коллагеназу, которые разрушают эластин и коллаген тканей нейтрофилов; пероксидазу – значительно усиливает активность антимикробных ферментов и т.д. б)
вторичные
(специфические) гранулы содержат адгезивные белки, обеспечивающие адгезию нейтрофилов на эндотелиоцитах; лактоферрин, связывающий факторы роста бактерий, коллагеназу, лизоцим.
Нейтрофилы передвигаются в тканях путем хемотаксиса, по градиенту концентрации веществ, образующихся при расщеплении микроорганизмов. Факторами хемотаксиса служат вещества, выделенные активированными нейтрофилами и другими клетками (тучными, макрофагами).
Функции нейтрофилов:
1) Повреждающее воздействие на микробы (катепсин, лизоцим и др.);
2) Фагоцитоз микроорганизмов, поврежденных клеток – одна из основных функций нейтрофилов, поэтому их еще называют микрофагами
;
3) Участие в специфических иммунных реакциях: вырабатывают биологически активные вещества (цитокины) и регулируют кооперацию клеток при иммунном ответе.
Эозинофил– гранулярный лейкоцит 12-17 мкм в диаметре, содержит палочковидное или сегментированное (обычно два сегмента с перемычкой) ядро, хорошо развитые органеллы в цитоплазме и гранулы. Из кровотока мигрируют в основном в рыхлую соединительную ткань органов, контактирующие с внешней средой (слизистая дыхательных, мочеполовых путей, кишечника). В рыхлой соединительной ткани эозинофилов в 200 раз больше, чем в крови.
В цитоплазме содержатся гранулы двух типов: а) неспецифические (аналогичные у нейтрофилов) и б) специфические
– овоидной формы, содержат кристаллоид, образованный главным основным белком (обусловливает эозинофилию). Обладает мощным противогельминтозным, противопротозойным и антимикробным действием. В аморфном матриксе, расположенном по периферии от кристаллоида содержатся фермент гистаминаза, иннактивирующий гистамин, а также коллагеназа и другие биологически активные вещества. Эозинофилы способны к хемотаксису. Факторами хемотаксиса являются паразиты и продукты их жизнедеятельности, вещества, выделяемые лимфоцитами, макрофагами, тромбоцитами, эндотелиоцитами. Особенно эффективен гистамин тучных клеток.
Функции эозинофилов:
1) инактивация гистамина ферментом гистаминазой,
2) уничтожение паразитов (гельминтов и простейших) нефагоцитарным путем.
2) Фагоцитоз.
3) Ограничивают область иммунной реакции, создавая препятствие распространению антигенам и медиаторам воспаления, разрушая их.
Базофил – гранулярный лейкоцит 10-12 мкм в диаметре, аналогичный тучной клетке, но отличаются друг от друга по соотношению и составу гранул. Базофил содержит S — образное трехдольное ядро, слабооксифильную цитоплазму, в которой находятся все органеллы в умеренном количестве, липидные капли, гликоген и два типа гранул: 1) неспецифические азурофильные
– аналогичны лизосомам; 2)
специфические
гранулы – плотные гранулы округлой или овальной формы, содержащие
гепарин
– антикоагулянт,
гистамин
– вещество, расширяющее сосуды, увеличивающее их проницаемость, а также факторы хемотаксиса нейтрофилов и эозинофилов и другие факторы.
Функции базофилов: 1) Участие в защитных реакциях организма (в первую очередь при аллергических и воспалительных реакциях): базофилы выделяют локально в большом количестве биологически активные вещества гранул, привлекают ряд других клеток (эозинофилы, нейтрофилы и др.).
Моноциты – агранулярные лейкоциты диаметром 18-20 мкм. В крови находятся транзитом по пути следования в органы и ткани, где будут функционировать, из красного костного мозга. Совокупность всех потомков моноцитов крови в тканях называется системой мононуклеарных (одноядерных) фагоцитов
: макрофаги (гистиоциты) соединительной ткани, дендритные клетки кроветворных органов, альвеолярные макрофаги легких, селезенки и красного костного мозга, макрофаги (клетки Купфера) печени, остеокласты костной ткани, перитонеальные макрофаги, макрофаги (клетки Хофбауэра) плаценты и микроглия нервной ткани.
Моноцит имеет крупное, эксцентрично расположенное бледное ядро с выемкой, которая увеличивается по мере созревания клетки. В слабобазофильной цитоплазме содержится большое количество лизосом и вакуолей, рибосом и полирибосом, умеренное количество цистерн грЭПС и хорошо развитый аппарат Гольджи, цитоскелет, мелкие удлиненные митохондрии. Имеются центриоли.
Функции моноцитов:
1) фагоцитоз и эндоцитоз;
2) участие в кооперации клеток при иммунном ответе, являясь антигепредставляющими клетками, а также выделяют биологически активные вещества, регулирующие гемопоэз и хемотаксис других участников иммунных реакций.
Лимфоциты – агранулярные лейкоциты диаметром 5-10 мкм, представлены большой группой морфологически сходных, но функционально различных клеток. Рециркуляция
– способность лимфоцитов выходить из крови в ткани, затем снова возвращаться в кровь через лимфу. В крови находится лишь 2% лимфоцитов, 98% рассредоточено по другим органам и тканям. Лимфоциты – округлые клетки с крупным ядром, занимающим до 90% объема клетки. Цитоплазма слабобазофильная. Все органеллы представлены в умеренном количестве, кроме цитоскелета, который хорошо развит.
Виды лимфоцитов:
1) по размерам клетки различают: малые (6-7мкм), их 80-90% от общего количества лимфоцитов крови; средние (8-9 мкм) – 10% и большие (10-18 мкм) – в норме в крови отсутствуют.
2) по функции выделяют Т
— и
В
-лимфоциты.
Отличия Т
— и
В
-лимфоцитов:
— по месту антигеннезависимой дифференцировке:
Т-лимфоциты в тимусе,
В-лимфоциты в лимфоидной ткани других органов.
— по выполняемым функциям:
Т-лимфоциты обеспечивают преимущественно клеточный иммунитет,
В-лимфоциты – гуморальный иммунитет.
Функционально Т- и В-клетки делят на субпопуляции.
Среди Т-лимфоцитов выделяют Тх (хелперы) – активируют эффекторные клетки,
Тк (киллеры) – эффекторные цитотоксические клетки,
Тс (супрессоры) – подавляют иммунный ответ,
Т-лимфоциты памяти.
В-лимфоциты дифференцируются в плазматические клетки, вырабатывающие иммуноглобулины (антитела) и в клетки памяти, несущие информацию о встрече с каким- либо антигеном.
— по содержанию в крови: Т-лимфоцитов – 70-80%, В-лимфоцитов — 10-20%.
Функция лимфоцитов: 1) участие и обеспечение иммунных реакций.
Тромбоциты (кровяные пластинки)– это овальные, двояковыпуклые тельца, являющиеся фрагментами цитоплазмы мегакариоцитов красного костного мозга. Центральная часть тромбоцита – грануломер, содержащий азурофильные зерна; наружная часть – гиаломер, имеющий гомогенную консистенцию и бледно-голубую окраску, здесь располагается краевое кольцо из элементов цитоскелета, образуя жёсткий каркас тромбоцита, а также подмембранный аппарат, позволяющий тромбоцитам перемещаться.
Плазмолемма покрыта слоем гликокаликса, состоящего из рецепторов, обусловливающих прикрепление тромбоцита к эндотелию (адгезию) и склеивание тромбоцитов друг с другом (агрегацию). В грануломере содержатся 1-2 митохондрии, гранулы гликогена в виде агрегатов, единичные рибосомы и гранулы нескольких типов
:
1) Азурофильные гранулы содержат вещества, участвующие в свертывании (фибронектин, фибриноген), фактор роста тромбоцитов и ряд других биологически активных веществ;
2) Гранулы с плотным матриксом, содержащим АТФ, ионы кальция, магния, гистамин, серотонин;
3) Гранулы, содержащие гидролитические ферменты, соответствуют лизосомам.
Функции тромбоцитов:
1. Восстановление целостности сосудистой стенки при повреждении (первичный гемостаз).
2. Свертывание крови, в совместной реакции с эндотелием и плазмой крови (вторичный гемостаз) путем прилипания агрегатов тромбоцитов к месту повреждения.
3. Участие в иммунных реакциях (вырабатывают факторы хемотаксиса клеток иммунной системы).
Профилактика и прогноз
Чтобы не допустить развития анемии, необходимо соблюдать следующие рекомендации:
- Правильно питаться, употребляя в пищу продукты, богатые витамином В9 и В12.
- Вести здоровый образ жизни, отказаться от алкоголизма.
- Не допускать ситуаций, которые могли бы привести к заражению паразитами.
- Вовремя лечить все заболевания органов пищеварительной системы.
Что касается прогноза, то при своевременной терапии он благоприятный и от анемии удается полностью избавиться.
Какой врач лечит мегалобластную анемию?
При появлении первых признаков анемии следует обратиться к участковому терапевту. Если врач выявит подобное нарушение, то он перенаправит пациента к гематологу, который назначит лечение. Возможна консультация у узких специалистов, среди которых: невролог, инфекционист, гепатолог, гастроэнтеролог. Для подбора адекватной диеты следует посетить диетолога.
Автор статьи:
Шутов Максим Евгеньевич | Гематолог
Образование: В 2013 году закончен Курский государственный медицинский университет и получен диплом «Лечебное дело». Спустя 2 года окончена ординатура по специальности «Онкология». В 2016 году пройдена аспирантура в Национальном медико-хирургическом центре имени Н. И. Пирогова. Наши авторы