Введение
Гомоцистеин является продуктом превращения метионина, одной из восьми незаменимых аминокислот. Из гомоцистеина в дальнейшем может образовываться другая аминокислота, цистеин, не входящая в число незаменимых аминокислот.
Избыток накапливающегося в организме гомоцистеина может обратно превращаться в метионин. Кофакторами ферментов метаболических путей метионина в организме выступают витамины, самыми важными из которых являются фолиевая кислота, пиридоксин (витамин B6), цианокобаламин (витамин B12) и рибофлавин (витамин B1).
Гомоцистеин не является структурным элементом белков, а потому не поступает в организм с пищей. В физиологических условиях единственным источником гомоцистеина в организме является превращение метионина.
Гомоцистеин обладает выраженным токсическим действием на клетку. Для защиты клетки от повреждающего действия гомоцистеина существуют специальные механизмы выведения его из клетки в кровь. Поэтому, в случае появления избытка гомоцистеина в организме, он начинает накапливаться в крови, и основным местом повреждающего действия этого вещества становится внутренняя поверхность сосудов.
Для превращения избытка гомоцистеина в метионин нужны высокие концентрации активной формы фолиевой кислоты (5-метилтетрагидрофолата). Основным ферментом, обеспечивающим превращение фолиевой кислоты в ее активную форму, является 5,10 метилентетрагидрофолат-редуктаза (MTHFR). Снижение активности этого фермента — одна из важных причин накопления гомоцистеина в организме. (рис. 1)
Рис. 1
Обратите внимание на то, что гомоцистеин может образовываться только из метионина. Гомоцистеин может превращаться либо в цистатионин, который в дальнейшем используется для синтеза цистеина, либо в метионин. На всех ключевых этапах метаболизма метионина и гомоцистеина важную роль играют витамины. Красным цветом обозначен цикл превращения метионина, зеленым — цикл превращения фолиевой кислоты. MTHFR — 5,10 метилентетрагидрофолат-редуктаза. Метионин, гомоцистеин и фолиевая кислота являются аминокислотами. Аминокислоты являются важнейшими субстратами метаболизма азота в организме. От аминокислот берут начало белки, ферменты, пуриновые и пиримидиновые основания (и нуклеиновые кислоты), пиррольные производные (порфирины), биологически активные соединения пептидной природы (гормоны), а также ряд других соединений. При необходимости аминокислоты могут служить источником энергии, главным образом за счет окисления их углеродного скелета. В живых организмах аминокислоты образуют пул, величина которого во взрослом состоянии остается в физиологических условиях постоянной. Она соответствует разнице между поступлением аминокислот извне или иногда из эндогенных источников, и расходом аминокислот, служащих субстратами в анаболических и катаболических процессах. Живые организмы не запасают аминокислоты и белки впрок, поэтому необходимое количество азота (лучше в форме аминокислот) должно поступать с пищей. Во взрослом организме в физиологических условиях количество поступающего и выводящегося азота одинаково (азотное равновесие). Аминокислоты из экзогенных источников (из пищи) всасываются в пищеварительном тракте и переносятся кровью в печень и другие ткани и органы, где они далее используются. Кроме того, источником аминокислот (эндогенный источник) могут служить тканевые белки организма, которые постоянно подвергаются метаболизму с освобождением входящих в них аминокислот. Эти аминокислоты используются для синтеза новых белков лишь в малой степени, однако эндогенные источники очень важны, поскольку они обеспечивают около двух третей всего пула аминокислот, и только одна треть аминокислот поступает из пищи. Незаменимые аминокислоты — это те аминокислоты, которые не могут синтезироваться данным организмом. Для человека это валин, лейцин, изолейцин, лизин, метионин, треонин, фенилаланин, триптофан и, в определенных условиях, также аргинин и гистидин.
История вопроса
В 1932 г. De Vigneaud открыл гомоцистеин как продукт деметилирования метионина. Через несколько лет был открыт и второй путь метаболизма гомоцистеина — транссульфурация. В 1962 г. был открыт синдром гомоцитеинурии (гомоцистеин в моче), связанный с дефицитом фермента цистатионин синтазы. При данном заболевании отмечаются умственная отсталость, деформации костей, смещение хрусталика, прогрессирующие сердечно-сосудистые заболевания и очень высокая частота тромбоэмболии. Kilmer McCully углубленно изучал больных с высокими уровнями гомоцистеина в крови и обнаружил связь гипергомоцистеинемии с развитием тяжелых сосудистых заболеваний. Эти исследования послужили основой предложенной им в 1975 г. гомоцистеиновой теории атеросклероза. Он был убежден, что существует связь между уровнем гомоцистеина, витаминной недостаточностью и заболеваниями сердца.
Исследования последних 15 лет подтвердили и углубили гомоцистеиновую теорию развития сосудистых нарушений. Ежегодно появляются десятки публикаций, посвященных разным сторонам этой проблемы. Однако, к сожалению, в настоящее время только немногие лаборатории могут определять уровень гомоцистеина в крови.
Клинические рекомендации
Вышесказанное свидетельствует о важности поддержания нормального уровня липидов и гомоцистеина в крови. Согласно недавним исследованиям очень важно исследовать уровень гомоцистеина в крови регулярно, например, в возрасте 30 лет, 40 лет, 50 лет, 60 лет. Ранняя профилактика (см. данные по применению муки обогащенной фолиевой кислотой) показала положительные результаты.
Исследования уровня холестерина и гомоцистеина в крови после инфаркта миокарда, инсульта или в случае деменции и попытки снижения их уровня не особенно полезны, так как степень атеросклеротического поражения сосудов едва ли может быть уменьшена. Невозможно достигнуть каких-либо больших успехов, даже постоянно проводя витаминотерапию, за 2-3 года. Поэтому очень важно объяснить пациентам значение ранней профилактики гипергомоцистеинемии.
Рекомендуется проверять уровень гомоцистеина у всех лиц с артериальными или венозными тромбозами в анамнезе, ишемической болезнью сердца. В обязательном порядке следует проверять уровень гомоцистеина у пациенток с бывшими ранее акушерскими осложнениями и женщин, у родственников которых были инсульты, инфаркты и тромбозы в возрасте до 45-50 лет.
Детальный обзор значения гипергомоцистеинемии был представлен международным экспертом проф. Wolfgang Herrmann в 2006 году в журнале Clin Lab [4].
Причины повышения уровня гомоцистеина в крови
В течение жизни уровень гомоцистеина в крови постепенно повышается. До периода полового созревания уровни гомоцистеина у мальчиков и девочек примерно одинаковы (около 5 мкмоль/л). В период полового созревание уровень гомоцистеина повышается до 6-7 мкмоль/л, у мальчиков это повышение более выражено, чем у девочек.
У взрослых уровень гомоцистеина колеблется в районе 10-11 мкмоль/мл, у мужчин этот показатель обычно выше, чем у женщин. С возрастом уровень гомоцистеина постепенно возрастает, причем у женщин скорость этого нарастание выше, чем у мужчин. Постепенное нарастание уровня гомоцистеина с возрастом объясняют снижением функции почек, а более высокие уровни гомоцистеина у мужчин — большей мышечной массой.
Во время беременности в норме уровень гомоцистеина имеет тенденцию к снижению. Это снижение происходит обычно на границе первого и второго триместров беременности, и затем остается относительно стабильным. Нормальные уровни гомоцистеина восстанавливаются через 2-4 дня после родов. Считается, что снижение уровня гомоцистеина при беременности благоприятстствует плацентарному кровообращению. Уровень гомоцистеина в крови обратно пропорционален массе плода и новорожденного.
Уровень гомоцистеина в крови может повышаться по многим причинам. Одним из факторов является повышенное поступление метионина с пищей. Поэтому во время беременности дополнительное назначение метионина в таблетках, до сих пор практикуемое некоторыми врачами, следует проводить с осторожностью и под контролем уровня гомоцистеина. Самыми частыми причинами повышения уровня гомоцистеина являются витаминодефицитные состояния. Особенно чувствителен организм к недостатку фолиевой кислоты и витаминов B6, B12 и B1. Предполагается, что повышенную склонность к гипергомоцистеинемиии имеют курящие. Потребление больших количеств кофе является одним из самых мощных факторов, способствующих повышению уровня гомоцистеина в крови. У лиц, выпивающих более 6 чашек кофе в день, уровень гомоцистеина на 2-3 мкмоль/л выше, чем у не пьющих кофе. Предполагается, что негативное действие кофеина на уровень гомоцистеина связано с изменением функции почек. Уровень гомоцистеина часто повышается при сидячем образе жизни. Умеренные физические нагрузки способствуют снижению уровня гомоцистеина при гипергомоцистеинемии. Потребление небольших количеств алкоголя может снижать уровень гомоцистеина, а большие количества спиртного способствуют росту гомоцистеина в крови.
На уровень гомоцистеина влияет прием целого ряда лекарств. Механизм их действия может быть связан с влиянием на действие витаминов, на продукцию гомоцистеина, на функцию почек, и на уровень гормонов. Особенное значение имеют метотрексат (антагонист фолиевой кислоты, часто применяется для лечения псориаза), противосудорожные препараты (фенитоин и др., опустошают запасы фолиевой кислоты в печени), закись азота (препарат, использующийся при наркозе и при обезболивании родов, инактивирует витамин B12), метформин (препарат, использующийся для лечения сахарного диабета и синдрома поликистозных яичников) и антагонисты H2-рецепторов (влияют на всасывание витамина B12), эуфиллин (подавляет активность витамина B6, часто применяется в акушерских стационарах для лечения гестозов). На уровень гомоцистеина может неблагоприятно влиять прием гормональных контрацептивов, но это бывает не всегда.
Еще одним фактором, способствующим повышению уровня гомоцистеина, являются некоторые сопутствующие заболевания. Самыми важными из них являются витаминодефицитные состояния и почечная недостаточность. Заболевания щитовидной железы, сахарный диабет, псориаз и лейкозы могут способствовать значительному росту уровня гомоцистеина в крови.
Одной из главных причин витаминодефицитных состояний, приводящих к гипергомоцистеинемии, являются заболевания желудочно-кишечного тракта, соопровождающиеся нарушением всасывания витаминов (синдром мальабсорбции). Это объясняет более высокую частоту сосудистых осложнений при наличии хронических заболеваний ЖКТ, а также то, что при B12-витаминодефиците частой причиной смерти служит не анемия, а инсульты и инфаркты.
Одним из важных факторов, способствующих росту гомоцистеина в крови является наследственная предрасположенность. Наиболее изученным является дефект фермента 5,10 метилентетрагидрофолат-редуктазы (MTHFR). MTHFR обеспечивает превращение 5,10-метилентетрагидрофолата в 5-метил-тетрагидрофолат, являющийся главной циркулирующей в организме формой фолиевой кислоты. В свою очередь, фолиевая кислота используется во многих биохимических путях, включая метилирование гомоцистеина и других веществ и синтез нуклеотидов. Ген MTHFR находится на первой хромосоме в локусе 1p36.3. Существует несколько аллельных вариантов этого фермента, вызывающих тяжелую недостаточность MTHFR, но большинство из этих вариантов очень редки. Практическое значение имеют два аллеля: термолабильный аллель C677T и аллель A1298C (иногда обозначается как C1298A). Аллель С677Т является результатом точечной мутации, при которой в позиции 677 аланин заменен на валин. При этом нормальный генотип обозначается как СС (на обеих хромосомах нормальные варианты гена), гетерозиготный — как СТ (носительство, на одной хромосоме — нормальный ген, а на другой — мутантный), гомозиготный по мутантному гену генотип — как TT (на обеих хромосомах мутантный ген). В настоящее время ДНК-диагностика мутации C677T проводится в некоторых медицинских центрах Москвы. Особенности данной мутации представлены на рис. 2.
Рис. 2 C677T-полиморфизм 5,10 метилентетрагидрофолат-редуктазы (MTHFR) влияет на распределение соединений фолиевой кислоты (выделены зеленым цветом), используемых для синтеза ДНК и РНК, и 5-метилтетрагидрофолата, необходимого для реметилирования гомоцистеина (Hсy), а значит — для синтеза белка. Секторная диаграмма показывает распределение генотипов, типичное для европейских популяций, а размеры стрелок показывают относительную ферментную активность MTHFR. Сокращения: AdoMet, S-аденозилметионин; CHOTHF, формилтетрагидрофолат; CHTHF, метенилтетрагидрофолат; CH2THF, 5,10-метилентетрагидрофолат; CH3DNA, метилированная ДНК; CH3THF, 5-метилтетрагидрофолат; DHF, дигидрофолат; dTMP, диокситимидин-5’-монофосфат;dUMP, деоксиуридин-5’-монофосфат; FAD, флавинадениндинуклеотид; Hcy, гомоцистеин; Met, метионин; THF, тетрагидрофолат; protein, белок; DNA, ДНК; RNA, РНК; purines, пуриновые основания. CC и TT — гомозиготные генотипы, CT — гетерозиготный генотип. При снижении активности фермента, 5-метилтетрагидрофолата может не хватать для эффективного перевода гомоцистеина в метионин, и гомоцистеин начинает накапливаться в организме.
| Уровень гомоцистеина | Частота1 | Частые причины1 |
| Умеренное повышение (15-30 мкмоль/л) | 10% | Нездоровый образ жизни, включая плохое и несбалансированное питание Полиморфизм MTHFR в сочетании с низким фолатным статусом (S-фолат на нижней границе нормы) Недостаток фолиевой кислоты Умеренный дефицит витамина B12 Почечная недостаточность Гиперпролиферативные нарушения Прием лекарств |
| Повышение средней степени тяжести (30-100 мкмоль/л) | Полиморфизм MTHFR в сочетании с дефицитом фолиевой кислоты Умеренный дефицит витамина B12 Тяжелый дефицит фолиевой кислоты Тяжелая почечная недостаточность | |
| Повышение тяжелой степени (>100 мкмоль/л) | 0,02% | Тяжелый дефицит витамина B12 Дефицит CBS (гомозиготная форма) |
Таблица 1. Частые причины различных степеней гипергомоцистеинемии
1Данные о причинах гомоцистеинемии и ее частоте даны на основании европейских исследований. Эти данные могут значительно варьировать в разных популяциях. По нашим данным, частота умеренной гипергомоцистеинемии в Москве значительно превышает среднеевропейские цифры. Умеренное повышение гомоцистеина у москвичек часто определяется даже на фоне приема больших доз витаминов, что может быть связано с высокой частотой нарушений усвоения витаминов в желудке и кишечнике. Сокращения: CBS — цистатионин-бета-синтаза
Гомоцистеин, как фактор риска развития психоневрологических расстройств.
В психоневрологической литературе появилось множество публикаций о роли гомоцистеина (Hcy) — серосодержащей аминокислоты, которая не является диетической составляющей и не образует белки.
Гомоцистеин получается исключительно вследствии деметилирования метионина — аминокислоты, входящей в растительные и животные белки и являющейся основным источником белковых атомов серы.
Процесс деметилирования является важным метаболическим путем, приводящим к важным реакциям метилирования в организме. Гомоцистеин либо повторно метилируется в метионин ( процесс, который использует фолат и витамин B12 в качестве кофакторов) , либо катаболизируется путем транссульфурации в цистатионин, если присутствует избыток Hcy ( с использованием витамина B6 в качестве кофактора).
Ферменты метаболизма гомоцистеина
Три основных фермента участвуют в метаболизме гомоцистеина : метионинсинтаза (MS) и 5-метилтетрагидрофолатредуктаза (MHTFR) в реметилировании и цистатион- b- синтаза (CBS) в транссульфурации. Эти ферменты, наряду с коэнзимами, поддерживают внутриклеточную концентрацию гомоцистеина в узком диапазоне, даже если его уровни в плазме значительно различаются.
Гомоцистеин в плазме примерно на 70% связан с альбумином и существует во многих формах: пониженная, окисленная и смешанные дисульфиды, содержащие гомоцистеин и другие тиолы.
Лабораторные исследования
В большинстве лабораторий измеряется общий пул гомоцистеина (tHcy) в плазме, обычно из образца натощак. Тест на гомоцистеин может быть выполнен путем измерения tHcy через 2-8 часов после пероральной метиониновой нагрузки (100 мг метионина на кг массы тела).
Нормальный диапазон плазмы для tHcy между 5 и 15 мкмоль / л. Гипергомоцистеинемия довольно распространена, и повышенные уровни Hcy могут быть умеренными (15-30 мкмоль / л), промежуточными (31-100 мкмоль / л) или тяжелыми (> 100 мкмоль / л).
Гипергомоцистенемия
Гомоцистеин признан независимым фактором риска развития атеросклероза коронарных, церебральных и периферических артерий. Высокие уровни гомоцистеина вызывают повреждение эндотелиальных клеток вследствие нарушения эндотелиально-зависимой вазодилатации, активности эндогенного активатора плазминогена тканевого типа и снижения синтеза эндотелиальной ДНК. Высокие уровни Hcy также приводят к снижению внутриклеточных уровней аденозина, который обладает кардио- и вазопротекторным эффектом. Hcy вызывает высвобождение многих медиаторов воспаления, которые играют активную роль в патогенезе атеросклерозе, таких как TNF a , стоит также отметить и его влияние на рецептор для прогрессирующего гликирования, конечные продукты (RAGE) и его сигнальный лиганд (EN-RAGE). Тромбоз усиливается за счет воздействия на агрегацию тромбоцитов, увеличенный синтез тромбоксана A и уменьшенный синтез простациклина а каскад свертывания — за счет активация факторов V, X и XII и ингибирования природных антикоагулянтов. Hcy способствует росту гладких мышц и связыванию липопротеина (а) с фибрином.
Гомоцистеин также может оказывать прямое нейротоксическое действие через индукцию апоптоза и NMDA-опосредованную эксайтотоксичность, а его метаболит гомоцистеиновая кислота также является эксайтотоксичной. В эксперименте было показано, что воздействие гомоцистеина на нейроны гиппокампа крыс приводит к активации поли-АДФ-рибозной полимеризации (PARP) и истощению NAD, которые предшествуют митохондриальной дисфункции, окислительному стрессу, активации каспазы и апоптозу нейронов.
Причины гипергомоцистенемии
Причины повышенных уровней Hcy многочисленны и могут быть генетическими или приобретенными. Наиболее распространенной генетической аномалией метаболизма гомоцистеина является замена на нуклеотид 677 (C677T) в гене, кодирующем фермент MTHFR, что делает его примерно на 50% менее активным. В популяционных исследованиях в западных странах 9-17% населения были гомозиготными по этому мутантному ферменту, а 30-41% — гетерозиготными. Гомозиготный дефицит CBS встречается редко и вызывает гомоцистинурию, но ее гетерозиготный дефицит, приводящий к умеренному повышению Hcy, присутствует у 1 из 300 человек.
Приобретенные причины гипергомоцистеинемии включают дефицит кофакторов (витамины B12, B6 и фолат), возраст, заболевания, такие как почечная недостаточность и гипотиреоз, лекарства, которые влияют на метаболизм витаминов B12, B6 или фолата, и факторы образа жизни, такие как курение сигарет. алкоголизм, диета и малоподвижный образ жизни.
Гомоцистеин и психоневрологические расстройства
Вероятно, высокий уровень гомоцистеина может привести к повреждению головного мозга и психоневрологическим расстройствам. По сути , гомоцистеин является проатерогенным и протромботическим, что повышает риск возникновения цереброваскулярных заболеваний и может оказывать прямое нейротоксическое действие. И , действительно , исследования подтверждают увеличение распространенности инсульта и сосудистой деменции у лиц с гипергомоцистеинемией. Отношения гомоцистеина с депрессией , как, впрочем, и с эпилепсией все еще носят предварительный характер.
Напомним читателю, что гипергомоцистеинемию следует лечить фолиевой кислотой ( фолиевая кислота в дозах от 0,5 до 5 мг фолата в день снижает уровень гомоцистеина на 25%). Исследование, сравнивающее дозы 0,2, 0,4, 0,6, 0,8 и 1,0 мг фолиевой кислоты в день, продемонстрировало максимальное снижение Hcy при дозе 0,8 мг, причем бетаин был менее эффективным. Метаанализ действия витамина B12 показал, что доза от 0,02 до 1 мг / день вызывает дополнительное снижение Hcy примерно на 7% . Отметим, что лечение фолиевой кислотой сопряжено с риском ускоренной подострой комбинированной дегенерации спинного мозга у лиц с субклинической недостаточностью витамина В12. Этого можно избежать, либо исключив дефицит витамина B12 до начала терапии фолатом, либо добавив фолиевую кислоту с витамином B12 в дозе 400 м.г / день или больше. Длительное лечение витамином B6 в дозах, превышающих 400 мг / день, может вызвать сенсорную периферическую невропатию. В Соединенных Штатах Америки существует обязательное требование, чтобы мука и крупы были обогащены 140 мкг фолиевой кислоты на 100 г муки, и, по оценкам, это связано с 3% снижением риска стеноза коронарной артерии, связанного с гомоцистеином.
Инсульт
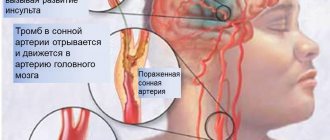
Гомоцистеин считается независимым фактором риска развития цереброваскулярных заболеваний, с суммарным отношением шансов 1,9 на 5 мкмоль / л увеличения гомоцистеина в плазме. Исследователи обнаружили значительную тенденцию к увеличению риска инсульта с увеличением tHcy, в то время как исследование женщин выявило повышенный риск инфаркта миокарда и инсульта только у пациентов, у которых уровень гомоцистеина составлял не менее 13,26 мкмоль / л. Роттердамское исследование обнаружило положительную корреляцию между увеличением tHcy и риском инсульта, особенно лакунарными, с увеличением риска всех инсультов на 7% на 1 мкмоль / л при повышении tHcy.
Сосудистая деменция
Связь гомоцистеина с инсультом также делает его фактором риска для возникновения сосудистой деменции (VaD). Исследователи также отметили, что обнаружили, что Hcy является значимым детерминантом глубокой, но не перивентрикулярной гиперинтенсивности.
Болезнь Альцгеймера
То, что гомоцистеин может быть связан с нейродегенеративным заболеванием, является интересным открытием, которое было подтверждено многими авторами. Ряд последних продемонстрировал корреляцию между уровнями гомоцистеина и выраженностью когнитивных нарушений. Отмечено, что у пациентов с исходным уровнем tHcy в верхних двух тертилях через 3 года наблюдалась значительно более высокая атрофия височной доли, чем у пациентов с самым низкими тертилями, предполагают, что повышенные уровни tHcy могут определять и темп прогрессирования заболевания. Перекрестное МРТ исследование описало подобную корреляцию между высокими уровнями гомоцистеина и церебральной атрофией у пожилых людей, что предполагает возможность того, что гипергомоцистеинемия является действительно нейротоксической.
Депрессия
Создается впечатление, что связь между депрессией и витаминами группы В, в частности фолиевой кислотой и витамином В12, представляет интерес для исследователей гораздо болший, чем акцент на гомоцистенемии. В двух крупных корреляционных исследованиях была обнаружена связь депрессии с фолиевой кислотой и B12, а не с уровнями гомоцистеина. Интересно отметить, что у 50% стационарных пациентов с депрессией регистрируются повышенные уровни гомоцистеина и только у нескольких пациентов с низким содержанием фолиевой кислоты в эритроцитах, а у субъектов с высокими уровнями гомоцистеина были более выраженные баллы по шкале оценки депрессии по Гамильтону (HDRS). Исследование депрессии с поздним началом обнаружило более высокие показатели мутации C677T MHTFR в этой группе по сравнению с депрессией с ранним началом. Относительно большое число пациентов с депрессией с субклиническим дефицитом витаминов группы В предполагает, что эти изменения могут быть результатом анорексии, связанной с депрессией, а не участвовать в патогенезе депрессии. Следует отметить, что дефицит фолата связан с плохой реакцией на антидепрессанты, что позволяет предположить, что увеличение фолата может и повысить эффективность терапии депрессии.
Снижение уровня гомоцистеина в плазме у женщин, принимающих фолат и флуоксетин, коррелирует с улучшением, в то время как уровни витамина B12 не связаны с клиническим ответом. Вероятно, дифференциальный ответ женщин на прием фолиевой кислоты может быть вызван тем, что мужчинам требуется больше добавок фолата, чтобы существеннго изменить уровень фолата в сыворотке и уровень гомоцистеина. Таким образом, хотя никаких проспективных исследований не проводилось, есть некоторые свидетельства того, что статус фолиевой кислоты и гомоцистеина предсказывает тяжесть депрессии и реакцию на лечение антидепрессантами, и что добавка фолиевой кислоты эффективно улучшает реакцию на флуоксетин.
Алкоголизм
Гипергомоцистеинемия часто фиксируется при хроническом алкоголизме. Возможно, что атрофия мозга, наблюдаемая у пациентов с алкоголизмом, может быть связана с высоким уровнем гомоцистеина.
Эпилепсия
Введение высоких доз гомоцистеина животным приводит к судорожному припадку. Кроме того, многие противосудорожные препараты снижают уровень фолиевой кислоты, тем самым повышая и уровень Hcy. Высокие уровни Hcy у эпилептиков также влияют на тератогенное действие противосудорожных препаратов, что приводит к рекомендации Американской академии неврологии, касающимся того , что все женщины детородного возраста, принимающие противосудорожные препараты, должны потреблять не менее 0,4 мг / день фолиевой кислоты.
Болезнь Паркинсона
Гипергомоцистеинемия была описана у пациентов с болезнью Паркинсона , что , вероятно, является результатом образования S-аденилгомоцистеина во время метаболизма леводопы, т.е. она является вторичной по отношению к лечению леводопой. Гипергомоцистеинемия более тяжелая у пациентов с болезнью Паркинсона , гомозиготных по мутации CTH7T MTHFR, но отмечается даже у гетерозигот, чем у тех, у кого вообще нет данной мутации.
Гипергомоцистеинемия и патология беременности
Гипергомоцистеинемия приводит к повреждению и активации эндотелиальных клеток (клеток выстилки кровеносных сосудов), что значительно повышает риск развития тромбозов. Не все детали механизма патологического действия гипергомоцистеинемии до конца изучены, но многое уже известно.
Тромбогенное действие гомоцистеина может быть связано с повреждением клеток эндотелия, неспецифическим ингибированием синтеза простациклина, активацией фактора V, торможением активации протеина C, даун-регуляцией экспрессии тромбомодулина, блокадой связывания тканевого активатора плазминогена эндотелиальными клетками. Кроме того, высокие уровни гомоцистеина усиливают агрегацию тромбоцитов вследствие снижения синтеза эндотелием релаксирующего фактора и NO, индукции тканевого фактора и стимуляции пролиферации гладкомышечных клеток.
Микротромбообразование и нарушения микроциркуляции приводят к целому ряду акушерских осложнений. Нарушение плацентации и фетоплацентарного кровообращения могут быть причиной репродуктивной недостаточности: невынашивания беременности и бесплодия в результате дефектов имплантации зародыша. На более поздних стадиях беременности гипергомоцистеинемия является причиной развития хронической фетоплацентарной недостаточности и хронической внутриутробной гипоксии плода. Это приводит к рождению детей с низкой массой тела и снижению функциональных резервов всех жизнеобеспечивающих систем новорожденного и развития целого ряда осложнений периода новорожденности.
Гипергомоцистеинемия может быть одной из причин развития генерализованной микроангиопатии во второй половине беременности, проявляющейся в виде позднего токсикоза (гестоза): нефропатии, преэкламсии и экламсии. Для гипергомоцистеинемии характерно развитие тяжелых, часто неуправляемых состояний, которые могут приводить к досрочному прерыванию беременности по медицинским показаниям. Рождение незрелого недоношенного ребенка в таких случаях сопровождается высокой детской летальностью и большим процентом неонатальных осложнений.
Гомоцистеин свободно переходит через плаценту и может оказывать тератогенное и фетотоксическое действие. Было доказано, что гипергомоцистеинемия является одной из причин анэнцефалии и незаращения костномозгового канала (spina bifida
). Аненцефалия приводит к стопроцентной летальности, а
spina bifida
— к развитию серьезных неврологических проблем у ребенка, включая моторный паралич, пожизненную инвалидность и преждевременную смерть. Нельзя исключить прямое токсическое действие избыточного уровня гомоцистеина на нервную систему плода.
Гипергомоцистеинемия может быть не только причиной, но и спутником акушерских осложнений. Предполагается, что в некоторых случаях проблемы могут быть связаны не только с высоким уровнем гомоцистеина, но и с теми состояниями, которые являются причиной развития гипергомоцистеинемии (витаминодефицитные состояния, сопутствующие заболевания и т. д.)
Следует помнить, что гипергомоцистеинемия может сопровождаться развитием вторичных аутоиммунных реакций и в настоящее время рассматривается как одна из причин антифосфолипидного синдрома. Аутоиммунные факторы могут мешать нормальному развитию беременности и после устранения высокого уровня гомоцистеина.
Диагностика гипергомоцистеинемии
Для диагностики гипергомоцистеинемии проводится определение уровня гомоцистеина в крови. Для дифференциальной диагностики различных форм гомоцистеинемии иногда используются нагрузочные пробы с метионином (определение уровня гомоцистеина натощак и после нагрузки метионином).
Для выяснения причин гипергомоцистеинемии проводится ДНК-диагностика наследственных дефектов ферментов, участвующих в обмене метионина и фолиевой кислоты, в частности, MTHFR, и определение уровня витаминов B6, B12, B1 и фолиевой кислоты в крови.
При обнаружении высокого уровня гомоцистеина в крови рекомендуется проведение тестов, позволяющих исключить дополнительные факторы риска развития сосудистых и акушерских осложнений. Мы рекомендуем проведение гемостазиограммы, анализа крови на волчаночный антикоагулянт, анализа на антифосфолипидные и анти-ДНК-антитела, антитела к щитовидной железе, антитела к фактору роста нервов и анализ крови на наследственные дефекты гемостаза (лейденскую мутацию и наследственные дефекты протромбина). По показаниям могут быть назначены и другие анализы.
Норма и изменения уровня гомоцистеина
У детей до 18 лет уровень гомоцистеина не должен превышать 5 микромоль на литр. У взрослых пациентов концентрация гомоцистеина в норме находится в диапазоне 3,7-11 мкмоль/л. Норма гомоцистеина при беременности неодинаковая в разных триместрах. В первом триместре беременности уровень гомоцистеина в норме менее 5,6 мкмоль/л, во втором – 4,3 мкмоль/л, а в третьем не должен превышать 3,3 мкмоль/л.
Что показывает гомоцистеин? При содержании гомоцистеина 11-14 мкмоль/л риск развития сердечно-сосудистых заболеваний гомоцистеина умеренный. Если уровень гомоцистеина находится в пределах 15-29 мкмоль/л, риск высокий, а при концентрации гомоцистеина выше 29 мкмоль/л риск развития сердечно-сосудистой патологии очень высокий.
При высоком уровне гомоцистеина повреждается внутренняя стенка артерий, что приводит к образованию микросгустков и сужению просвета артерий. Микроскопические сгустки, в зависимости от органа, где они формируются, могут приводить к инсульту, инфаркту миокарда и прерыванию беременности вследствие нарушения маточно-плацентарного кровотока. Уровень гомоцистеина может повышаться при недостаточном поступлении витаминов В6, В12 и фолиевой кислоты с пищей. Повышение концентрации гомоцистеина наблюдают при некоторых заболеваниях:
- Хронической почечной недостаточности;
- Гипофункции щитовидной железы;
- В12-дефицитной анемии, онкологической патологии;
- Генетических дефектах, приводящих к неполноценности ферментов, которые отвечают за обмен гомоцистеина.
Если гомоцистеин понижен, что это значит? Низкий гомоцистеин, как правило, в начале беременности. После родов уровень гомоцистеина возвращается в обычное состояние в течение 4-5 дней. Контроль концентрации гомоцистеина в крови очень важен при планировании беременности. Его повышение крайне опасно и может вызвать выкидыш или развитие тяжёлых патологий у плода.
Лечение гипергомоцистеинемии
При обнаружении гипергомоцистеинемии проводится специально подобранная терапия высокими дозами фолиевой кислоты и витаминов группы B (В6, B12, B1). Учитывая то, что во многих случаях витаминодефицитное состояние бывает связано с нарушением всасывания витаминов в желудочно-кишечном тракте, лечение, как правило начинают с внутримышечного введения витаминов группы B. После снижения уровня гомоцистеина до нормы (5—15 мкг/мл) назначаются поддерживающие дозы витаминов per os
.
Во время беременности может быть показано проведение антиагрегантной терапии (малые дозы аспирина, выступающего в данном случае в качестве своеобразного витамина беременности, малых доз препаратов гепаринового ряда). При наличии антифосфолипидного синдрома может быть назначено дополнительное лечение.
Гипергомоцистеинемия — патологическое состояние, своевременная диагностика которого в подавляющем большинстве случаев позволяет назначить простое, безопасное и эффективное лечение, в десятки раз снижающее риск осложнений у матери и ребенка.
Теги: беременность, гомоцистеин