Кровеносные сосуды шейного отдела позвоночника – это эластичные гладкомышечные полые образования, по которым происходит кровоснабжение головного мозга. Всего в головной мозг поступает около 15% от общего объема циркулирующей крови и почти четверть от количества кислорода, который человек получает в процессе дыхания. Сужение сосудов в данном отделе является одной из форм сосудистой непроходимости и при отсутствии своевременной коррекции может привести к полной окклюзии (закупорке) артерий, снабжающих кровью клетки головного мозга. Патология опасна не только стойкими вертебробазилярными и вегето-сосудистыми расстройствами, но и тяжелыми органическими поражениями мозга: инсультом, нарушением глотательной и речевой функции, параличом лицевых мышц.
Сужение сосудов шейного отдела позвоночника
Синдром позвоночной артерии при шейном остеохондрозе
Синдром позвоночной артерии – это патологическое состояние, развивающееся на фоне нарушенного кровоснабжения в бассейне позвоночной артерии, на практике проявляется симптомами гипоксии головного мозга в местах, которые она питает. Наиболее часто синдром позвоночной артерии возникает в комплексе с остеохондрозом шейного отдела позвоночного столба. Реже заболевание имеет другие причины, порой даже не вертеброгенного происхождения.
Долгое время синдром позвоночной артерии являлся заболеванием людей старшего возраста. Но в последние годы болезнь очень помолодела, и сегодня такой диагноз можно встретить даже у детей. Патологическое состояние неприятно своими симптомами, которые существенно ухудшают качество жизни человека. Кроме этого, по мере своего прогрессирования оно обрастает последствиями, которые в большинстве случаев становятся причиной развития транзиторных ишемических атак и даже ишемического инсульта.
При правильном подходе к лечению синдрома позвоночной артерии специалистам удается облегчить состояние больного человека и предупредить многие осложнения заболевания. Болезнь ни в коем случае нельзя оставлять без внимания в надежде, что ее проявления со временем угаснут. СПА лучше лечить сразу после появления первых его признаков, что существенно повысит шансы на выздоровление и обеспечит положительный прогноз для дальнейшей жизни пациента.
Лечение стеноза сонной артерии
Наиболее распространенным методом лечения стеноза является стентирование артерии. Стентирование относится к хирургическим методам лечения, поэтому, как и любое другое хирургическое вмешательство, требует высокой квалификации врача в диагностике, принятии решения о необходимости/возможности операции и непосредственно введении стента. Стент – это металлический каркас, вводимый напрямую в артерию. В месте сужения он разворачивается и расширяет стенки сосуда, насколько это необходимо. Стент остается в артерии. Только первые дни его наличие может доставлять неудобство ввиду изменения кровотока, но со временем пациент перестает его ощущать и возвращается к нормальной жизни без риска возникновения инсульта. Но конечно же врач выдаст определенные рекомендации по дальнейшему образу жизни, чтобы не допустить повторного стеноза.
Наши врачи понимают всю важность качественного ведения пациента и послеоперационного наблюдения, поэтому обращаясь к нам, вы можете рассчитывать на комплексный подход в диагностике, лечении и послеоперационном периоде. Для реализации такого подхода отделение неврологии ФНКЦ располагает мощной диагностической базой и сильным составом специалистов с богатым опытом лечения стенозов, дополнительно проходящих курсы повышения квалификации на регулярной основе. Отделение плотно сотрудничает с кардиохирургической службой и выделенным в отдельное подразделение отделением сосудистой хирургии.
Преимуществом нашего центра является предоставление всего комплекса услуг нашим пациентам в одном месте, начиная с первичной консультации, записаться на которую вы можете по телефону или через специальную форму на сайте.
Причины развития синдрома позвоночной артерии
Существует несколько основных причин развития у человека шейно-позвоночного синдрома, среди которых следует выделить:
- остеохондроз и другие дегенеративно-дистрофические нарушения в сегментах шейного отдела позвоночника;
- врожденные аномалии строения костных элементов шеи;
- последствия травм в области нахождения позвоночной артерии;
- патологические состояния, которые негативно влияют на состояние симпатического артериального сплетения;
- атеросклеротическое поражение позвоночных артерий и другие патологии сосудистой стенки;
- тонические спазмы мышц в области шеи;
- дефекты строения шейных сосудов.
Квалифицированное лечение при синдроме позвоночной артерии шейного отдела позвоночника должно проводиться вне зависимости от причин развития болезненного состояния. Его объемы и основные методы во многом зависят от природы заболевания. Поэтому при появлении симптомов патологии не стоит заниматься их самолечением, а сразу обращаться за помощью к специалистам, которые имеют опыт работы в подобных клинических ситуациях.
Что такое стеноз шейного отдела позвоночника
Позвоночный канал представляет собой полость внутри позвоночника, образованную дугами позвонков. С одной стороны его надежно защищает дуга с поперечным и остистым отростком, а также желтая связка. С другой стороны его оберегают тела позвонков с пролегающими между ними хрящевыми прослойками (межпозвонковыми дисками) и проходящая по всей длине позвоночника задняя продольная связка.
В позвоночном канале проходят:
- спинной мозг, дополнительно защищенный твердой, паутинной и мягкой оболочками;
- спинномозговые корешки, через которые нервные импульсы передаются ко всем внутренним органам, мышцам, коже;
- кровеносные сосуды.
Его сужение наблюдается при деформации позвонков или дисков шейного отдела позвоночника, а также формировании новообразований различной природы, в результате чего они начинают выпирать в позвоночный канал и механически сдавливать находящиеся в нем анатомические структуры. В таких случаях изначально чаще всего развивается корешковый синдром со всеми вытекающими из этого последствиями в виде нарушений чувствительности, подвижности рук, упорными головными болями, головокружениями и т. д.
Если на этом этапе не вмешаться в процесс, имеющаяся патология прогрессирует и в конечном итоге размер патологического выпячивания может достигать такой величины, что будет оказывать давление на спинномозговую оболочку и, соответственно, спинной мозг и провоцировать увеличение давления ликвора (спинномозговой жидкости). В подобных случаях симптомы становятся значительно ярче, а при невмешательстве человек может вовсе утратить работоспособность и стать глубоким инвалидом.
Симптомы
Для синдрома позвоночной артерии характерными являются следующие клинические симптомы:
- головные боли, которые при синдроме позвоночной артерии локализируются в затылочной зоне с переходом на переднюю часть головы и могут появляться после резких поворотов шеи или после сна (синдром Барре-Льеу);
- мигренозные боли базилярного характера, которые часто сопровождаются потерей сознания;
- внезапные падения с запрокидыванием головы и нарушением координации;
- потеря нормальной устойчивости и свойства держать равновесие вместе с тошнотой, рвотой, головокружением, потемнением в глазах;
- развитие транзиторных ишемических атак;
- кратковременные обморочные состояния после резких движений головы;
- боли и ощущение «песка» в глазах, нарушение функции зрительного анализатора, выпадение полей зрения, тому подобное;
- ухудшение слуха, шум в ушах;
- приливы жара с повышенной потливостью;
- иногда болевые ощущения в области сердца.
Определить симптомы синдрома позвоночной артерии для опытного специалиста не составляет проблемы. Поэтому при появлении первых признаков недомогания не стоит откладывать визит к врачу, который сможет провести качественную диагностику патологического состояния и вовремя начать лечение.
Известно, что для обеспечения высокой активности метаболических процессов в головном мозге необходима постоянная поддержка его адекватного кровоснабжения [1, 2]. При нарушении кровоснабжения возникают патологические процессы, обусловленные ишемизацией мозговой ткани, что чаще всего связано с нарушениями структуры и функции мозговых сосудов.
В 1951 г. Ch. Fisher [3] была отмечена связь окклюзии внутренней сонной артерии (ВСА) с ишемическим инсультом. При этом автор подчеркнул, что окклюзия ВСА обычно развивается на фоне атеросклеротического поражения ее шейного сегмента, а предвещают приближающийся ишемический инсульт транзиторные ишемические атаки (ТИА).
Хотя до сих пор обсуждается патогенез развития ишемического инсульта у больных с окклюзией ВСА [4], она диагностируется приблизительно у 15% пациентов c ТИА или инфарктами в каротидном бассейне [5-8]. При окклюзии крупных артерий церебральное перфузионное давление (ЦПД) снижается, и для его поддержания на требуемом уровне компенсаторно расширяются артерии среднего калибра (приводя к повышению сосудисто-мозгового объема) с одновременным усилением кровотока по существующим коллатералям. При этом показатели объемного мозгового кровотока не меняются. Данный механизм ауторегуляции мозгового кровотока соответствует I стадии гемодинамической декомпенсации. По мере дальнейшего снижения ЦПД, в том числе по причине недостаточно развитой коллатеральной сети, исчерпываются возможности компенсаторной вазодилатации, приводя к «срыву» ауторегуляции и понижению объемного мозгового кровотока. При этом метаболические процессы, обеспечивающие нормальное функционирование головного мозга, поддерживаются за счет повышенного потребления кислорода тканью мозга (II стадия) [9, 10]. Иногда II стадию декомпенсации церебральной гемодинамики называют «нищей» перфузией [11].
На сегодняшний день для исследования церебральной гемодинамики и оценки цереброваскулярного резерва применяются инструментальные методы, позволяющие оценить объем мозгового кровотока, в том числе с использованием внутривенной пробы с ацетазоламидом [12]. «Нищая» перфузия проявляется снижением объема мозгового кровотока на стороне окклюзии ВСА после введения ацетазоламида, тогда как в норме при этом он увеличивается [12-14]. Исследование объема мозгового кровотока возможно с помощью позитронно-эмиссионной томографии (ПЭТ), однофотонной эмиссионной компьютерной томографии (КТ), КТ с ингаляцией ксенона, магнитно-резонансной томографии, транскраниальной допплерографии, а также перфузионной КТ (п-КТ) [15]. Преимуществами п-КТ являются ее общедоступность, простота и непродолжительность исследования, а также возможность получения количественных результатов [12, 16, 17]. Помимо объема мозгового кровотока, п-КТ оценивает сосудисто-мозговой объем и среднее время прохождения контрастного вещества по артериям в исследуемой области головного мозга [18].
Для улучшения коллатерального кровоснабжения головного мозга у больных с сосудисто-мозговой недостаточностью M. Yasargil и R. Donaghy в 1967 г. была разработана и внедрена в клиническую практику операция создания анастомоза между поверхностной височной артерией и ветвью средней мозговой артерии (цит. по [19]), получившая название «экстра-интракраниальный микроартериальный анастомоз» (ЭИКМА). Со временем операция ЭИКМА приобрела популярность в нейрохирургическом сообществе, например в 70-е годы в США ежегодно выполнялось несколько тысяч таких вмешательств [20, 21]. Однако проведенное в 1985 г. мультицентровое исследование (EC-IC Bypass Study) [22, 23], продолжавшееся 5 лет и включавшее 1377 больных, не выявило преимуществ операции ЭИКМА по сравнению с медикаментозной профилактикой ТИА и ишемического инсульта аспирином. Следует отметить, что исследование EC-IC Bypass оказалось недостаточно репрезентативным по больным, имеющим повышенный риск прогрессирования ишемии головного мозга, поскольку на момент его проведения отсутствовали диагностические методы, позволяющие выявить пациентов с декомпенсированной церебральной гемодинамикой [24-31].
В последующие 20 лет были разработаны нейровизуализационные методики, позволяющие облегчить отбор больных с окклюзирующими поражениями артерий головного мозга и с ожидаемой пользой от реваскуляризирующих вмешательств. Было проведено несколько исследований оценки риска развития ишемического инсульта в зависимости от выраженности расстройств церебральной гемодинамики. Например, в исследовании Каротидной Окклюзии St. Louis оценивалась возможность ПЭТ в выявлении «нищей» перфузии головного мозга. При повышении экстракции кислорода мозговой тканью было отмечено повышение риска ипсилатерального ишемического инсульта в течение 2 лет до 26,5% по сравнению с 5,3% у пациентов с нормальными показателями [10]. В исследовании из Японии [32] оценивался риск повторного ишемического инсульта методом ПЭТ при проведении нагрузочной пробы с ацетазоламидом. Ежегодный риск ишемического инсульта при наблюдении в сроки до 45,6 мес составил 10,6% для больных с повышенным потреблением кислорода мозговой тканью, тогда как при нормальном потреблении он отсутствовал [32].
В 2011 г. было завершено масштабное исследование хирургического лечения каротидной окклюзии — COSS (Carotid Occlusion Surgery Study) [33], на котором мы остановимся более подробно.
COSS проводилось на территории США и Канады в 49 стационарах и 18 центрах, оснащенных позитронноэмиссионными томографами. Критериями включения пациентов в исследование было наличие ТИА либо ишемического инсульта (в одноименном полушарии с окклюзированной сонной артерией) в период до 120 дней с момента ишемического эпизода. Больные с асимметрией показателей экстракции кислорода ипсилатеральное/контралатеральное полушарие >1,13 рандомизировались в две группы: лечившиеся консервативным методом («консервативная») и хирургическим (ЭИКМА). Инсульт или летальный исход в течение 30 дней после операции либо ипсилатеральный ишемический инсульт в течение 2 лет стали определяющими критериями (конечная точка) для каждого клинического случая. После предварительного анализа результатов лечения 195 больных COSS было досрочно завершено по причине неубедительности полученных данных. Тем не менее представленные группой COSS наблюдения заслуживают внимания.
По данным COSS, определяющие критерии в течение 2 лет существенно не различались в выделенных группах, составив 21% в хирургической и 22,7% в «консервативной» группе соответственно.
В хирургической группе было зарегистрировано улучшение показателя экстракции кислорода по сравнению с исходным уровнем при проведении ПЭТ в сроки с 30-го по 60-й день после операции.
В «консервативной» группе были получены существенно более низкие показатели развития инсульта, чем предполагалось — 22,7% против 40%. По мнению ряда исследователей [33], показатели лечения в «консервативной» группе улучшились благодаря терапии статинами. Не вызывает сомнения, что совершенствование медикаментозной терапии ведет к снижению заболеваемости инсультом. Так, в завершившемся недавно исследовании SAMMPRIS [34] агрессивная медикаментозная терапия, направленная на достижение уровня липопротеинов низкой плотности менее 70 мг/дл (1,81 ммоль/л), постоянный контроль за цифрами артериального давления и показателями гликемии при сахарном диабете, отказ от курения и малоподвижного образа жизни, снижение избыточной массы тела привели к существенному снижению заболеваемости инсультом у больных со стенозами интракраниальных артерий. Сходные результаты были получены и в широкомасштабном исследовании SPARCL [35], продемонстрировавшем очевидную пользу от назначения аторвастатина в дозе 80 мг/сут, позволившем уменьшить абсолютный риск развития инсульта на 5,5% при поражении артерий крупного диаметра.
Для выяснения причин неэффективности критериев COSS, разработанных с целью выявления лиц с повышенным риском прогрессирования ишемии головного мозга, были оценены другие факторы, способствовавшие снижению заболеваемости инсультом в «консервативной» группе больных [36]. Во-первых, настолько ли специфична ПЭТ, чтобы ее использование было оправдано для отбора пациентов? Были проанализированы методики, использовавшиеся для оценки цереброваскулярного резерва с помощью ПЭТ. В исследовании Каротидной Окклюзии St. Louis, взятом «за основу» исследователями COSS, оценка экстракции кислорода мозговой тканью определялась как межполушарная разница показателей, т.е. полученные результаты имели относительный характер, тогда как в исследовании H. Yamauchi и соавт. [37] суждения о недостаточности кровоснабжения головного мозга принимались на основании абсолютных показателей экстракции кислорода. По мнению авторов, такой способ расчетов достовернее, поскольку: 1) даже при односторонней окклюзии ВСА страдает и контралатеральное полушарие вследствие развития синдрома обкрадывания, поскольку кровоснабжение полушария на ее стороне, как правило, осуществляется через переднюю соединительную артерию из бассейна контралатеральной ВСА; 2) при двусторонних либо множественных окклюзиях магистральных артерий головы судить о состоянии кровоснабжения полушарий головного мозга можно лишь на основании абсолютных показателей. Тем не менее анализ данных, полученных в исследовании Каротидной Окклюзии St. Louis, продемонстрировал, что методика расчета относительных показателей проще и имеет сходную чувствительность с расчетом абсолютных показателей в прогнозировании повышенного риска ишемии мозга [38]. Более того, в подгруппе больных с контралатеральными каротидными стенозами, включенных в исследование COSS, метод относительной (межполушарная) оценки экстракции кислорода вряд ли отражал истинное состояние кровоснабжения головного мозга, как и степень его компенсации. Обобщая сказанное, можно утверждать, что специально разработанные для выявления лиц с повышенным риском прогрессирования ишемии головного мозга критерии оценки результатов ПЭТ, использовавшиеся в исследовании COSS, оказались недостаточно эффективными. Во-вторых, исследователи COSS ориентировались на ретроспективный анализ подгрупп пациентов, вошедших в исследование Каротидной Окклюзии St. Louis, используя наиболее характерные клинические проявления, требовавшиеся для определения критериев, на основании которых в последующем вычленялись пациенты с повышенным риском прогрессирования ишемии мозга [39, 40]. Применение такого метода необоснованно, поскольку для прогнозирования того, что «возможно случится», использовался ретроспективный анализ данных, полученных не от всех больных, а лишь от определенных групп пациентов [41]. Неправомерность использования полученных на основании ретроспективного анализа результатов объясняется тем, что методика определения оптимальных точек пересечения при наслоении рисков предрасполагает к переоценке истинных различий и частоты развития конечного события в сравниваемых группах [42, 43].
Можно утверждать, что попытки «вычленения» пациентов с повышенным риском прогрессирования ишемии мозга и включения их в COSS оказались безуспешными из-за предвзятого отношения к результатам, полученным в предшествующих исследованиях, и неубедительных диагностических критериев, разработанных для подтверждения факта декомпенсации церебральной гемодинамики.
В недавно завершенных исследованиях CREST и SAMMPRIS было продемонстрировано [44, 45], что хирургический опыт — важная составляющая исследований, оценивающих новые методы лечения и технологии, при этом требуется его подтверждение сертификационным экзаменом. На первый взгляд кажется, что организаторы COSS приняли все меры для того, чтобы операции ЭИКМА проводилась хирургами, имеющими достаточный опыт их выполнения. Однако более «пристальное» изучение критериев, необходимых для участия хирурга в исследовании COSS продемонстрировало, что достаточно было прохождения двухдневных обучающих курсов, а хирургам, самостоятельно выполнившим менее 10 таких операций, разрешалось оперировать под контролем более опытного коллеги. Можно предположить, что эти послабления были вызваны желанием организаторов COSS увеличить количество стационаров, участвующих в исследовании, однако зародили сомнения об уровне подготовки нейрохирургов, выполнявших операции. Несмотря на заявления исследователей COSS, что частота периоперационного инсульта не была связана с утвержденным сертификационным процессом, количество хирургических вмешательств, выполненных 93 пациентам 30 хирургами, оказалось ничтожно малым, чтобы выявить значимые различия. На основании анализа крупных национальных баз данных США [46-49] доказано, что эффективность нейрососудистых вмешательств, включая шунтирующие, напрямую зависит от количества выполняемых операций в конкретном учреждении. Анализ 558 операций ЭИКМА (данные Общенационального стационарного реестра США по выписанным больным) продемонстрировал связь между количеством операций и лучшими результатами лечения, при этом отношение шансов составило 0,45 при 10-кратном увеличении объема пролеченных больных [46]. Высокий процент проходимости шунтов (98% в 30-дневный период и 96% в течение 723 дней после операции) в исследовании COSS можно считать показателем успешности выполненной операции и достаточного опыта хирурга. Хотя 15% частоты послеоперационных осложнений, с которыми столкнулись исследователи COSS, не «выходит» за рамки прогнозируемых и рассчитанных на основании результатов исследований EC-IC Bypass, завершенном в 1985 г., она все-таки не является идеалом, к которому нужно стремиться. Появившиеся новые технологии анестезиологического обеспечения, интенсивной терапии и реабилитационных мероприятий не должны провоцировать «рост» послеоперационных осложнений. Нейрохирурги из центров с большим хирургическим опытом также придерживаются мнения [50-53], что 15% — это «не самое лучшее, чего мы смогли достичь», оперируя больных с окклюзирующими поражениями магистральных артерий головы, кровоснабжение головного мозга у которых находится на грани гемодинамической декомпенсации, формально имеющих повышенные хирургические риски. Проще говоря, для того чтобы польза от хирургического лечения стала очевидной, требуется проведение сходного по количеству больных клинического исследования, при этом показатели по периоперационному инсульту должны быть снижены в 2 раза по сравнению с исследованием COSS [36].
Исследование COSS продемонстрировало в хирургической группе больных тенденцию к снижению частоты ишемических эпизодов в отдаленные сроки после операции. Сходные результаты были получены японскими исследователями, предварительно сообщившими о снижении частоты инсульта после операции ЭИКМА. В исследовании JET [54, 55] риск периоперационного инсульта приблизился к нулю, что указывает на превосходство хирургического метода лечения над консервативным. К сожалению, окончательные результаты этого исследования пока не опубликованы. Исследование COSS однозначно продемонстрировало улучшение кровоснабжения головного мозга в послеоперационном периоде (подтверждено проведением ПЭТ в динамике). Полученные результаты согласуются с концепцией эффективности реваскуляризации головного мозга путем наложения экстра-интракраниального микроанастомоза, способного предупредить прогрессирование ишемии головного мозга при условии максимального уменьшения рисков периоперационного инсульта. Кумулятивные кривые Каплан-Мейера, смоделированные на 2-летний период и позволяющие сравнивать хирургический и консервативный методы по риску ишемического инсульта, не имеют достоверных отличий, однако не исключено, что их «продление» все-таки продемонстрирует преимущество оперативного метода. Это означает, что если все пациенты будут прослежены в сроки до 5 лет, исследование COSS сможет доказать эффективность хирургического метода (для этого риск развития инсульта должен оставаться неизменным в обеих группах более 2 лет).
О спонтанном улучшении кровоснабжения головного мозга без хирургического вмешательства (в основном за счет развития коллатералей) было сообщено в небольших обсервационных исследованиях, хотя опубликованные результаты носили противоречивый характер. В одном из них [56] сообщалось об улучшении состояния пациентов в отдаленные сроки наблюдения, тогда как в другом [57] улучшение состояния было зарегистрировано в течение первых месяцев с начала наблюдения и не имело продолжительного эффекта в виде снижения риска инсульта в отдаленные сроки. К сожалению, пациентам «консервативной» группы COSS ПЭТ в динамике не выполнялась, поэтому на сегодняшний день нельзя получить достоверных отдаленных результатов, как и прогнозировать вероятность пересечения кумулятивных кривых Каплан-Мейера при анализе результатов лечения.
Важно понимать, что исследование COSS было остановлено по причине неубедительности полученных результатов, не позволивших подтвердить гипотезу (риск развития инсульта 24% в хирургической и 40% в «консервативной» группе). Тем не менее, чтобы разница в рисках составила 10% в пользу хирургического метода лечения, требуется значительное увеличение (до 986) количества пациентов, включенных в исследование, что потребует привлечения дополнительных ресурсов и значительно удорожит его. Однако проведение такого исследования будет иметь значение для клинической практики и позволит получить ответ, который не дало исследование COSS [36].
Больные с рецидивирующей симптоматикой и грубым атеросклеротическим поражением магистральных артерий головы (у которых ишемия головного мозга провоцируется постуральными реакциями либо колебаниями артериального давления) как раз представляют тех пациентов, которым возможно улучшить кровоснабжение головного мозга путем реваскуляризирующих вмешательств. Такие пациенты не были «выделены» в исследовании COSS в отдельную подгруппу. Критерием включения в исследование был 120-дневный срок после ишемического «события», и одним из требований было стабильное состояние пациента, чтобы направить его для проведения ПЭТ (иногда даже требовался авиаперелет до ПЭТ-центра), чтобы принять окончательное решение о необходимости операции. Установлено, что обусловленная атеросклеротическим поражением магистральных артерий головы ишемия головного мозга наиболее часто рецидивирует в ранние сроки с момента появления первичных симптомов. Как правило, риск повторных ишемических атак у таких больных максимален в первые 2 нед с последующим снижением в дальнейшем [58-60]. Согласно опубликованным результатам исследования COSS, среднее время от клинической манифестации до включения пациента в исследование составило 72 дня, что не исключает стабилизации кровоснабжения головного мозга у части больных. Отсутствие повторных ишемических атак в течение 6 дней с момента «включения» в исследование (до выполнения операции) наводит на мысль, что риски прогрессирования ишемии головного мозга у этих больных не были повышенными.
По протоколу COSS для включения в исследование требовалось наличие у пациента единичного ишемического эпизода. По одной из теорий, ишемия головного мозга при окклюзии ВСА — следствие артериальной эмболии, которая вряд ли будет рецидивировать на фоне начатой антитромботической терапии. С другой стороны, критерии отбора пациентов в исследование COSS выглядят обоснованными, поскольку окончательное решение о рандомизации принималось лишь после определения степени расстройств церебральной гемодинамики с помощью ПЭТ. Можно предположить, что у части больных по мере формирования коллатералей наступала компенсация нарушенной гемодинамики, тогда как остальные пациенты оставались в группе повышенного риска и имели рецидивирующую ишемию головного мозга, наличие которой можно объяснить неэффективной медикаментозной терапией. Данные о прогрессировании ишемии головного мозга у включенных в исследование пациентов на сегодняшний день не опубликованы. Вероятно, в COSS было включено недостаточно больных с рецидивирующей ишемией головного мозга, обусловленной прогрессирующей сосудисто-мозговой недостаточностью, которые как раз и являются кандидатами на реваскуляризирующие вмешательства [36].
Хотя COSS прекращено, продолжается вспомогательное исследование, оценивающее когнитивные расстройства у больных с окклюзией ВСА «Рандомизированная оценка каротидной окклюзии и когнитивной функции» (RECON) [61]. Учитывая малое количество пациентов, перенесших реваскуляризацию головного мозга, исследование вряд ли сможет достоверно оценить влияние операции на когнитивные функции, но, вероятно, предоставит подтверждающие гипотезу доказательства, что прирост мозгового кровотока, помимо предупреждения повторного инсульта, также способствует ощутимому клиническому улучшению. Имеются сообщения [62-65] об уменьшении выраженности когнитивных расстройств как после операции ЭИКМА, так и после каротидной эндартерэктомии при стенозах сонных артерий. D. Jussen и соавт. [66], изучающие эффективность операций шунтирования артерий головного мозга у больных с неврологическими «выпадениями» после завершенного инсульта, сообщили об улучшении не только электрофизиологических показателей, но и клинического состояния после операций. Опубликованы результаты исследований [67, 68], предоставивших данные об увеличении мозгового кровотока в ишемизированных участках головного мозга после реваскуляризирующих вмешательств.
Приведенные в настоящем обзоре данные свидетельствуют, что на данный момент еще нет достаточных доказательств, способных подтвердить эффективность хирургического метода лечения. Это произошло, в основном, по причине переоценки ожидаемой заболеваемости инсультом в выбранной популяции больных. С момента завершения исследования EC-IC Bypass (1985) количество выполненных реваскуляризирующих вмешательств при окклюзии сонной артерии ограничилось ничтожно малой популяцией больных, прогрессирование ишемии головного мозга у которых не удавалось приостановить, используя даже максимально доступную антитромботическую терапию [52, 69]. Хотя COSS не предоставило доказательств в поддержку расширения показаний к хирургическому лечению, вероятно, у определенной категории пациентов можно добиться улучшения состояния в виде снижения риска инсульта при условии проведения операций в специализированных центрах и низких периоперационных осложнениях. Если посмотреть шире на проблему реваскуляризации головного мозга при окклюзии ВСА, то помимо предупреждения прогрессирования ишемии, шунтирование артерий головного мозга способно не только уменьшить выраженность когнитивных расстройств, но и улучшить функциональное состояние пациента уменьшением его зависимости либо полным избавлением от посторонней помощи, что должно стать предметом будущих научных исследований.
Осложнения шейно-позвоночного синдрома
Шейно-позвоночный синдром опасен своими осложнениями, которые нередко несут в себе угрозу для жизни пациента. Это заболевание может стать причиной следующих последствий:
- ишемический инсульт в бассейне кровоснабжения позвоночной артерии;
- инфаркт миокарда, ассоциированный с нарушением функции нервно-сосудистого пучка, питающего сердечную мышцу;
- удушье в результате нарушения глотательного рефлекса.
Предупредить все осложнения СПА можно с помощью своевременного и грамотного лечения, которое способен назначить только квалифицированный специалист с большим опытом работы.
Факторы риска
Факторами, воздействующими на артерии и повышающими риск повреждения, формирования бляшек и развитие заболеваний, являются:
- Повышенное артериальное давление.
Повышенное артериальное давление является важнейшим фактором развития атеросклеротического поражения сонных артерий. Воздействие высокого давления на стенку артерии ослабляет ее и делает более подверженной повреждениям. - Курение.
Никотин раздражает внутреннюю оболочку сосудов, а также способствует учащению ритма сердца и повышению артериального давления. - Возраст.
С возрастом стенка артерий теряет эластичность и приобретает большую подверженность к повреждениям. - Нарушение соотношения липидов крови.
Повышенный уровень холестерина липопротеинов низкой плотности («плохого холестерина»)и высокий уровень триглицеридов способствует формированию атеросклеротических бляшек. - Сахарный диабет.
Диабет не только воздействует на способность контролировать уровень сахара крови, но и на липидный обмен, повышая риск артериальной гипертензии и развития атеросклероза. - Ожирение.
Избыток массы тела увеличивает риск возникновения артериальной гипертензии, атеросклероза и сахарного диабета. - Наследственность.
Наличие у родственников атеросклероза или ишемической болезни сердца значительно увеличивает риск формирования атеросклеротического поражения. - Малоподвижный образ жизни.
Недостаток физической активности вносит свой вклад в развитие артериальной гипертензии, ожирения и сахарного диабета.
Зачастую, перечисленные факторы риска присутствуют в совокупности, тем самым повышая степень риска.
Диагностика
Перед тем как лечить синдром позвоночной артерии, врач направляет пациента для прохождения полноценной диагностики состояния его организма. При данном заболевании диагностические мероприятия включают в себя ряд важных методов:
- рентгенография в области шеи, которая помогает определить участки компрессии сосудов;
- ангиографическое исследование сосудов шеи для определения их проходимости, наличия мест сужения просвета, деформаций, тому подобное;
- ультразвуковое обследование шеи и диагностика состояния сосудов, мышц, определение характера кровотока, наличия зон атеросклероза;
- МРТ в области шеи с более глубоким изучением всех нюансов и нарушений;
- биохимический анализ крови с определением уровня холестерина и степени развития атеросклероза.
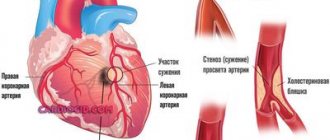
Что такое
В начале стоит разобраться, что такое сонная артерия: в организме человека две сонных артерии, проходящих от грудной клетки через боковые стороны шеи в голову. Основная их задача — питать мозг. Как любая артерия они подтверждены атеросклерозу — серьезному заболеванию, природа которого до конца не изучена, как и причины. Это заболевание проявляется в деформации стенок сосудов, когда ткани, выстилающие сосуд, разрастаются, между ними появляются отложения холестерина, и просвет сосуда становится всё меньше вплоть до полной закупорки (обтурации). По сонным артериям течет обогащенная кислородом кровь для клеток мозга, поэтому сужение просвета сосуда очень опасно – это может стать причиной инсульта.
Медикаментозное лечение
Медикаментозное лечение синдрома позвоночной артерии при остеохондрозе позвоночника и других нарушениях со стороны шейного его отдела включает в себя ряд лекарственных средств, действие которых направлено на возобновление утерянных функций, устранение патологических симптомов и предупреждение развития осложнений. При синдроме позвоночной артерии назначаются:
- противоотечные средства, которые помогают устранить сжатие сосудов соседними тканями;
- миорелаксанты для снятия компрессии и напряжения мышечной ткани;
- препараты для улучшения питания головного мозга;
- сосудистые лекарственные формы;
- нейропротекторы, защищающие нервную ткань от ишемии;
- препараты для лечения атеросклероза;
- витамины группы В для укрепления нервных волокон;
- спазмолитики, купирующие головные боли.
Лекарства при синдроме позвоночной артерии можно принимать только с разрешения лечащего врача, не изменяя приписанных специалистом дозировок и не превышая назначенного курса. Важно понимать, что любое самолечение и игнорирование рекомендаций доктора опасно последствиями, которые нередко несут в себе угрозу для жизни пациента.
Причины заболевания
До сих пор не выявлено точных причин возникновения первичных артериитов. Ученым удалось выяснить, что определенную роль в развитии вторичной формы болезни играют некоторые группы бактерий и вирусов. Также не исключается и наследственный фактор, так как часто в одной семье выявляется несколько случаев заболеваемости.
К другим причинам развития воспаления артерий относят прием определенных лекарственных препаратов, а также иммунную реактивность человеческого организма.
Процесс развития болезни начинается с иммунного воспаления артериальной стенки. Воспалительный процесс возникает вследствие формирования в крови аутоантител и иммунных комплексов, оседающих на стенках сосудов. Пораженные клетки выделяют медиаторы воспаления, что приводит к формированию воспалительных очагов.
Физиотерапия
Физиотерапевтическое лечение помогает устранить многие проблемы с нарушением кровотока по сосудам, которые питают головной мозг. При подобных патологических состояниях специалист может принять решение о целесообразности назначения пациенту УВЧ-терапии, электрофореза, грязевых аппликаций, магнитотерапии, тому подобное. Эти современные методики позволяют улучшить питание ЦНС, устранить проявления заболевания, нормализовать кровоток, снизить отечность тканей и снять местное воспаление. Перед физиотерапевтическим лечением стоит проконсультироваться у врача. Для более детальной информации можно пройти по ссылке.
ЛФК
ЛФК при синдроме позвоночной артерии – эффективный метод устранения основных патологических симптомов, результативность которого основана на укреплении мышечных структур шеи, создающих каркас для сосудисто-нервного пучка. С помощью специальных лечебных упражнений удается достичь положительного эффекта терапии и предупредить осложнение процесса. Более подробно о длительности и объемах такого лечения пациенту расскажет врач после изучения клиники его проблемы, масштабов нарушений и наличия осложнений.
Операция при стенозе шейного отдела позвоночника
Операция проводится при неэффективности консервативной терапии или в экстренном порядке при развитии угрожающих состояний. Основной ее целью является устранение факторов, приведших к компрессии спинного мозга и отходящих от него нервных корешков. Поэтому при шейном стенозе выполняются декомпрессионные операции различного рода:
- Классическая дискэктомия – открытая операция, выполняемая через разрез мягких тканей до 10 см по передне-боковой поверхности шеи. Она применяется при развитии шейного стеноза на фоне образования межпозвонковой грыжи крупного размера и предполагает удаление всего диска, который впоследствии может заменяться титановым кейджем или эндопротезом.
- Декомпрессионная ламинэктомия – подразумевает удаление части дуги позвонка с последующей стабилизацией позвоночно-двигательного сегмента конструкциями различного рода.
Их задачей является удаление грыж межпозвонковых дисков или всего диска, дужек позвонков и других анатомических структур, которые стали причиной сдавливания спинномозгового канала и его корешков. Выбор тактики хирургического вмешательства зависит от того, с какой стороны позвоночного канала присутствует сужающее его выпячивание.
Декомпрессионные операции на шейном отделе позвоночника сегодня могут выполняться через передний и задний доступ. Первый вид доступа подразумевает выполнение разреза на передне-боковой поверхности шеи и используется с целью удаления межпозвонковых дисков и их грыж при:
- кифозе;
- диагностировании с помощью МРТ передней компрессии спинного мозга;
- стенозе позвоночного канала, протяженность которого превышает размеры 2-х позвонков;
- выраженной нестабильности позвоночника.
При выборе заднего доступа разрез осуществляется на задней поверхности шеи, т. е. со стороны спины. Хирургическое вмешательство с таким доступом используются для проведения ламинэктомии. Показаниями к их осуществлению являются:
- протяженная задняя компрессия;
- шейный лордоз;
- обызвествление задней продольной связки;
- конгенитальный стеноз.
После того, как причина стеноза устранена, требуется зафиксировать сохраненные анатомические структуры позвоночника в правильном положении, устранить вероятность их смещения в будущем и избежать развития вторичного стеноза. В этих целях выполняются стабилизирующие операции с установкой систем неподвижной и динамической стабилизации, каждая из которых имеет свои конструктивные особенности:
- Системы для передней стабилизации – предназначены для неподвижного соединения тел позвонков. Чаще всего устанавливаются титановые пластины и винты или кейджи, заполненные костной крошкой.
- Системы для задней стабилизации – используются для соединения остистых и поперечных отростков, но если требуется стабилизировать средние и задние опорные столбы позвоночника подобные конструкции не всегда могут обеспечить требуемую степень фиксации.
- Имплантат DCI – специально разработанная для стабилизации шейного отдела позвоночника конструкция, использующаяся для замены удаленного межпозвонкового диска. Она обеспечивает сохранение практически естественной амплитуды движения шеи и обладает достаточными показателями прочности и износостойкости.
Если ситуация позволяет, предпочтение всегда отдается использованию систем динамической стабилизации. Благодаря им можно сохранить нормальную подвижность шеи, но если прооперированный позвоночно-двигательный сегмент имеет признаки нестабильности, подобные конструкции нельзя устанавливать, так как они не смогут зафиксировать позвонки в нужном положении.
Таким образом, шейный стеноз в подавляющем большинстве случаев является следствием отсутствия своевременного лечения заболеваний позвоночника, в том числе таких распространенных, как межпозвонковые грыжи шейного отдела. Это угрожающее инвалидностью и летальным исходом состояние иногда удается устранить с помощью консервативных методов, но все же чаще для этого требуется участие нейрохирурга.
Современные операции на шейном отделе позвоночника отличаются достаточно высоким уровнем безопасности и значительно реже приводят к возникновению осложнений, чем отсутствие грамотного лечения шейного стеноза. Но все же лучше не допускать развития столь грозного осложнения и своевременно лечить имеющиеся болезни позвоночника.