23 декабря 2020
Это рентгенохирургическая процедура, которая используется и в онкологии для ухудшения кровоснабжения опухолевых тканей. Злокачественное новообразование формирует вокруг себя сеть сосудов, по которым к нему поступает кислород и питательные вещества, необходимые для размножения клеток опухоли. Эмболизация, то есть закупорка, перекрытие таких сосудов оставляет новообразование без притока крови, что ведет к постепенной остановке его роста за счет отмирания злокачественных клеток.
Как проводят эту процедуру?
Эмболизация – это малоинвазивный, то есть не связанный с масштабными хирургическими вмешательствами, метод лечения. Иногда он может даже послужить альтернативой традиционной операции.
Доступ к области, в которой находится опухоль, врачи получают через крупные сосуды человеческого тела, расположенные по соседству. Через очень небольшой разрез в тот или иной сосуд вводят катетер и медленно перемещают его к новообразованию. Вся эта процедура проходит под контролем рентгеноскопии – врач видит, куда и насколько он продвигает катетер.
По достижении сосуда, питающего опухоль, через катетер вводят эмбол – вещество или устройство, которые призваны закупорить сосуд, остановить кровообращение в нем. После этого делают несколько ангиографических снимков для того, чтобы удостовериться, что операция прошла успешно, и эмбол установлен именно там, где требовалось. Чаще всего такие вмешательства проходят под местной анестезией, но иногда, например, при эмболизации опухолей в печени, используют и общий наркоз.
Материал и методы
В отделении хирургии сосудов головного мозга Российского научно-исследовательского нейрохирургического института имени профессора А.Л. Поленова — филиала ФГБУ «Национальный медицинский исследовательский центр им. В.А. Алмазова» Минздрава России в 2018 г. прооперировано 13 пациентов с церебральными АВМ путем эмболизации неадгезивными эмболизатами на фоне аденозин-индуцированной кардиоплегии. Оценку необходимости выполнения кардиоплегии проводили на дооперационном этапе по данным спиральной компьютерной томографии и магнитно-резонансной томографии сосудов, а также по данным предоперационной селективной ангиографии. Особое внимание обращали на наличие высокоскоростных артериовенозных фистул (АВ-фистул), представляющих собой расширенный афферентный сосуд, напрямую впадающий в расширенную вену или венозную лакуну. Следует обратить внимание на то, что подобных фистул в структуре даже одной АВМ может быть несколько. Заполнение дренажных вен в ранней артериальной фазе также считали признаком наличия высокопотоковой АВ-фистулы. Мужчин было 9, женщин — 4. Средний возраст составил 36,2 года (21—58). Распределение АВМ по шкале Spetzler—Martin (SM) представлено в табл. 1.
Таблица 1. Распределение пациентов по шкале Spetzler—Martin
Примечание. SM — шкала Spetzler—Martin.
АВМ располагалась в лобной доле у 1 пациента, в теменной — у 2, в затылочной — у 3; занимала более одной доли в 5 случаях. Субтенториальные АВМ установлены у 2 пациентов. Сочетание АВМ с церебральными аневризмами выявлено у 5 больных, при этом в нашей серии все аневризмы располагались в бассейнах, не заинтересованных в кровоснабжении АВМ. Геморрагический тип течения отмечен у 3 пациентов, эпилептический — у 5, другие варианты течения — у 5. Все пациенты до операции осмотрены кардиологом, всем рутинно выполнены электрокардиография и эхокардиография, по показаниям применялись стресс-тесты. Абсолютными противопоказаниями к проведению данного метода считали наличие атриовентрикулярной блокады II и III степени, нестабильной стенокардии. Для эмболизации использовали DMSO-совместимые микрокатетеры Sonic (BALT EXTRUSION SAS, Франция) и неадгезивные эмболизаты ONYX (EV3 International Inc., США и SQUID Embo Flüssigkeiten AG, Швейцария).
Какие есть типы эмболизирующих материалов?
- жидкие среды, которые способны легко проникать в сложные разветвления мелких сосудов, обеспечивая повышенную точность воздействий;
- склерозирующие материалы – они не создают искусственную «пробку», а уплотняют внутренний клеточный слой сосуда, за счет чего его просвет постепенно перекрывается;
- эмболизирующие микрочастицы;
- устройства для механической закупорки сосуда: спирали, баллоны и т.д.
Наиболее эффективным способом сосудистой эмболизации в современной онкологии считается химиоэмболизация с использованием микросфер. Микросферы представляют собой полимерные частицы шарообразной формы и диаметром от 50 до 200 мкм. Их диаметр также можно подбирать в зависимости от ожидаемого размера сосудов, питающих опухоль. После введения эти частицы «застревают» в просвете сосудов, вызывая их необратимую эмболизацию. Кроме того, перед вмешательством микросферы также насыщают препаратами для химиотерапии. После закупорки сосуда они начинают высвобождать эти цитостатические лекарственные вещества и могут поддерживать их терапевтическую концентрацию до месяца.
Обсуждение
Аденозин является природным эндогенным пуриновым нуклеозидом, состоящим из молекулы аденина, присоединенной к рибозо-сахарному фрагменту (рибофуранозе) через бета-N9-гликозидную связь (6-амино-9-b-D-рибофуранозил-9-H-пурин) [3]. Аденозин снижает частоту сердечных сокращений и продлевает проводимость через синоатриальный и атриовентрикулярный узлы [4]. Вводимый в виде внутривенного болюса аденозин может вызывать преходящую асистолию с сопутствующей остановкой кровотока [5]. Он имеет короткий период полураспада (менее 10 с), что связано с быстрым обратным захватом эритроцитами и эндотелиальными клетками сосудов и ферментативным разрушением. Влияние на частоту сердечных сокращений развивается в течение 10—20 с после введения, продолжительность асистолии достигает плато от 40 до 60 с при дозе 1 мг на 1 кг массы тела. Относительный период гипотонии составляет 1 мин после асистолии [6]. В нашей серии период асистолии был несколько короче и находился в промежутке 10—20 с, после чего во всех случаях происходило полное восстановление параметров гемодинамики до исходного уровня.
Нам не удалось найти публикации, посвященные применению неадгезивных эмболизатов на фоне кардиального ареста в лечении АВМ у взрослых пациентов, однако первые сообщения о применении этой методики в сосудистой нейрохирургии появились уже в 80-х годах XX века [7—9] и посвящены открытой хирургии церебральных аневризм. В последние годы появились сообщения об использовании кардиоплегии в открытой хирургии церебральных АВМ. По мнению авторов, данная опция являлась чрезвычайно полезной в случае интраоперационного разрыва АВМ для облегчения поиска источника кровотечения [10]. Параллельно появились публикации, посвященные внутрисосудистой эмболизации АВМ на фоне кардиоплегии, однако основным применяемым эмболизирующим агентом является адгезивный клей [11—13]. Описание сочетания кардиоплегии с введением неадгезивного эмболизата нам удалось найти только в одной публикации, посвященной лечению АВМ вены Галена у детей [14], в которой авторы сообщают о безопасности и надежности применения этого метода в детском возрасте, хотя был проанализирован только один случай. Отдельно следует отметить факт отсутствия в нашей серии явлений тахифилаксии при повторном применении аденозина, что соответствует данным других авторов [5, 8].
При каких онкозаболеваниях показана сосудистая эмболизация?
Эмболизацию с использованием микросфер и одновременным применением препаратов для химиотерапии назначают при:
- первичном раке печени;
- печеночных метастазах опухолей нервной системы, желез внутренней секреции и прямой кишки;
- опухолях желчного пузыря и желчевыводящих протоков;
- раке молочной железы;
- опухолях легких;
- почечном раке;
- раке головки поджелудочной железы;
- опухолях костных структур головы и шеи.
Виды церебральных мальформаций венозно-артериального русла
Патологические образования принято различать по топографо-анатомическому признаку, гемодинамической активности, размерам. Первый параметр характеризует место расположения мальформации в головном мозге, отсюда происходят их названия:
- поверхностные АВМ – сосредоточены в коре больших полушарий мозга (на поверхности мозга) и прилежащих структурах белого вещества;
- глубинные АВМ – локализуются в глубине мозговых извилин, базальных ганглиях, внутри желудочков, в структурах ствола ГМ.
По гемодинамической активности выделяют мальформации:
- активные – к ним причисляют смешанного вида АВМ ГМ (самая частая разновидность, при которой обнаруживается частичная деструкция капилляров) и фистулезного типа (артерия прямо переходит в вену, капиллярная сеть полностью разрушена);
- неактивные – капиллярные (телеангиоэктазии), венозные, артериовенозные кавернозные.
Поражение также оценивается по размерам, учитывается диаметр только клубка мальформации. При диагностике размеров используют следующие наименования АВМ:
- микромальформации – менее 10 мм;
- малые – от 10 мм до 20 мм;
- средние – 20-40 мм
- большие – 40-60 мм
- гигантские – более 6 см в диаметре.
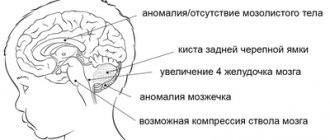
Для предупреждения тяжелой геморрагии и связанных с ней необратимых осложнений крайне важно выявить и устранить очаг в ближайшее время, до разрыва. Почему? Объяснение куда более убедительное – при разрывах слишком большой процент людей погибает (до 75% пациентов) от обширного кровоизлияния, несопоставимого с жизнью.
Необходимо понимать, что сосуды АВМ слишком подвержены прорывам, так как они серьезно истощены на почве ненормального строения и нарушенного тока крови. Одновременно с этим, крупные порочные образования сдавливают и повреждают окружающие мозговые ткани, что несет дополнительную угрозу состоятельности функций ЦНС. Поэтому, если диагноз подтвержден клинически, оттягивать с лечением ни в коем случае нельзя.
Каковы преимущества сосудистой эмболизации?
- Малая инвазивность процедуры – она не требует наложения швов и не оставляет после себя крупных послеоперационных шрамов.
- Минимальный риск инфекционных осложнений.
- Часто нет необходимости использовать общую анестезию, которая всегда становится серьезной нагрузкой для ослабленного организма онкобольного.
- Минимальное время восстановления после вмешательства.
- Высокая эффективность в сравнении с традиционной системной химиотерапией.
- Сохранение целостности и функциональной активности органов и тканей.
Комментарий
Это небольшое сообщение посвящено начальному опыту использования аденозин-индуцированной кардиоплегии при эндоваскулярном лечении высокопоточных артериовенозных мальформаций головного мозга. Проблема эндоваскулярного лечения высокопоточных артериовенозных шунтов заключается в сложности выключения традиционными методами зоны шунтирования из-за высокой скорости кровотока при исходных условиях центральной и локальной гемодинамики пациента. В результате такого шунтирования окклюзирующие устройства или эмболизирующие клеевые композиции могут мигрировать в дренажные венозные коллекторы вплоть до ветвей легочной артерии, вызывая тяжелые осложнения. Наиболее грозным осложнением является интракраниальное кровоизлияние, возникающее при окклюзии дренажных вен при сохранении артериального притока. Предложены различные эндоваскулярные методики остановки кровотока в афферентном сосуде перед введением клеевых композиций. Используются временная окклюзия баллоном, предварительная окклюзия микроспиралями и прочее. В частности, в нашей клинике мы применяем методику частичной имплантации стента в афферентный сосуд, на котором в последующем зацепляются микроспирали, в результате чего достигается их надежная фиксация. После окклюзии сосуда стент отделяется от доставляющей системы.
Авторы для остановки кровотока в зоне артериовенозного шунта предлагают использовать метод медикаментозной кардиоплегии. Такой метод применен у 13 больных с артериовенозными мальформациями головного мозга, в структуре которых есть высокопоточные шунты. Клинически значимых осложнений операций не было. Однако надо полагать, что не у всех больных возможно применение этой методики. Вероятно, к такой категории пациентов относятся больные с патологией сердца и почек. Сомнительно применение кардиоплегии у детей раннего возраста. Несомненно, что данная методика требует тщательной подготовки пациента и грамотного анестезиологического обеспечения.
Так или иначе, описанная авторами методика медикаментозной кардиоплегии может рассматриваться как одна из опций в выборе метода эндоваскулярной эмболизации высокопоточных артериовенозных шунтов. Хочется пожелать авторам успеха в выбранном направлении и по мере накопления опыта более подробно описать методику, четко определить показания и противопоказания к операции, а также осветить возможные осложнения.
С.Б. Яковлев (Москва)
Как проходит сосудистая эмболизация в клинике «Анадолу»?
Специалисты нашего медицинского центра используют самые современные эмболизационные материалы, а потому этот метод онкологического лечения дает отличные результаты. Кроме того, очень многое зависит от профессионализма врачей, проводящих данную процедуру. В клинике «Анадолу» сосудистую эмболизацию выполняет целая команда высококвалифицированных специалистов: хирург-онколог, химиотерапевт, сосудистый хирург, а также интервенционный радиолог, который обеспечивает контроль введения катетера.
2.Как проводится операция?
Сосудистая система человека представляет собой густую сеть, которая охватывает весь организм, вплоть до самых периферических его участков. По этим питательным «трубопроводам» медицина научилась подводить к страдающим органам миниатюрный инструментарий – катетеры, стенты, спирали, окклюдеры и проч. В диаметре такие инструменты обычно не превышают полутора-двух миллиметров. Их вводят в доступный сосуд через прокол, и затем продвигают уже внутри сосудистой системы до нужной области. Выполняется эта манипуляция под контролем соответствующей рентгено-телевизионной аппаратуры
. Этот современный способ контроля стал возможен благодаря инновационным технологиям, позволившим получить объемную картинку внутренности сосуда с помощью обработки цифрового изображения. Для получения такой подробной картинки, позволяющей исследовать изображение в мельчайших деталях, необходимы минимальные дозы рентгеновского облучения. Таким образом,
оперирующий хирург полностью контролирует ход операции
, точно манипулируя эндоваскулярным инструментарием и направляя его в заданное место установки.
Посетите нашу страницу Нейрохирургия
Эффективность эмболизации
Эмболизационный метод лечения зарекомендовал себя с самой лучшей стороны. О его высокой эффективности можно судить по быстрому исчезновению симптомов заболевания.
Например, при лечении миомы матки уже через 14 дней начинается процесс замещения мышечной ткани узлов на соединительную. При этом узлы существенно сокращаются, не способны расти вновь и провоцировать прогрессирование заболевания. Уменьшение узлов занимает примерно 6-8 месяцев.
Обратите внимание! Эффективность метода доказана клинически. Кроме того, эмболотерапия позволяет перекрыть самые разные сосуды. Пациенты, прошедшие процедуру эмболизации, быстро забывают о боли и дискомфорте, возвращаясь к привычной жизни в кратчайшие сроки.