Физиологические основы
В университетскую программу первых курсов входит изучение строения сердца и его коронарных сосудов. Но чаще всего авторы учебников ограничиваются описанием только крупных сосудов. Клиницисты же используют совершенно иную, но также международную номенклатуру. Коронароангиография и имплантация стентов требуют более подробного описания сосудов сердца, что нашло применение и в международной практике.
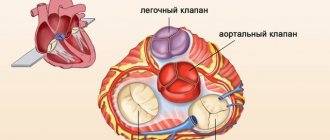
Из курса анатомии каждый узнал, что от аорты отходят две артерии, кровоснабжающие само сердце: левая и правая коронарные артерии. Утолщения на корне аорты, из которых и выходят эти артерии, называются соответственно левым и правым коронарными синусами.
Выделяют следующие части левой коронарной артерии (LCA, left coronary artery): главный ствол, который делится на переднюю межжелудочковую ветвь (ramus interventricularis anterior, RIVA или left anterior descending, LAD), а также огибающую артерию (left circumflex coronary artery, LCх).
Главный ствол этой артерии длиной редко превышает 1 см, а далее делится на две свои конечные ветви. Передняя межжелудочковая ветвь располагается на передней поверхности сердца вплоть до его верхушки. На своем протяжении от этой артерии отходят передние желудочковые ветви (диагональные ветви, RD/R.Diag) и передние перегородочные ветви. В коронароангиографии с целью топического указания места поражения предложено делить коронарное русло на сегменты.
Проксимальный сегмент ПМЖВ начинается своим ответвлением от ствола и продолжается до места отхождения от нее первой перегородочной или первой RD, средняя часть — до ответвления второй перегородочной ветви или второй RD, дистальная — до верхушки сердца/после отхождения второй RD.
- Огибающая артерия всегда располагается на задней поверхности сердца. В ее проксимальной части от нее отходит ветвь тупого края (obtuse marginal artery, obtuse marginal branch, OMB). В зависимости от места этого ответвления различают проксимальную и дистальную части огибающей ветви. Очень редко от главного ствола между передней межжелудочковой ветвью и огибающей ветвью посередине отходит еще одна ветвь, берущая начало непосредственно из общего ствола — промежуточная артерия (RIM, ramus intermedius).
Выделяют следующие три части правой коронарной артерии (RCA): - проксимальную (от устья до первого ее поворота, обычно располагающегося горизонтально),
- среднюю (от первого до второго поворота) и
- дистальную (после второго ее поворота до разделения артерии на ветви у «креста» сердца (crux cordis) — места пересечения задней межжелудочковой и атриовентрикулярной борозд сердца).
Иногда непосредственно после самого устья от сосуда отходит маленькая ветвь — ветвь артериального конуса (ramus coni arteriosi, CB), а также много мелких ветвей к правому предсердию.
Самой главной из этих ветвей является артерия синоатриального узла (S-A node artery, SNA). Она часто располагается под правым ушком сердца. В редких случаях ветвь артериального конуса имеет собственное устье. Этот вариант всегда следует учитывать, поскольку при коронароангиографии можно принять эту артерию за главный ствол правой коронарной артерии. Перекрыв вход в эту артерию катетером, можно вызвать локальную ишемию и, как следствие, нарушения ритма вплоть до трепетания камер сердца. В передней части венечной борозды, в области острого края сердца, от правой коронарной артерии отходит ветвь острого края (acute marginal artery, AMB), чаще от одной до трех, которая в большинстве случаев достигает верхушки сердца.
Итак, перечислим еще раз все сокращения:
Левая коронарная артерия — left coronary artery (LCA): — Передняя межжелудочковая ветвь (ПМЖВ), или передняя нисходящая артерия — left anterior descending artery (LAD); иначе — ramus interventricularis anterior (RIVA/RIA); — Диагональные артерии (ветви) — ДА; ramus diagonalis (RD/Diag); — Огибающая ветвь (ОВ) левой коронарной артерии, огибающая артерия — left circumflex coronary artery (LCх)); — Ветвь тупого края, obtuse marginal artery, obtuse marginal branch, (OMB); — Перегородочные межжелудочковые ветви, ramus septalis (RSA); — Промежуточная артерия, ramus intermedius (RIM).
Правая коронарная артерия — right coronary artery (RCA): — Ветвь острого края, acute marginal artery, (AMB); — Артерия синоатриального узла — ramus nodi sinuatrialis (S-A node artery, SNASA/RNS); — Задняя межжелудочковая ветвь (ЗМЖВ), или задняя нисходящая артерия — posterior descending artery (PDA); иначе — ramus interventricularis posterior (RIVP/RIP).
И еще раз для повторения (важное задание для диагностики локализации ишемии при инфаркте миокарда): LAD/RIVA, LCx кровоснабжает левую камеру спереди и сбоку, а RCA — сзади. Левое предсердие кровоснабжают LCx, RCA. Перегородку — RSA от LAD. Правую камеру сзади — RCA, спереди — RCA, LAD. Правое предсердие — RCA.
Следует также напомнить о доминантности кровоснабжения миокарда. При так называемом правом типе кровоснабжения сердца, наблюдающемся у 70 % людей, задняя нисходящая артерия (PDA) отходит от правой коронарной артерии. При левом типе кровоснабжения сердца (10 % людей) огибающая артерия (LCx) достигает уровня задней межжелудочковой борозды и образует заднюю нисходящую артерию (PDA). При еще более редком, так называемом смешанном содоминантном типе (20 % людей), имеются две задних желудочковых ветви (RIVP/RIP), отходящих от правой венечной и огибающей артерий.
Для понимания принципа работы ЭКГ необходимо повторить строение проводящей системы сердца. Синоатриальный узел находится в стенке правого предсердия, его импульсы поступают к атриовентрикулярному узлу (также располагается в стенке правого предсердия). Далее импульс распространяется по волокнам пучка Гиса, который делится в межжелудочковой перегородке на две ножки — правую и левую (иногда называются ножками Тавары). К эндокарду сигнал поступает посредством волокон Пуркинье. Иногда встречаются и дополнительные пути передачи возбуждения, как, например, по волокнам Кента. Такие пути часто располагаются между предсердиями и желудочками и идут в обход атриовентрикулярного узла. Из-за этого мускулатура миокарда часто сокращается преждевременно, что становится заметно на ЭКГ, а такие пациенты предрасположены к тахикардии (WPW-синдром).
Электрокардиограмма представляет собой не что иное, как запись распространяемых электрических потенциалов сердца, фиксируемых электродами на конечностях и грудной стенке. ЭКГ включает в себя три стандартных отведения по Эйнтховену (I, II, III), и три усиленных по Гольдбергу (aVR, aVL, aVF). Прикрепление еще шести грудных электродов по Вильсону (V1-V6) позволяет зарегистрировать распространение возбуждение по сердечной стенке в горизонтальной проекции. В зависимости от изменений в этих отведениях еще на догоспитальном этапе при помощи ЭКГ можно предположить локализацию инфаркта и возможную «проблемную» артерию.
Например, при инфаркте правых отделов сердца (задней стенки) часто особенно сильно поражается правый желудочек. Чаще всего это происходит из-за тромба в RCA. Правые отделы сердца не способны сокращаться должным образом, что приводит к снижению преднагрузки левой камеры сердца, поскольку таким образом снижается объем крови, транспортируемый к левому предсердию. Сниженный сердечный выброс сердце пытается компенсировать увеличением частоты сокращений. При инфаркте же левых отделов сердца основным осложнением является кардиогенный шок.
Специально для наших подписчиков мы сделали таблицу, в которой показаны изменения ЭКГ в зависимости от локализации возможного повреждения коронарных артерий.
Стоит также повторить и классификацию острых коронарных синдромов:
Нестабильная стенокардия без повышения тропонина. Эта форма классифицируется по Браунвальду на 3 класса в зависимости от выраженности клинических признаков: I — недавно возникшая боль за грудиной (менее 2-х месяцев, более 3-х раз в день); II — боль за грудиной в покое (минимум один раз за прошедший месяц, но не в течении последних 48 часов); III — боль за грудиной в покое (минимум один раз за последний 48 часов).
Нестабильную стенокардию классифицируют на 3 группы по причинам возникновения: А — вторичная нестабильная стенокардия (инфаркт миокарда, анемия, повышение температуры, гипотензия, тахиаритмия, тиреотоксикоз, дыхательная недостаточность); B — первичная нестабильная стенокардия; C — нестабильная стенокардия после инфаркта (минимум 2 недели после инфаркта).
Инфаркт миокарда без элевации сегмента ST (NSTEMI) с повышением концентрации кардиального тропонина в крови. Инфаркт миокарда с элевацией сегмента ST (STEMI) с повышением концентрации кардиального тропонина в крови.
Хирургические методы лечения сосудов сердца
Рентгенохирурги за работой, выполняя ангиопластику и стентирование сердца
Для улучшения кровообращения коронарных артерий проводится баллонная ангиопластика и стентирование.
Метод баллонной ангиопластики подразумевает введение в пораженную артерию специализированного инструмента для раздувания стенок сосуда в месте сужения. Эффект после процедуры сохраняется временно, так как операция не предполагает устранение основной причины стеноза.
Для наиболее эффективного лечения стеноза сосудистых стенок проводится установка стентов в сосуды сердца. Специализированный каркас вводится в пораженный участок и расширяет суженные стенки сосуда, соответственно улучшается кровоснабжения миокарда. Согласно отзывам ведущих кардиохирургов, после проведения стентирования сосудов сердца продолжительность жизни повышается при условии выполнения всех врачебных рекомендаций.
Средняя стоимость стентирования сосудов сердца в Москве составляет от 25 000 до 55 000 рублей, без учета стоимости инструментов; цены зависят от многих факторов: степень тяжести патологии, количество требуемых стентов и баллонов, реабилитационный период и прочее.
Стент раскрыт в коронарной артерии
В плане открытой кардиохирургии всем известна операция аорто-коронарного шунтирования. Ранее требовалась остановка сердца, кардиоплегия, аппарат искусственного кровообращения и т.д. На сегодняшний день такие операции возможны в ряде случаев и на работающем седрце. Также появился вариант – маммарокоронарное шунтирование. Причем последнее также возможно и из минидоступа – через миниторакотомию.
Аортокоронарное шунтирование с АИК
Маммарокоронарное шунтирование
Лучшая помощь при заболеваниях коронарных артерий – это своевременное обращение за квалифицированной помощью для дальнейшей диагностики и лечения сосудистых заболеваний.
ПБКА и стентирование
Sones еще в 1959 году описал метод, позволяющий оценить состояние отдельных коронарных сосудов. Judkins модифицировал описанный метод в 1967 году. Именно этот способ исследования коронарных сосудов применяется и по сей день. Первая транслюминальная баллонная коронарная ангиопластика (ТБКА) была проведена 16 сентября 1977 в Цюрихе в Швейцарии. С этого момента количество пациентов с ОКС, подвергшихся ТБКА, возросло с 10 до 65 %. По последним данным, недавно опубликованным в журнале The Lancet, смертность вследствие сердечно-сосудистых заболеваний в 2010 году снизилась на четверть по сравнению с 1950 годом, когда 400 из 100 000 случаев заканчивались летальным исходом. Первым пациентом был 38-летний мужчина-курильщик, у котого наблюдался стеноз LAD. После операции мужчина прожил еще 37 лет.
При ПБКА баллонный катетер с помощью проводника вводится вплоть до места стеноза. Баллон раздувается и тем самым «сплющивает» атеросклеротические бляшки, растягивая сосудистую стенку. Мелкие повреждения интимы во время раздувания баллона часто не имеют последствий, однако иногда именно в этих местах позже начинается пролиферация тканей, что в 30–40 % случаев приводит к рестенозам и рецидивам в течение последующих трех месяцев. Частота экстренных операций по созданию шунтов (bypass) составляет менее 0,5 %. С помощью имплантации стента сосудистая стенка стабилизируется. Существовала также техника primary stenting — имплантация стента без предшествующего дилатирования сосудов баллоном, однако ныне она используется крайне редко и только на начальных этапах сужения просвета сосуда. Исследования последних лет показали, что при значительных сужениях просвета сосуда, у таких пациентов в первые часы после ангиопластики наблюдалась ишемия миокарда, что требовало немедленного повторного хирургического вмешательства или повторной дилатации. Это осложнение возникает вследствие отрыва бляшки от эндотелия. Обнажение поверхности гладкомышечных клеток приводит к тромбообразованию за счет высвобождения молекул коллагена и тканевых факторов, запускающих каскад свертывания крови. Во избежание развития тромбов и рестеноза в настоящее время чаще всего ангиопластику совмещают с имплантацией стентов на месте стеноза.
Первую имплантацию стента провел Sigwart в 1987 году. Тогда стенты монтировались непосредственно на баллон самим врачом. Сейчас же вся конструкция идет в комплекте, что позволило снизить риск потери стента в кровеносном русле при его недостаточной фиксации.
Появились и новые типы самих баллонов. Некоторые из них имеют на своей поверхности режущие зубцы, что расположены параллельно оси сосуда, а также баллоны из нитинола и нейлона хеликальные или же параллельные оси сосуда. Эти конструкции позволяют создать идеальную площадку для имплантации будущего стента. Сперва в процессе исследований ученые не заметили разницы между такими баллонами и стандартными, однако недавно выяснилось, что такие надсекающие баллоны, покрытые лекарственными средствами, показывают лучшие результаты.
Различают два типа металлических стентов: саморасширяющиеся и прикрепленные к дилатирующему баллону. Исследования показывают, что применение первого типа стентов чаще вызывает развитие неоинтимальной гиперплазии. Поэтому в настоящее время часто используются стенты второго типа. Как правило, они состоят из металлической трубочки, в которой с использованием различных техник создаются отверстия. После расширения сосуда баллонным катетером в его просвете создается сеть, обволакивающая его стенки изнутри. Прототипом такого типа стентов являлся стент Palmaz-Schatz, который сейчас уже не применяется.
Исследование 1994 года не показало разницы между имплантацией такого стента и обычной ангиопластикой. Развитие этого направление позволило разработать новые типы стентов. Чаще всего они состоят из нескольких модулей, соединенных коннекторами. Изначально их производили из стали, однако сейчас в качестве материала для изготовления стентов используется платина, кобальт, нитинол (никель-титан), а также только титан. Из-за этого они стали существенно меньше и легче. РКИ выявили преимущества стентов с толстым каркасом перед таковыми с тонким. Предполагают, что они меньше травмируют сосуды, предотвращая таким образом реэндотелизацию.
Существуют также стенты с особым покрытием, создающим непроницаемый для крови барьер. К таким вещества относят политетрафторэтилен и полиэтилен. Сперва их использовали для экстренного закрытия небольших перфораций коронарных артерий, однако сейчас их применяют в профилактике коронарных аневризм и артериовенозных фистул.
Drug-eluting-stents (DES) покрыты специальными веществами, подавляющими пролиферацию клеток эндотелия, таким образом препятствуя рестенозированию сосуда, чаще всего развивающемуся в течение 4–8 месяцев после имплантации.
Стенты – ферромагнетики, плотно устанавливающиеся в сосудистом русле не являются противопоказанием для проведения МРТ.
Существуют специальные стенты для позиционирования их в устьях и разветвлениях сосудов. Как и любой инородный объект в кровеносном русле, стенты являются дополнительным фактором тромбообразования. Поэтому после самой процедуры пациенту всегда назначают ДААТ или ТАТ.
Возможные риски при коронарной ангиопластике
Хотя ангиопластика является менее инвазивным способом, чем шунтирование это процедура по-прежнему сопряжена с некоторыми рисками. Риски могут быть связаны с самой процедурой и ее отдаленными исходами.
Ранние риски:
- Кровотечение. Возможно кровотечение в ноге или руке, где был проведен доступ к сосуду. Обычно просто развивается синяк, но иногда бывает серьезное кровотечение, что может потребовать переливания крови или хирургической операции.
- Сердечный приступ. Нарушения коронарного кровообращения в процессе операции развиваются очень редко, однако иногда из-за технических причин может развиться разрыв или расслоение коронарной артерии. Эти осложнения могут потребовать экстренной операции коронарного шунтирования.
- Проблемы с почками. Контрастное вещество, используемые при ангиопластике и установке стента может привести к повреждению почек, особенно у людей, которые уже имеют проблемы с почками. Если вы находитесь в группе повышенного риска, ваш врач может предпринять шаги, чтобы защитить ваши почки, такие как ограничение количества контрастного вещества и увеличенную водную нагрузку для разбавления контраста.
- Ишемический инсульт. Во время ангиопластики, инсульт может произойти, если при проведении катетера через аорту отрываются кусочки бляшки. Инсульт-крайне редкое осложнение коронарной ангиопластики. Для его предупреждения назначаются препараты снижающие свертываемость крови.
- Аритмия сердца. Во время процедуры, сердце может биться слишком быстро или слишком медленно. Такие аритмии обычно непродолжительны, но иногда требуется установка временного кардиостимулятора.
Поздние осложнения
- Повторное сужение артерии (рестеноз). При ангиопластике без стентирования частота рестеноза составляет примерно 30% случаев. Стенты были разработаны для уменьшения рестеноза. Использование простых металлических стентов уменьшает вероятность рестеноза до 15%, и использование стентов с лекарственным покрытием снижает риск до менее 10%.
- Тромбоз стента. Сгустки крови (тромбы) могут закрыть артерию, вызывая сердечный приступ. Для уменьшения риска тромбоза важно принимать аспирин, клопидогрель (Плавикс), что помогает уменьшить риск образования тромбов в стенте. Никогда не прекращайте прием этих лекарств без обсуждения с врачом.
Брахитерапия
Этот метод основан на радиоактивном облучении коронарных артерий при рецидивах после имплантации стентов. Для этого используется бета-излучение, поскольку оно способно проникать лишь на несколько миллиметров внутрь толщи ткани. При этом методе катетер вводят в место стеноза, который прежде был дилатирован баллоном. С помощью этого катетера зону определенное количество времени (3–5 минут) облучают рассчитанной дозой. Васкулярная брахитерапия используется с 1996 года. В феврале 2005 года прекратила свое существование фирма, разрабатывающая аппараты для брахитерапии коронарных сосудов (Beta-Cath-System).
Диагностика сосудов сердца
Наиболее информативным методом, как проверить сосуды сердца является ангиография. Для исследования коронарных артерий применяется селективная коронарография сосудов сердца – процедура, позволяющая оценить состояние сосудистой системы и определить необходимость проведения хирургического вмешательства, но имеет противопоказания и в редких случаях приводит к негативным последствиям.
В ходе диагностического исследования выполняется прокол бедренной артерии, через который вводится катетер к сосудам сердечной мышцы для подачи контрастного вещества, в результате чего на мониторе выводится изображение. Далее выявляется участок сужения стенок артерии и рассчитывается его степень. Это позволяет специалисту спрогнозировать дальнейшее развитие болезни.
В Москве цены коронарографии сосудов сердца в среднем варьируют от 20 000 до 50 000 рублей, к примеру центр сердечно – сосудистой хирургии Бакулева предоставляет услуги качественного исследования коронарных сосудов, стоимость процедуры стартует от 30000 рублей.
Ротаблационная пластика
Этот метод используется с 1989 года. В сосуд вводится алмазный бор, способный вращаться с частотой 190 000 об. в минуту. С его помощью удаляются ткани в месте рестенозирования. Величина таким образом измельченных частиц составляет 5–10 микрометров (длина эритроцита — 7,5 микрометров). Образуемый канал очень небольшой в диаметре, но достаточный для проведения ПТКА. Как правило, метод используют в случае образования на месте рестеноза кальцификатов. Диаметр головки бора варьируется от 1,25 до 2,5 мм. Поскольку кабель для ротаблационного бора плохо проходит место стеноза, успех операции составляет 80–95 %. К осложнениям относят спазмы сосудов, возникающие чаще (5 %), чем при ПТКА.
Общие методы лечения сосудов сердца
Для лечения и укрепления сосудов используют комплексные методы, состоящие из корректирования питания и образа жизни, медикаментозной терапии и хирургического вмешательства.
Общие рекомендации:
- соблюдение диетического питания, с повышенным употреблением свежих овощей, фруктов и ягод, что является полезным для укрепления сердца и сосудов;
- назначаются легкие гимнастические упражнения для сердца и сосудов в домашних условиях, рекомендуется плавание, бег трусцой и ежедневные прогулки на свежем воздухе;
- назначаются комплексы витаминов для сосудов головного мозга и сердца с повышенным содержанием ретинола, аскорбиновой кислоты, токоферола и тиамина;
- применяются капельницы для поддержания сердца и сосудов, питающие и восстанавливающие в минимальные сроки структуру тканей и стенок;
- используются лекарства для сердца и сосудов, снижающие болезненные ощущения, выводящие холестерин, снижающие АД;
- новой методикой для улучшения деятельности сердца и сосудов является прослушивание лечебной музыки: американские ученые доказали положительное влияние на сократительную функцию миокарда во время прослушивания классической и инструментальной музыки;
- хорошие результаты наблюдаются после использования народной медицины: некоторые лекарственные растения оказывают укрепляющее и витаминное действие для сердца и сосудов, наиболее популярными являются отвар боярышника и пустырника.
Интраваскулярный ультразвук
Еще одним инструментом кардиолога является метод интраваскулярного ультразвука (IVUS). В сосуд вводят ультразвуковой зонд. Порядок манипуляций напоминает таковой при ПТКА: после позиционирования проводника зонд проводят к месту стеноза. Ультразвук позволяет просмотреть 1 мм тканей на расстоянии от излучателя. Всего на верхушке катетера используется 64 таких кристалла (пьезоэлемента). С помощью этого метода возможно определить состав бляшек и их фибринные, липидные и кальциевые составляющие. Чаще всего к ультразвуку прибегают при неоднозначности ангиографической картины, используя как дополнительный метод обследования.
Всех нас на физиологии мучили графиками давления в сосудах. Мало кто на младших курсах мог подумать, что эти данные действительно используются в диагностике. При каждой коронароангиографии исследуют давление в коронарных артериях и его изменения в зависимости от наличия стенозированных участков. Для этого к исследуемому участку подводят детектор диаметром 0,014 дюймов. Этот катетер продвигают до самого конца коронарной артерии. Потом его тянут обратно. Таким образом фиксируется давление на всем протяжении артерии. На мониторе врачи наблюдают изменение давления; в месте наибольшего его перепада чаще всего и оказывается самый стенозированный участок. Постепенное изменение давления является свидетельством диффузного заболевания сосудов. Важно откалибровать детектор до самого исследования. После аппликации аденозина наблюдается гиперемия, то есть увеличение циркуляции крови, что симулирует состояние нагрузки. После этого давление на протяжении сосуда измеряется еще раз, что позволяет определить, являются ли места стенозирования важными, вызывают ли именно они боли у пациента при физических нагрузках. Аденозиновый тест не является безопасным: возможно развитие нарушений сердечного ритма, однако из-за короткого периода полувыведения аденозина лишь кратковременно.
Причины нарушения коронарного кровообращения
Процесс развития атеросклероза коронарной артерии
Основной причиной развития ИБС являются атеросклеротические отложения на сосудистых стенках. Другие причины нарушения кровообращения заключаются в:
- неправильном питании (преобладание животных жиров, жареных и жирных блюд);
- возрастные изменения;
- мужчины в несколько раз чаще страдают заболеваниями сосудов;
- сахарный диабет;
- лишний вес;
- генетическая предрасположенность;
- стойкое повышение АД;
- нарушенное соотношение липидов в крови (жироподобных веществ);
- вредные привычки (курение, употребление спиртных напитков и наркотических веществ);
- малоподвижный образ жизни.
Спазмы коронарных сосудов и ацетилхолиновый тест
Спазмы коронарных артерий часто являются причиной болей за грудиной в ночное время суток у пациентов без видимых изменений коронарных сосудов. Таким пациентам также назначают коронароангиографию и проводят вышеуказанный провокационный тест, чтобы исключить психогенные или некардиальные причины таких симптомов. Сейчас у каждого человека, уже сдавшего физиологию, должна промелькнуть мысль: «Почему ацетилхолин?». Если вы не находите ответа, возможно, придется снова открыть учебник. Дело в том, что эндотелий сердца при аппликации ацетилхолина вырабатывает NO, что приводит к расширению сосудов. Ацетилхолин оказывает вазоконстрикторное действие на гладкомышечные клетки сосудов в результате прямой их стимуляции, если эндотелий поврежден. Таким образом можно отличить здоровый эндотелий от поврежденного. Здоровые сосуды реагируют на ацетилхолин расширением, поврежденные же сужаются. При сужении сосудов более чем на 75 % по сравнению с аппликацией нитроглицерина внутрикоронарно говорят о коронарном спазме.
Источники:
- М. Winkhardt. Das Herzkatheterlabor (Einführung in die Aufgabenbereiche des kardiologischen Assistenzpersonals). Steinkopff Verlag Darmstadt, 2005.
- Byrne R. A. et al. Coronary balloon angioplasty, stents, and scaffolds //The Lancet. – 2022. – Т. 390. – №. 10096. – С. 781-792.
Атеросклеротическое поражение сосудов сердца
Атеросклеротическая болезнь сердца и сосудов – это опасное поражение сосудистых стенок, характеризующееся образование холестериновых бляшек, которые становятся причиной стеноза и препятствуют нормальному поступлению кислорода и питательных веществ к сердцу. Симптомы атеросклероза сосудов сердца чаще проявляются в виде приступов стенокардии, приводят к инфаркту миокарда, кардиосклерозу, а также истончению сосудистых стенок, что грозит их разрывом и без своевременного лечения приводит к инвалидности либо летальному исходу.