Софья Касацкая «Природа» №2, 2016
Об автореСофья Алексеевна Касацкая — младший научный сотрудник лаборатории геномики адаптивного иммунитета Института биоорганической химии им. академиков М. М. Шемякина и Ю. А. Овчинникова РАН. Область научных интересов — Т-клеточный иммунитет, нейро- и онкоиммунология. Победитель конкурса «Био/мол/текст» 2015 г. в номинации «Лучшая статья по иммунологии». |
Адекватная защитная реакция организма на вторжение вирусов, бактерий и других патогенов — уничтожить пораженные клетки, не допустив распространения инфекции и гибели большого числа собственных клеток. Если инфицированная вирусом клетка его заметила, запускаются процессы врожденного иммунитета: аутофагия (утилизация внутренних компонентов клетки с помощью ферментов лизосом) и апоптоз (запрограммированная гибель клеток). Однако патогенных вирусов и бактерий очень много, к тому же они постоянно меняются до неузнаваемости. Чтобы справиться с ними, подключается система адаптивного иммунитета и его главные участники — лимфоциты. Вершиной эволюции адаптивного иммунитета стал цитотоксический Т-лимфоцит, или Т-киллер. Для распознавания фрагмента вируса (антигена) на зараженной клетке он использует Т-клеточный рецептор (T cell receptor
, TCR), случайно и независимо собирающийся на каждой Т-клетке в вилочковой железе (тимусе). Механизм сборки TCR уникален и присущ только иммунной системе позвоночных животных. Считается, что эти преимущества впервые получили примитивные рыбы около 500 млн лет назад, когда в результате ретровирусной инфекции в их гаметы внедрились гены, кодирующие особые белки (рекомбиназы), ответственные за рекомбинацию генов TCR.
Классическая иммунология человека построена на изучении иммунных клеток крови просто потому, что образец крови можно взять у любого пациента и исследовать в норме и в патологии. Именно на клетках крови была выстроена классификация Т-лимфоцитов — деление на Т-киллеры и Т-хелперы, которые проверяют антигенную специфичность Т-киллеров, выдают им «лицензию на убийство» и способны управлять всем ходом иммунного ответа через сигнальные растворимые молекулы, цитокины. Позднее из ветви Т-хелперов была выделена группа регуляторных Т-клеток, подавляющих избыточный адаптивный иммунитет.
Но, как нам напоминает реклама йогурта, значительная часть клеток иммунной системы сосредоточена вокруг слизистой оболочки пищеварительного тракта и в других тканях. В то время как в 5–6 л крови взрослого человека находится около 6–15 млрд T-лимфоцитов, в эпидермисе и коже — 20 млрд Т-клеток [], в печени — еще 4 млрд []. Достаточно ли изучения образцов крови для полного описания функций Т-клеток, если в периферических органах Т-клеток больше, чем в кровотоке? И достаточно ли классических субпопуляций, чтобы описать все типы Т-клеток, находящихся в организме человека?
Жизненный цикл Т-лимфоцита
Каждая Т-клетка после сборки TCR проходит тестирование на функциональность случайно собранного рецептора (положительная селекция) и на отсутствие специфичности к собственным антигенам организма, т.е. на отсутствие очевидной аутоиммунной угрозы (отрицательная селекция). Этапы селекции происходят в вилочковой железе; при этом более 90% клеток-предшественников погибает, не сумев правильно собрать рецептор либо пройти селективный отбор. Выжившие Т-клетки пролиферируют и выходят из тимуса в кровоток — это наивные Т-лимфоциты, еще не встречавшиеся с антигеном. Наивная Т-клетка циркулирует в крови и периодически заходит в лимфоузлы, где в Т-клеточной зоне контактирует со специализированными клетками, которые представляют ей чужеродный антиген.
Миграция эффекторной Т-клетки в ткань при вирусной инфекции []. Сигналы воспаления от зараженных эпителиальных клеток при участии резидентных клеток передаются эндотелию сосудов, клетки которого привлекают эффекторные Т-клетки хемокинами CXCL9, CXCL10. Роллинг:
при движении по посткапиллярной венуле в ткани эффекторная клетка замедляется, образуя временные контакты с Е-селектинами и P-селектинами на клетках эндотелия.
Остановка:
эффекторная клетка плотно прикрепляется к эндотелию при взаимодействии LFA-1 и других альфа-интегринов с ICAM-1 / VCAM-1 / MAdCAM-1 (на эндотелии).
Трансмиграция:
эффекторная Т-клетка связывает эндотелиальный JAM-1 молекулами PECAM, CD99, LFA-1 и проникает через клетки эндотелия в подслизистую
После встречи с антигеном в лимфоузле Т-клетка приобретает способность снова делиться — становится предшественницей Т-клеток памяти (Stem Cell Memory T cells
, TSCM). Cреди ее потомков появляются клетки центральной памяти (
Central Memory T cells
, TCM) и эффекторные клетки-предшественники (
Effector Memory T cells
, TEM), которые при делении дают короткоживущие эффекторные клетки, осуществляющие иммунную реакцию (TEMRA-клетки) []. Все эти клетки выходят из лимфоузла и перемещаются по крови. Эффекторные клетки затем могут покинуть кровоток для осуществления иммунной реакции в периферической ткани органа, где находится патоген. Что потом — снова путешествие по крови и лимфоузлам?
Схема перехода потомков активированных Т-лимфоцитов между популяциями []. Пояснения в тексте
Клетки стромы, т.е. основы лимфоузла, выделяют сигнальные вещества (хемокины) для того, чтобы позвать Т-клетку в лимфоузел. Распознают хемокины лимфоузлов рецепторы хоминга CCR7 и CD62L. Но на эффекторных клетках оба рецептора отсутствуют. Из-за этого долгое время было загадкой, как эффекторные клетки могут попасть из периферической ткани обратно во вторичные лимфоидные органы — селезенку и лимфоузлы.
Сложный выбор эффекторной клетки.
To home
— процесс хоминга, или миграции Т-клеток, например, в наиболее привычное для наивных клеток место — лимфоузел. Альтернатива — не отправляться в путешествие по организму и превратиться в резидентную клетку ткани
В то же время стали накапливаться данные (о различиях в репертуарах TCR и профилях транскрипции между TEM в крови и в других тканях), которые никак не укладывались в концепцию постоянной миграции Т-клеток между тканями и кровью. Решено было выделить новую субпопуляцию — резидентные клетки памяти (Resident Memory T cells
, TRM), которые населяют определенный орган и не рециркулируют [].
Откуда впервые появляются резидентные клетки ткани? Это потомки эффекторных клеток, которые потеряли способность рециркулировать. Некоторые периферические для иммунной системы ткани, например слизистая тонкого кишечника и брюшная полость, позволяют эффекторным Т-лимфоцитам проникать внутрь свободно, другие — очень ограниченно. Большой поток эффекторных Т-клеток в эти ткани наблюдается только при реакции воспаления. К тканям второго типа относятся головной и спинной мозг, отделенные барьером от иммунной системы, а также многие другие ткани: периферические ганглии, слизистые половых органов и кишечника, легкие, эпидермис, глаза. Разница между двумя типами тканей — в экспрессии дополнительных молекул хоминга для эффекторных Т-клеток, например молекул адгезии MadCAM-1 для проникновения в эпителий [].
Т-киллеры:
Т-киллеры – самая известная субпопуляция лимфоцитов. Они обладают способностью разрушать неполноценные клетки организма, вступая с ними в непосредственный контакт. Их еще называют цитотоксические лимфоциты: «цито» в переводе означает «клетка», значение слова «токсические» объяснять не надо.
Т-киллеры, строго осуществляющие иммунный надзор, агрессивно реагируют на чужеродный белок. Именно они вызывают реакцию отторжения трансплантата при пересадке органов. По этой причине при пересадке человеку любого органа ему некоторое время дают специальные медикаменты, которые угнетают иммунную систему: уменьшают повышенное содержание лимфоцитов и нарушают их взаимодействие. Иначе любая подобная операция заканчивалась бы отторжением нового органа или ткани, а может, даже гибелью пациента, которому такое вмешательство проводится.
Интересен механизм работы этих клеток. В отличие от фагоцитов, активно атакующих, пожирающих и переваривающих чужеродные частицы, Т-киллеры ведут себя на первый взгляд достаточно сдержанно. Своими отростками они прикасаются к объекту, а затем разрывают контакт и «уходят по своим делам». Клетка же, к которой прикоснулся лимфоцит, спустя какое-то время погибает… Отчего?
Дело в том, что во время своего «смертельного поцелуя» Т-киллеры оставляют на поверхности уничтожаемой ими клетки частицы своей мембраны. В местах контакта частицы «разъедают» поверхность объекта нападения. В результате в обреченной на гибель клетке фактически образуется сквозное отверстие. Она теряет ионы калия, внутрь нее входят ионы натрия и вода – так как клеточный барьер нарушается, ее внутренняя среда начинает напрямую сообщаться с внешней… В исходе клетка раздувается проникшей внутрь ее водой, из нее выходят белки цитоплазмы, органеллы разрушаются… Она погибает, а дальше к ней подходят фагоциты и пожирают ее остатки. Вот такое страшное наказание готовит организм всем клеткам, которые были распознаны иммунитетом как «неправильные» или чужеродные.
Резидентные Т-клетки в старении тканей человека
Карта соотношений присутствия отдельных субпопуляций Т-клеток в разных органах человека, как ни странно, была составлена только в 2014 г. Команда Донны Фарбер из медицинского центра Колумбийского университета Нью-Йорка провела сравнение фенотипов Т-клеток, выделенных из крови и тканей доноров органов всех возрастных групп от 3 до 73 лет (всего 56 доноров) []. Анализ субпопуляций Т-клеток при помощи проточной цитофлуориметрии подтвердил многие данные, полученные методами с меньшим разрешением и меньшей статистикой, и некоторые черты описания иммунной системы, перенесенные с иммунологии мыши на человека, к примеру снижение содержания наивных Т-лимфоцитов во всех органах при старении организма.
Уменьшение числа наивных Т-клеток с возрастом связано с быстрым старением вилочковой железы, в которой будущие Т-клетки проходят этапы сборки TCR, проверку его работоспособности и селекцию на отсутствие аутоиммунного потенциала. Важно не только снижение абсолютной численности наивных Т-клеток, но и уменьшение разнообразия репертуара Т-клеточных рецепторов, а значит, и возможности сформировать адаптивный иммунный ответ на ранее незнакомую инфекцию []. Для наивных Т-киллеров подтвердилось прогрессирующее падение численности в крови и лимфоузлах, хотя для наивных Т-хелперов отрицательная корреляция численности с возрастом в данном исследовании оказалась значительной только для вторичных лимфоидных органов, но не для крови.
Пути циркуляции Т-лимфоцитов различных субпопуляций []. Наивные Т-клетки вместе с субпопуляцией TCM путешествуют по кровеносным сосудам и заходят в Т-клеточную зону различных лимфоузлов, в ткани не выходят, хотя в их капиллярах встречаются (красная траектория
). Эффекторные ТEM-клетки перемещаются по лимфо- и кровотоку, могут попасть в лимфоузел, но в Т-клеточную зону не заходят (
траектория лилового цвета
). Резидентные ТRM-клетки (показаны
зеленым
в коже и
различными цветами
в слизистых) перемещаются только внутри ткани (
траектория зеленого цвета
)
Выделение Т-лимфоцитов памяти, эффекторных клеток памяти и короткоживущих эффекторных клеток из слизистых легких, тонкого и толстого кишечника, паховых и мезентериальных лимфоузлов доноров органов позволило впервые оценить динамику данных популяций в тканях человека при старении. Доля центральных клеток памяти ожидаемо растет с течением жизни, в соответствии с ростом числа инфекций, которые успели встретиться организму и попасть в библиотеку памяти иммунной системы. Эффекторные клетки памяти TEM стремительно заполняют нишу для Т-клеток в тканях ребенка, быстро, примерно к 12 годам, вытесняя наивные Т-клетки. Растет и количество терминально дифференцированных эффекторных Т-киллеров (TEMRA), но только в лимфоузлах и в селезенке; в нелимфоидных тканях численность TEMRA падает. Короткоживущие терминально дифференцированные Т-киллеры чаще всего встречаются в крови, селезенке и слизистых легких в любом возрасте, а вот среди Т-хелперов эта субпопуляция представлена исчезающе малым числом клеток. Аналогично мало центральных клеток памяти среди Т-киллеров, преимущественно они находятся в слизистых двух барьерных тканей: легких и кишечника.
Широкими мазками карту распределения Т-лимфоцитов человека можно обрисовать так: наивные Т-клетки путешествуют по крови и периодически заходят во вторичные лимфоидные органы, киллеры TEMRA находятся в крови, селезенке и легких. Для центральных клеток памяти, судя по всему, характерно более индивидуальное распределение по тканям, чем для других субпопуляций: во всяком случае, закономерностей динамики при старении разных тканей выявить не удалось. Эффекторные клетки памяти, включающие и TRM-субпопуляцию, доминируют среди Т-клеток слизистых барьерных тканей. В целом, при старении Т-клеточного иммунитета нелимфоидные ткани проявляют большую стабильность субпопуляций, лимфоидные ткани — большую возрастную динамику типов Т-клеток []. Стабильность тканевых клеток проще объяснить, если разобраться, какие из эффекторных клеток TEM остаются в ткани, становятся резидентными TRM и из каких событий состоит их жизнь после отказа от путешествий по организму.
Т-хелперы:
Задача хелперов на первый взгляд тоже довольно очевидна. Это клетки-помощники («help» значит «помогать»). А кому или чему они помогают? Они индуцируют, стимулируют иммунный ответ: под их влиянием усиливают свою работу цитотоксические лимфоциты. Также хелперы передают информацию о присутствии в теле чужеродного белка В-лимфоцитам, которые выделяют против них защитные антитела. Наконец, хелперы оказывают стимулирующее действие на работу фагоцитов, главным образом моноцитов.
Т-хелперы
Как отличить резидентные клетки тканей от примесей клеток крови?
Резидентные Т-клетки корректно, но неудобно каждый раз определять по способности индивидуальной клетки мигрировать в лимфоузлы, поэтому необходимо составить список характерных признаков, по которым можно выявить принадлежность к этой субпопуляции. Резидентные Т-лимфоциты в тканях — естественных барьерах организма (например в легких и слизистой тонкого кишечника) немного похожи на классические эффекторные клетки крови: экспрессируют маркер активированных клеток CD69, причем экспрессия стабильна в течение жизни при взрослении и старении и характерна для всех нелимфоидных тканей. Но вдобавок CD69 колокализуется с маркером CD103, который обозначает группу молекул адгезии — интегринов, способствующих прикреплению резидентной Т-клетки к эпителию и к фибробластам в подслизистой выбранного органа. Для эффекторных Т-клеток во вторичных лимфоидных органах экспрессия интегринов CD103 совершенно нехарактерна: TEM-клетки постоянно сохраняют подвижный фенотип.
У карты, составленной коллективом Донны Фарбер, есть крупный недочет: неясно, насколько чисто удается выделить Т-лимфоциты из органа, какую долю анализируемых клеток на самом деле составляют Т-лимфоциты крови из капилляров внутри органа.
Особенно остро вопрос загрязнения клетками крови стоит для легких — неслучайно субпопуляционный состав Т-клеток легких неожиданно похож на Т-клетки крови и лимфоузлов. Вопрос загрязнения клетками крови был изящно решен для Т-лимфоцитов мыши: подопытных животных заражали вирусом лимфоцитарного хориоменингита после пересадки трансгенного клона Т-клеток P14, специфичного к данному вирусу. В результате при инфекции большая часть циркулирующих клеток была представлена вирусоспецифичным клоном P14, а его присутствие в тканях можно было выявить с помощью флуоресцирующих антител к TCR P14. Мышам в кровь вводили антитело анти-CD8 к маркеру Т-киллерных клеток, оно быстро распространялось по кровотоку и связывалось со всеми Т-киллерами в крови (но не в тканях). При микроскопии срезов органов легко было отличить резидентные киллерные TRM от только недавно вышедших из крови в орган клеток, помеченных анти-CD8 антителом []. Численность резидентных клеток, подсчитанная этим методом, в 70 раз превышала количество, определенное методом проточной цитометрии; разница меньше чем в два раза наблюдалась только для резидентных клеток лимфоузлов и селезенки. Получается, стандартные методики выделения лимфоцитов из органов плохо подходят для анализа киллерных резидентных клеток и существенно занижают размеры популяции.
Функции В-лимфоцитов:
Лимфоциты у детей и взрослых представлены еще одной важной разновидностью: В-клетками. Последние обеспечивают гуморальный иммунитет (определение происходит от слова humor – жидкость). Функции лимфоцитов В-типа состоят в том, что они вырабатывают антитела – особые вещества, которые оказывают агрессивное воздействие на инородные частицы. Эти вещества растворимы и выделяются лимфоцитами в плазму крови (вот вам и ответ на вопрос: «А при чем тут жидкость?»).
После того, как В-клетки выработали антитела против какого-то объекта, часть из этих лимфоцитов преобразуется в клетки памяти. Они формируют самую настоящую «библиотеку опасностей», хранят информацию о том, с чем столкнулись, и при повторной встрече с агрессором мобилизуют иммунитет на уничтожение «врага».
Работа резидентных Т-клеток: не стоит путать туризм с эмиграцией
Мышиные резидентные клетки тканей в нормальной ситуации почти не перемещаются внутри нелимфоидной ткани и достаточно прочно прикреплены молекулами адгезии к строме органа. Когда резидентные макрофаги той же ткани секрецией цитокинов инициируют реакцию воспаления, ТRM приобретают большую подвижность и патрулируют близлежащий эпителий в поисках зараженных клеток.
Если воспалительная реакция усиливается, то клетки понимают это как сигнал о подкреплении: к работе патрульных TRM подключаются вновь прибывающие из крови TCM- и TEM-клетки. Эти клетки крови куда более подвижны и лучше перемещаются в эпителии. Значит ли это, что именно в крови находятся готовые действовать Т-киллеры среди TEM, а CD8+ TRM выполняют в ткани хелперные и регуляторные функции?
С одной стороны, Т-хелперы по спектру Т-клеточных рецепторов более тканеспецифичны, т.е. пересечений между репертуарами TCR клеток, взятых из разных тканей, совсем мало, тогда как клетки одного клона Т-киллера встречаются в разных тканях среди TEM []. Спектр функций и репертуар антигенной специфичности TRM еще предстоит исследовать, но способности к уничтожению зараженных клеток тканей у TRM-киллеров точно есть. Более того, в модели мышиной инфекции полиомавирусом, протекающей в ткани головного мозга, аффинность вирусоспецифичных Т-клеточных рецепторов резидентных киллерных клеток выше, чем у вирусоспецифичных клеток центральной памяти [].
Однако размер популяции Т-клеток зависит не только от специфичности TCR к инфекциям, которые раньше протекали в данном органе, но и от гомеостатической пролиферации Т-клеток — размножения более удачливых клеток для заполнения емкости органа по числу Т-лимфоцитов. По маркерам CD28 и CD127 на поверхности клеток можно отличить недавно и давно активированные через TCR клетки от тех, которые получили только гомеостатический сигнал к пролиферации от фактора роста IL-7. При старении ткани гомеостатическое размножение клеток начинает преобладать над пролиферацией активированных через TCR клеток.
Независимо от Т-клеточных рецепторов часто функционируют NKT-клетки, тип резидентных клеток печени, встречающихся и в других тканях. Они могут быть активированы NK-клеточными рецепторами через распознавание не индивидуальных антигенов, а общих молекулярных паттернов опасности и тканевого стресса. При активации CD8+ NKT-клетки выделяют цитотоксические гранулы и лизируют подозрительные клетки ткани, к примеру единичные опухолевые клетки и зараженные вирусами клетки, экспрессирующие и выставляющие на внешней мембране стрессорные молекулы. При старении тенденция TRM к активации без Т-клеточного рецептора, через NK-клеточные рецепторы или цитокиновые сигналы, может приводить к ошибочному лизису клеток ткани, недостаточному контролю над хронически зараженными или перерождающимися участками эпителия.
Патологические проявления, связанные с работой резидентных Т-клеток, включают органоспецифичные аутоиммунные синдромы и синдромы хронического воспаления в ткани. Примеры хронического воспаления, поддерживаемого резидентными Т-лимфоцитами, — контактный дерматит и псориаз, а механизмом служит выделение воспалительных факторов IL-17 резидентными Т-киллерами и IL-22 резидентными Т-хелперами дермы. CD8+ эффекторные Т-киллеры, находящиеся в головном мозге, похожи по совокупности мембранных молекул-маркеров на TRM кожи, кишечника и легких и способны подталкивать развитие перемежающегося рассеянного склероза при периодических выбросах воспалительных цитокинов. Неясно, однако, есть ли в норме в головном мозге популяция TRM или же это Т-лимфоциты, оставшиеся в ткани после нейротропной вирусной инфекции [].
Функции резидентных клеток памяти в норме — при отсутствии инфекции или хронического воспаления — могут включать cross-talk
(взаимную регуляцию преимущественно через секрецию цитокинов и костимуляторные молекулы) с неклассическими малоизученными лимфоидными клетками. Ими могут быть ассоциированные со слизистыми γ/δ Т-клетки, несущие альтернативный вариант сборки Т-клеточного рецептора, или лимфоидные клетки врожденного иммунитета (
Innate Lymphoid Cells
, ILC), которые делят с Т- и В-лимфоцитами общие черты эпигенетического ландшафта, но не имеют Т-/В- или NK-клеточных рецепторов [, ].
Предполагаемые функции резидентных Т-лимфоцитов тканей. Часть функций может выполняться во взаимодействии с резидентными макрофагами
TRM клетки контактируют с антигенпрезентирующими клетками тканей — дендритными клетками кожи и резидентными макрофагами тканей. Резидентные миелоидные клетки в разных тканях дифференцированы и слабо похожи друг на друга. К примеру, макрофаги маргинальной зоны селезенки, макрофаги печени и микроглия (макрофаги мозга) будут сильно отличаться и по морфологии, и по спектру функций. Кроме обнаружения антигенов в ткани, резидентные макрофаги заняты регуляцией процессов старения и самообновления тканей, в частности, выделяют факторы роста и цитокины, стимулирующие деление стволовых клеток тканей. В жировой ткани, к примеру, макрофаги стимулируют дифференцировку новых жировых клеток, но при переходе в активированное M1-состояние запускают воспаление и вместо дифференцировки заставляют увеличиваться и набухать имеющиеся жировые клетки. Сопутствующие изменения метаболизма жировой ткани приводят к накоплению жировой массы и в последние годы связываются с механизмами развития ожирения и диабета II типа. В коже цитокины, выделяемые макрофагами и резидентными γ/δ Т-клетками, стимулируют деление стволовых клеток при регенерации эпидермиса и стволовых клеток волосяных фолликулов [, ]. Можно предположить, что хелперные TRM-клетки при патрулировании эпителия и образовании контактов с тканевыми макрофагами могут модулировать спектр и объем выделяемых последними факторов роста для стволовых клеток, воспалительных цитокинов и факторов ремоделирования эпителия — и тем самым участвовать в обновлении тканей.
Иммунная система человека
к.м.н. Гольдинберг Б. М., Васюк Я.В.
Городской центр трансфузиологии учреждения здравоохранения «6-я городская клиническая больница», г. Минск,
учреждение здравоохранения «7-я городская детская поликлиника», г. Минск
ИММУНННАЯ СИСТЕМА ЧЕЛОВЕКА
Введение
Группа органов, имеющих общее происхождение, единый план строения и выполняющая общую функцию называется системой органов. Пять из всех десяти систем органов являются регулирующими (управляющими): нервная, кровеносная, эндокринная, лимфатическая и иммунная. Уточним, что лимфатические органы и лимфатических узлы, которых насчитывается около 600, функционально является частью иммунной системы, а к собственно лимфатической системе относится обширная сеть сосудов, которая проходит почти через все наши ткани, обеспечивая движение жидкости, называемой лимфой.
Слово «иммунитет» происходит от латинского «immunis» (на английском – immunity), что означает «чистый от чего-либо», невосприимчивый к чему-либо. Иммунная система появилась вместе с многоклеточными организмами и развивалась, как помощница их выживанию. Она объединяет органы и ткани, которые гарантируют защиту организма от генетически чужеродных клеток и веществ, поступающих из окружающей среды.
Иммунная система представлена тремя уровнями: органным, клеточным и молекулярным.
Органы иммунной системы человека
Иммунная система включает центральные и периферические органы.
Центральные органы иммунной системы представляют собой красный костный мозг и тимус.
Костный мозг является хранилищем стволовых клеток, из которых образуются клетки крови (рис.1). В зависимости от ситуации, стволовые клетки трансформируются в иммунные В-лимфоциты. При необходимости, определенная часть B-лимфоцитов превращается в плазматические клетки, которые способны вырабатывать антитела.
Рис.1. Костный мозг содержит стволовые клетки
Тимус (или вилочковая железа) – один из главных органов иммунной системы, расположенный у человека за грудиной ниже ключиц, который отвечает за образование Т-клеток иммунной системы в лимфоидных тканях организма (рис.2).
Рис.2. Тимус
К периферическим органам относятся селезенка, миндалины и лимфоузлы, в которых находятся зоны созревания иммунных клеток.
Миндалины, получившие свое название из-за внешней схожести с миндалем, представляют собой скопление лимфоидной ткани в верхней части носоглотки. У человека шесть миндалин: две небные, две грудные и по одной носоглоточной и язычной.
Самыми крупными из них являются небные миндалины, или гланды, которых легко осмотреть самостоятельно в зеркале, если достаточно широко раскрыть рот (рис.3).
Рис. 3. Небные миндалины
Селезенка является самым крупным лимфоидным органом (рис. 4). Кроме того, она может накапливать некоторое количество крови. В экстренных ситуациях селезенка способна послать свои запасы в общий кровоток. Это позволяет улучшить качество и скорость иммунных реакций организма. Селезенка очищает кровь от бактерий и перерабатывает всевозможные вредные вещества. В ней полностью разрушаются эндотоксины, а также остатки умерших клеток при ожогах, травмах или других повреждениях тканей. У людей, оставшихся по какой-либо причине без селезенки, ухудшается иммунитет.
Рис. 4. Селезенка
Лимфатические узлы представляют собой небольшие образования округлой формы (рис. 5), расположенные в грудной полости (бронхолегочные, бронхотрахеальные) и брюшной полости (пейеровы бляшки, аппендикс и другие), окологрудные на поверхности грудной клетки, на шее и на конечностях. Лимфоузел – это один из барьеров на пути инфекций и раковых клеток, играющий роль своеобразной таможни (рис. 5). В нем образуются лимфоциты – специальные клетки, которые принимают активное участие в уничтожении вредных веществ.
Рис. 5. Лимфоузел
Центральные органы иммунной системы отвечают за образование и созревание клеток, а периферические органы обеспечивают защиту, то есть иммунный ответ. Периферические и центральные органы иммунной системы выполняют свои работу только вместе и если выходит из строя какой-либо один из этих органов, то организм лишится защитного барьера.
Компоненты иммунной системы
Современная иммунология различает два взаимодействующих компонента иммунной системы – врожденный и приобретенный виды иммунитета, обеспечивающие развитие иммунного ответа на генетически чужеродные субстанции (сущности).
Врожденный (видовой) иммунитет – наследственно закрепленная система защиты организма человека от патогенных и непатогенных микроорганизмов, а также продуктов тканевого распада. Клетки врожденного иммунитета распознают патоген по специфичным для него молекулярным маркёрам – так называемым «образам патогенности». Эти маркёры не позволяют точно определить принадлежность патогена к тому или иному виду, а лишь сигнализируют о том, что иммунитет столкнулся с возмутителями спокойствия: чужаком или своим, но ставшим для организма предателем (рис.6).
Рис.6. Врожденный иммунитет: главное – спокойствие!
Врожденный иммунитет на клеточном уровне представляют:
- моноциты – предшественники макрофагов (клетки, пожирающие чужеродные частицы). Образуются в костном мозге, затем поступают в кровь, но быстро ее покидают, превращаясь в тканевые макрофаги и дендритные клетки (рис. 7);
Рис.7. Моноцит
- макрофаги и дендритные клетки расположены в коже, слизистых. Обладают подвижностью, переносятся с током крови и лимфы. Они поглощают (фагоцитируют) патоген, и уже внутри себя при помощи содержимого вакуолей растворяют его. Дендритные клетки ветвятся подобно дереву. Благодаря ветвям-антеннам они работают связистами между врожденным и приобретенным видами иммунитета(рис.8);
Рис.8. Дендритная клетка и
и макрофаг
- клетки крови, содержащие в цитоплазме гранулы (гранулоциты): нейтрофилы, эозинофилы и базофилы (рис.9);
Рис.9. Гранулоциты
Нейтрофилы – самые многочисленные иммунные клетки в крови человека. Они циркулируют в крови всего 8-10 часов и бόльшую часть своей жизни путешествуют по тканям организма. При встрече с патогеном они его захватывают и переваривают, после чего обычно сами погибают. Из разрушенных нейтрофилов высвобождаются гранулы, содержащие антибиотические вещества.
Гранулы эозинофилов и базофилов осуществляют химическую защиту организма от крупных патогенов, например, паразитических червей, грибов, внеклеточных бактерий. Однако при чрезмерной активности могут участвовать и в развитии аллергической реакции;
- натуральные (естественные) киллеры или NK-клетки (англ. Natural killer cells, NK cells) – тип цитотоксических лимфоцитов, участвующий в функционировании врождённого иммунитета. Они на высокой скорости уничтожают клетки, инфицированные бактериями и вирусами, а также опухолевые клетки.
Рис.10. Натуральный киллер
Действуют натуральные киллеры с помощью агрессивных веществ перфорина и гранзима, которые наподобие буравчиков «кусают» и разрушают пораженную клетку, ставшую для них мишенью (рис.11)
Рис.11. Проникновение перфорина и гранзима в раковую клетку и ее уничтожение
Молекулярными(гуморальные) факторами врожденного иммунитета являются (рис.12):
- белки, связывающие ионы металлов (железа, цинка), необходимых для жизнедеятельности и размножения патогенов – лактоферрин, кальпротектин, мембранный белок и другие;
- ферменты, генерирующие окислители – кислород и оксид азота:
- ферменты, способные расщеплять клеточную мембрану патогенов – лизоцим, хитиназа, фосфолипаза А2;
- белки и пептиды, нарушающие целостность клеточной оболочки микроорганизма – комплемент, эозинофильный протеин, дефензины и другие.
Рис.12.Гуморальные факторы врожденного иммунитета
Система комплемента – это многокомпонентная самособирающаяся система более 20 сывороточных белков, которые в норме находятся в неактивном состоянии.
После активации проявляются биологические эффекты комплемента: образование мембраноатакающего комплекса для лизиса патогенов, выброса медиаторов воспаления для привлечения фагоцитов и усиления их поглотительной способности.
Цитокины – это система низкомолекулярных белков организма, синтезируемых преимущественно активными клетками иммунной и кроветворной систем, регулирующих межклеточные взаимодействия «универсальный» язык для всех клеток), представленные на рис.13 и 14.
Рис. 13. Цитокины: ИЛ – интерлейкины, которых в настоящее время насчитывается 34 разновидности;
Рис. 14. Разнонаправленность действия цитокинов на примере гамма-интерферона
В результате активации гуморальных и клеточных факторов врожденного иммунитета в течение нескольких часов после внедрения патогена во внутреннюю среду организма формируется базовая реакция инфекционного воспаления (рис. 15)
Рис. 15. Инфекционное воспаление ткани на месте внедрения инородного тела с целью его удаления
Приобретенный иммунитет (или адаптивный – от франц. adapter «приспосабливать») формируется индивидуально в течение жизни под влиянием антигенной стимуляции и, в свою очередь, подразделяется на естественный и искусственный (рис.16).
Рис.16. Адаптивный
иммунитет
Естественный иммунитет формируется при встрече с патогеном, в результате чего в организме вырабатываются защитные иммунные факторы (активный естественный иммунитет), либо они попадают в готовом виде из материнского оргазма в период внутриутробного развития или при грудном вскармливании (пассивный естественный иммунитет).
Искусственный иммунитет создается путем введения вакцин или анатоксинов, которые стимулируют выработку антител против конкретных патогенов или их ядов. При этом с профилактической целью воспроизводится процесс реакции иммунной системы пациента на патоген, но в бессимптомной или легкой клинической форме с сохранением их защитной иммунной силы в течение нескольких месяцев, лет или даже пожизненно (искусственный активный иммунитет). Когда необходимо быстро и на короткое время защитить пациента от реального риска встречи с патогеном во время эпидемии или нейтрализовать уже проникший в его организм патоген применяются иммуноглобулины (антитела) как в очищенном виде, так и в дозированных объемах плазмы или сыворотки, полученных из крови донора (человека или животного). Применение готовых антител формирует пассивный искусственный иммунитет, сохраняющийся 2-3 недели.
Адаптивный иммунитет основывается на трех главных процессах:
- распознавание антигенов (как правило чужеродных для организма) с помощью рецепторов;
- удаление (элиминация) распознанных чужеродных агентов (рис. 17);
- формирование иммунологической памяти о контакте с антигеном, позволяющей быстрее и эффективнее удалять этот антиген при повторном его распознавании.
Рис.17.Варианты реагирования иммунной системы на пересадку органов или тканей, возникновение злокачественных новообразований и инфекций
Иммунокомпетентными клетками адаптивного иммунитета являются лимфоциты, которые живут в организме человека от нескольких месяцев до несколько лет. По функциям клетки подразделяются на Т-лимфоциты – 80% и В-лимфоциты – 20%.
То, что Т-лимфоцит распознает только чужеродные антигены, а не молекулы собственного организма, является следствием процесса, называемого селекцией, которая происходит в тимусе, где завершают свое развитие Т-клетки. Суть селекции такова: клетки, окружающие юный, или наивный, лимфоцит, показывают (презентируют) ему пептиды собственных белков. Тот лимфоцит, который слишком хорошо или слишком плохо узнает эти белковые фрагменты, уничтожается. Выжившие же клетки (а это менее 1% всех предшественников Т-лимфоцитов, пришедших в тимус) обладают промежуточным сродством к антигену, следовательно, они, как правило, не считают собственные клетки мишенями для атаки, но имеют возможность среагировать на подходящий чужеродный пептид.
Для активации Т-лимфоцита нужно, чтобы он получил специальные сигналы от рецепторов лейкоцитарной антигенной системы и коктейля из множества провоспалительных цитокинов.
С помощью специальных реагентов определяются маркеры поверхностных белков лейкоцитов определенного типа, которые называются кластерами дифференциации (Сluster of differentiation) – CD. В настоящее время известно 350 CD-антигенов и их подтипов (табл. 1).
Таблица 1. Главные идентификациионные СD-маркёры клеток
| Обозначение кластера | Клетки |
| CD 10, CD34 | Лимфоидная стволовая клетка |
| CD3 | Т-лимфоцит |
| CD4 | Т-хелпер |
| CD8 | Т-киллер |
| CD19, CD72, CD79 и др. | В-лимфоцит |
| CD16/ CD56 | NK-клетки |
| CD14, CD64 | Моноцит/макрофаг |
Т-лимфоциты распознают клетки, несущие чужеродные антигены, и уничтожают их после непосредственного контакта (атаки), а также выполняют функцию регуляции иммунного ответа.
Т-лимфоциты имеют подтипы (рис. 18):
Рис. 18. Подтипы Т-лимфоцитов и их функции
- Т-киллеры (их еще называют CD8+ Т-лимфоциты), которые подобно NK-клетке (натуральному киллеру), выделяет белки перфорин и гранзим, что приводит к лизису клетки-мишени;
- Т-хелперы (от английского helper – помощник). Они еще обозначаются как Th-клетки, CD4+ T-лимфоциты. Активированные Т-хелперы продуцируют хемокины и цитокины, участвующие в иммунном процессе (рис.19);
Рис. 19. Активация цитокинами разных субпопуляций Т-хелперов
- Т-супрессоры (Ts) подавляют (супрессируют) реакции В-лимфоцитов и блокируют Т-хелперы. Притом эти клетки вовсе не устраивают саботаж иммунным процессам и не вредят здоровью. Они просто регулируют силу иммунного ответа, что позволяет иммунной системе сдержанно и с умеренной силой отвечать на раздражители (тушить пожар, а не костер);
- Т-регуляторные клетки (Tr1) влияют на образование зернистых лейкоцитов (гранулоцитов), которых мы уже представляли в качестве макрофагов.
Соотношение количества клеток CD4/CD8 называют иммунорегуляторным индексом (ИРИ). Если у пациента ИРИ повышен (более 2,2), то это говорит о чрезмерной активности T-хелперов и ослаблении регулирующей функции T-киллеров. При таком показателе иммунные клетки могут разрушать собственные ткани организма. Повышенный ИРИ чаще всего отмечается у пациентов с аутоиммунными болезнями (системной красной волчанкой, склеродермией, ревматоидным артритом и др.). Причиной чрезмерной активности T-хелперов может также стать опухоль вилочковой железы. При этой патологии продуцируется избыточное количество лимфоцитов. Высокие показатели ИРИ отмечаются при остром лимфобластном лейкозе. Это тяжелое онкологическое заболевание сопровождается неконтролируемым увеличением количества незрелых лимфоцитов.
Если иммунорегуляторный индекс понижен (менее1,6), то это говорит о серьезном ухудшении работы иммунитета. Низкие показатели ИРИ свидетельствуют о том, что в организме ослаблена функция защитных клеток, а регуляция со стороны T-киллеров чрезмерна. Обычно это отмечается при следующих патологиях, сопровождающихся иммунодефицитом: инфекционных болезнях (в том числе ВИЧ-инфекции); врожденном иммунодефиците; любых затяжных и хронических болезнях; опухолях костного мозга.
В-лимфоциты ответственны за гуморальное звено иммунитета – продукцию антител. После антигенного стимула В-лимфоцит превращается в лимфобласт – клетку, способную к делению. Часть лимфобластов дифференцируется в В-лимфоциты памяти, другая часть превращается в плазматические клетки, которые осуществляют продукцию антител.
В-лимфоциты несут на своей поверхности В-клеточный рецептор. При контакте с антигеном эти клетки активируются и превращаются в особый клеточный подтип – плазматические клетки, живущие до трех недель и обладающие уникальной способностью секретировать в этот срок тысячи антител.
Антитело имеет сродство к распознаваемому им антигену, как бы «прилипает» к нему. Это дает возможность антителам обволакивать (опсонизировать) клетки и вирусные частицы, покрытые молекулами антигена, привлекая макрофаги и другие иммунные клетки для уничтожения патогена. Антитела также умеют активировать специальный каскад иммунологических реакций, называемый системой комплемента, который приводит к перфорации клеточной мембраны патогена и его гибели.
Рис. 20. Выработка антител и маркировка патогена
Различают несколько классов антител (иммуноглобулинов). Первыми после антигенного раздражения, вызывающих агглютинацию бактерий и нейтрализацию вирусов, появляются иммуноглобулины М (IgM). В длительном иммунитете участвуют иммуноглобулины G(IgG).
В табл.2 представлена интерпретация лабораторных исследований на наличие патогена на молекулярном уровне и с помощью тестов на иммуноглобулины М и G.
Таблица 2. Интерпретация лабораторных исследований на наличие патогена на молекулярном уровне
| Результат молекулярного исследования | Тест на антитела | Интерпретация | |
| IgM | IgG | ||
| Положительный | Отрицательный | Отрицательный | Острая инфекция |
| Положительный | Положительный | Отрицательный | Острая инфекция |
| Положительный | Положительный | Положительный | Инфицированный пациент |
| Положительный | Отрицательный | Положительный | Инфицированный или повторно инфицированный пациент |
| Отрицательный | Положительный | Отрицательный | Ранние стадии инфекции. Требуется дополнительное исследование |
| Отрицательный | Положительный | Положительный | Инфекция. Требуется дополнительное исследование |
| Отрицательный | Отрицательный | Положительный | Постинфекционный период |
| Отрицательный | Отрицательный | Отрицательный | Неинфицированный пациент |
Врожденный и приобретенный виды иммунитета имеют точки соприкосновения, которые представляют две триады (рис.21)
Рис. 21. Две триады, объединяющие врожденный и приобретенный виды иммунитета
Развитие адаптивного иммунного ответа требует достаточно много времени (от нескольких дней до двух недель), и для того чтобы организм мог защищаться от уже знакомой инфекции быстрее, из Т- и В-клеток, участвовавших в прошлых битвах, формируются так называемые клетки памяти. Они, подобно ветеранам, в небольшом количестве присутствуют в организме, и, если появляется знакомый им патоген, вновь активируются, быстро делятся и целой армией выходят на защиту границ (рис.22).
Рис.22. Т-клетки памяти быстро формирует вторичный иммунный ответ
Иммунологическая толерантность
Под иммунологической толерантностью (терпимостью, ареактивностью) понимают отсутствие иммунного ответа на специфический антиген. Перечень антигенов, к которым может развиваться толерантность, практически неотличим от набора антигенов, против которых развивается специфический иммунный ответ (рис.23).
Рис. 23. Иммунная толерантность
Механизмы толерантности необходимы, поскольку иммунная система продуцирует огромное число разнообразных антиген специфичных рецепторов, и некоторые из них оказываются специфичными к собственным антигенам организма; толерантность предотвращает нежелательные реакции против собственных органов и тканей, также для нормального протекания беременности.
Нарушения иммунной системы у человека
Нарушения в работе иммунной системы можно подразделить на три категории: иммунодефициты, аутоиммунные заболевания и реакции гиперчувствительности.
Иммунодефициты
Иммунодефицит – снижение количественных показателей и/или функциональной активности основных компонентов иммунной системы, приводящее к нарушению защиты организма от патогенных микроорганизмов и проявляющееся повышенной инфекционной заболеваемостью.
Первичные иммунодефициты (ПИД) – наследственные заболевания, обусловленные дефектами генов, контролирующих иммунный ответ. В основном ПИД заявляют о себе уже в раннем детском возрасте, но иногда лишь к 30-40 годам жизни.
- симптомов, которые могут быть признаками первичных иммунодефицитов:
- 4 и более случаев отита в течение года;
- 2 и более синусита в течение года;
- низкая эффективность антибиотиков в течение двух и более месяцев приема;
- 2 и более случаев пневмонии в течение года;
- невозможность ребенка набирать вес и нормально расти;
- частые и глубокие абсцессы кожи и внутренних органов
- постоянный кандидоз полости рта и кожи;
- необходимость внутривенного введения антибиотиков для разрешения инфекции;
- две и более системных инфекции, включая сепсис;
- наследственная предрасположенность.
По механизмам развития выделяют 4 основные группы ПИД (табл.3):
- 1-я группа – преимущественно гуморальные, или В-клеточные ПИД;
- 2-я группа – комбинированные ПИД (при всех Т-клеточных иммунодефицитах есть нарушение функции В-клеток);
- 3-я группа – ПИД, обусловленные дефектами фагоцитоза;
- 4-я группа – ПИД, обусловленные дефектами в системе комплемента.
Таблица 3. Некоторые первичные иммунодефициты
| Патология | Симптомы | Диагностика | Лечение |
| Дефекты антителообразования | |||
| Агаммаглобулинемия | Частые бактериальные инфекции | Дефицит или полное отсутствие В-лимфоцитов | Антибиотики, пожизненное введение IgG |
| Общая вариабельная иммунная недостаточность | Частые респираторные инфекции, отиты | Дефекты Т- и В- лимфоцитов | Антибиотики, пожизненное введение IgG |
| Комбинированные ПИД | |||
| Атаксия-телеангиоэкстазия (синдром Луи-Бар) | Аномалия двигательной функции, слабость мышц, нарушение речи | Дефицит Т- и В- лимфоцитов | Симптоматическое |
| ПИД, обусловленные дефектами фагоцитоза | |||
| Хроническая гранулёматозная болезнь | Частые пневмонии, гнойные инфекции | Генетический дефект | Пожизненная антибактериальная и противогрибковая терапия, интерферон гамма |
| ПИД, обусловленные дефектами в системе комплемента | |||
| Наследственный ангионевротический отек | Отеки губ и век при отсутствии зуда. Отеки гортани, носа, языка опасны для жизни | Низкая концентрация ингибитора эстеразы С1 | Введение концентрата ингибитора эстеразы С1 |
Как следует из табл.3, основным и часто единственным методом лечения большинства пациентов с первичными В-клеточными иммунодефицитами являются иммуноглобулины. Это лекарственные средства, получаемые из плазмы крови человека. Они призваны заменить защитные антитела, отсутствующие в иммунной системе, с целью предотвращения или остановки развития тяжелых инфекционных заболеваний. Сегодня в арсенале врача имеются иммуноглобулины, различающиеся по концентрации активного вещества (5 и 10%), а также по способу введения (внутривенный и подкожный).
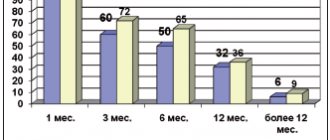
ПИД может проявиться в любом возрасте. В зависимости от этого у пациента возникают своеобразные проблемы, требующие определенных видов поддержки на протяжении всей жизни (табл. 4).
Таблица 4. Необходимость в видах поддержки пациента с ПИД в различных возрастных группах
| Возраст, лет | Виды поддержки | |||
| семьи | врача | психолога | общества | |
| 0-14 | +++ | + | + | +++ |
| 14-18 | +++ | + | +++ | +++ |
| 18-65 | + | ++ | + | +++ |
| Старше 65 | + | ++ | ++ | +++ |
В возрасте от 0 до 14 лет требуется уход со стороны родителей, направленный на профилактику инфекций и на период лечения. Могут потребоваться: обучение на дому; оказание психологической помощи; социальная поддержка в приобретении лекарственных средств.
В подростковом возрасте (14-18 лет) дополнительно могут возникнуть потребности в продолжении непрерывного обучения, профессиональной ориентации, налаживании взаимоотношений со сверстниками, организации досуга.
В возрасте от 18 до 65 лет у пациентов чаще возникают инфекционные осложнения, а с ними и расходы на приобретение лекарственных средств, не подлежащих восполнению, а также проблемы с трудоустройством.
В пожилом возрасте (старше 65 лет) возникают потребности в материальной, социальной и психологической поддержке пациента с ПИД.
Аутоиммунная патология
Повреждение собственных органов и тканей организма иммунной системой называется аутоиммунным процессом. Заболеваниями такого типа страдает около 5% человечества. В организме пациента развиваются боевые действия, напоминающие гражданскую войну: в атаку идут «свои против своих». В этой борьбе победителей нет – одни страдания.
Селекция Т-лимфоцитов в тимусе, а также удаление аутореактивных клеток на периферии (центральная и периферическая иммунологическая толерантность), о которых мы говорили ранее, не могут полностью избавить организм от аутореактивных Т-лимфоцитов. Что же касается В-лимфоцитов, вопрос о том, насколько строго осуществляется их селекция, до сих пор остается открытым. Поэтому в организме каждого человека обязательно присутствует множество аутореактивных лимфоцитов, которые в случае развития аутоиммунной реакции могут повреждать собственные органы и ткани.
В качестве аналога можно привести созданную турками в ХIV веке янычарскую пехоту, в которую набирали юношей-христиан 8-16 лет, воевших против своих сородичей.
Т-клеточная аутоиммуннная агрессия хорошо изучена при ревматоидном артрите, сахарном диабете первого типа, рассеянном склерозе и многих других болезнях.
Такие же клетки-янычары, не помнящие своего родства, прослеживаются среди В-лимфоцитов:
- аутоантитела могут вызывать гибель клеток, активируя на их поверхности систему комплемента или же привлекая макрофаги;
- мишенями для антител могут стать рецепторы на поверхности клетки.
Например, вследствие срыва иммунологической толерантности происходит активация В-лимфоцитов, продуцирующих антитела. Это приводит к выраженному повышению выработки тиреоидных гормонов (Т4 и Т3), а также к увеличению щитовидной железы в размерах (гипертрофии). Патология носит название болезнь Грейвса.
Еще одним примером может быть миастения гравис, которая характеризуется слабостью скелетной мускулатуры вследствие образования аутоантител против структур, отвечающих за холинергическую передачу и сокращение мышечного волокна;
- аутоантитела вместе с растворимыми антигенами могут образовывать иммунные комплексы, которые оседают в различных органах и тканях (например, в почечных клубочках, суставах, на эндотелии сосудов), нарушая их работу и вызывая воспалительные процессы.
Как правило, аутоиммунное заболевание возникает внезапно, и невозможно точно определить, что стало его причиной. Считается, что триггером для запуска может послужить практически любая стрессовая ситуация, будь то перенесенная инфекция, травма или переохлаждение. Значительный вклад в вероятность возникновения аутоиммунного заболевания вносит как образ жизни человека, так и генетическая предрасположенность – наличие определенного варианта какого-либо гена.
Гиперчувствительность
Под гиперчувствительностью понимают чрезмерный иммунный ответ на какой-либо антиген. Реакции гиперчувствительности подразделяют на несколько типов в зависимости от их длительности и механизмов, лежащих в их основе:
- гиперчувствительность I типа включает немедленные анафилактические реакции, часто связанные с аллергией. Реакции этого типа могут как вызывать небольшой дискомфорт, так и приводить к смерти. Основу гиперчувствительности I типа составляют иммуноглобулины E (IgE), которые вызывают дегрануляцию базофилов и тучных клеток;
- гиперчувствительность II типа характеризуется присутствием антител, распознающих его собственные белки и помечающие экспрессирующие их клетки к разрушению. Гиперчувствительность II типа также называют зависимой от антител или цитотоксической гиперчувствительностью, её основу составляют иммуноглобулины G (IgG) и (IgM);
- гиперчувствительность III типа обусловлена иммунными комплексами, состоящими из антигенов, белков комплемента, IgG и IgM;
- гиперчувствительность IV типа, также известная как отложенная гиперчувствительность, развивается в течение 2-3 дней. Реакции гиперчувствительности IV типа наблюдаются при многих аутоиммунных и инфекционных заболеваниях, а их основу составляют T-клетки, моноциты и макрофаги.
Эффективные методы воздействия на иммунитет:
- регулярная вакцинация по скорости и качеству реакции превышает естественный процесс формирования иммунитета на конкретную инфекцию;
- сбалансированное питание, обеспечивающее поддержание нормального обмена веществ;
- регулярные физические нагрузки, обеспечивающие физиологическое функционирование всех систем организма, поддержание оптимальных показателей массы тела;
- отказ от вредных привычек, приводящих к зависимостям (алкогольной, никотиновой, наркотической, токсической, компьютерной);
- режим дня, особенно влияние циркадных ритмов (смена дня и ночи): во время бодрствования пика достигает численность T-киллеров и NK-клеток, а также концентрация противовоспалительных веществ, таких как кортизол и катехоламины; во время сна достигает своего пика формирование Т-клеток памяти.
Спекулятивные методы вокруг иммунитета:
- прием иммуностимуляторов клинически не оправдан. Если постоянно стимулировать выработку лейкоцитов лекарственными средствами, иммунная система начнет утрачивать свои непосредственные функции. Вот тогда и наступает момент начала серьезных проблем с иммунитетом. Совершенно не влияют на иммунную систему природные адаптогены: лимонник китайский, женьшень, элеутерококк, радиола розовая. Они воздействуют, как усилители синтеза РНК и белков (основу человеческих клеток), активизируют ферменты обмена и работу эндокринной и вегетативной систем;
- прием витаминов явно переоценен. Положительное влияние на иммунную систему оказывает витамин D, который стимулирует образование Т-киллеров. Все остальные группы витаминов прямого участия в функционировании иммунной системы не принимают;
- банные процедуры и сауна на иммунную систему не влияют;
- народные средства, такие как мед и чеснок обладают легким бактерицидным, но не иммуногенным действием.
Заключение
Иммунная система представлена тремя уровнями: органным, клеточным и молекулярным со сложнейшими взаимодействиями между ними.
Современная иммунология различает два взаимодействующих компонента иммунной системы – врожденный и приобретенный (адаптивный) виды иммунитета, обеспечивающие развитие иммунного ответа на генетически чужеродные субстанции, которые представляют собой микроорганизмы, злокачественные опухолевые клетки, пересаженные органы и ткани.
Адаптивный иммунитет основывается на трех главных процессах: распознавание антигенов, их удаление (элиминация) и формирование иммунологической памяти.
Поломки в структуре иммунной системы приводят к развитию иммунодефицитов, аутоиммунным заболеваниям или реакции гиперчувствительности.
Иммунодефицит на генетическом уровне (первичный) или приобретенный (вторичный) может проявиться в любом возрасте и привести к повышенной инфекционной заболеваемости. В последние годы появились средства заместительной терапии, которые продлевают жизнь этим пациентам. Для повышения качества их жизни требуется не только обеспечение дорогостоящим лечением, но и организация поддержки со стороны семьи, психологов и социальных институтов.
Аутоиммунные заболевания и гиперчувствительность – это неспособность организма противостоять разбушевавшейся иммунной системе, которая перепутала свое и чужое.
К сожалению, ни одно из заболеваний иммунной системы медицина еще не научилась излечивать, а только применять заместительную терапию.
Эффективными профилактическими методами воздействия на иммунную систему являются вакцинация и здоровый образ жизни. Купить иммунитет в аптеке пока никому не удалось.
Где рождаются лимфоциты
Доказано, что у этих клеток есть 2 основных места рождения: лимфатические узлы и вилочковая железа.
Группы лимфоузлов разбросаны по всему телу, но они поставляют всего от 10 до 15% общего количества лимфоцитов крови. Их называют В-лимфоцитами. Эти клетки, встретив однажды чужеродный микроорганизм, запоминают его и организуют уничтожение. Свойство передается «по наследству» следующим поколениям. Таким образом формируется искусственный иммунитет на прививки, при этом чужеродным антигеном являются ослабленные возбудители разных заболеваний.
Вилочковая железа (тимус) — расположена за верхним краем грудины
У новорожденного тимус весит всего 15 г, растет к 15 годам до 27-30 г, далее начинает постепенно атрофироваться. Поэтому количество лимфоцитов в крови у ребенка сразу после рождения составляет максимальный уровень, затем снижается.
Важная роль тимуса в иммунитете заключается в продуцировании до 80% от всех лимфоцитов крови. Этот вид называется Т-лимфоцитами. Именно они осуществляют «организационную» работу в системе иммунитета, подготавливают атаку на чужеродные микроорганизмы.
Роль лейкоцитов в восстановлении и делении клеток
Учеными был проведен интересный эксперимент. Лимфоциты животного, в организме которого шел такой активный процесс, как регенерация печени, ввели здоровому животному. И у него начали активно делиться клетки нормальной, неповрежденной печени.
Опыт повторяли снова и снова и получали все тот же поразительный эффект. Ученые предположили, что участие лимфоцитов в процессах клеточного деления обусловлено, не только их обязанностью нести иммунный надзор, но что им присуща также строительная, морфогенетическая функция.
О том, что лейкоциты (и в их числе лимфоциты) оказывают влияние на деление клеток, было известно и раньше. В эксперименте на рану наносили сыворотку, в которой культивировали лейкоциты, и заживление раны шло гораздо быстрее.
Объясняли это так называемой трофической функцией лейкоцитов, считая, что они обогащают сыворотку питательными веществами. Полагали, что, кроме этих веществ, клетки ткани используют для регенерации «обломки» погибающих лейкоцитов.
Сегодня можно с уверенностью сказать, что дело не только в питательных веществах (этот фактор нельзя отрицать полностью), но главным образом в специфическом биологически активном субстрате, способствующем размножению клеток. Какое вещество (а может быть, вещества?) входит в состав этого субстрата, неясно, выделить его пока не удается. Но достоверно установлено, что продуцирует его и переносит «регенерационный стимул» опять жене лимфоцит.
Самое удивительное то, что лимфоциты переносят не просто стимул к делению как таковому. Эта «любопытная» клетка всегда хорошо осведомлена, в каком органе идет регенерация. Лимфоциты животного с регенерирующей печенью вызывают у здоровых животных усиленное деление главным образом печеночных клеток; лимфоциты животного с восстанавливающейся почкой — деление клеток почки реципиента.
Сигнал к размножению клеток лимфоцит переносит и в тех случаях, когда в организме донора происходит усиленное клеточное деление, не связанное с повреждениями какого-либо органа.
Например, гипоксия (недостаток кислорода), как известно, приводит к усиленному образованию эритроцитов — носителей дыхательного пигмента гемоглобина. Так вот, если взять лимфоциты у животного, находящегося в состоянии гипоксии, и ввести их животному, которое не испытывает кислородного голодания, то через некоторое время можно наблюдать у него стимуляцию продукции эритроцитов.
Какие же структуры лимфоцита играют роль запоминающего и воспроизводящего устройства? Пожалуй, это одна из самых интересных и сложных загадок, которые когда-либо загадывал лимфоцит исследователям. Разгадать же ее просто необходимо, ибо есть основания полагать, что это откроет путь к лечению многих болезней.
Как часто в клинической практике врачи сталкиваются с необходимостью повлиять на регенерационные процессы. И лимфоциты могли бы здесь оказать неоценимую помощь. Ведь они обладают высокой мобильностью, имеют широкий доступ практически ко всем тканям и органам и способны передавать свои «навыки» организму, в котором надо стимулировать регенерацию определенной ткани.
Возможно, лимфоциты помогут в какой-то мере решить сложнейшую проблему лечения наследственных заболеваний.
Изучая наследственную патологию — остеопетроз у мышей и крыс, выражающуюся в ненормальном формировании костей и преждевременном их уплотнении, специалисты обнаружили следующий факт. Введение больным мышам и крысам лимфоцитов от их здоровых «братьев и сестер» приводило к нормализации процесса формирования кости.
Правда, при условии подавления активности собственных лимфоцитов больных животных. Разве не поразительно, что наследственный порок развития, каковым является остеопетроз, удалось, пусть в эксперименте, исправить с помощью обыкновенных лимфоцитов!
Функции NK-клеток:
Третья разновидность лимфоцитов (натуральные киллеры, NK-клетки) существует затем, чтобы помогать первой. В принципе, по своим функциям они дублируют Т-лимфоциты. Натуральные киллеры обладают способностью уничтожать те поврежденные клетки, которые недоступны действию Т-лимфоцитов.
Лимфоциты у детей в достаточной степени «неопытны»: у детского иммунитета память развита не очень хорошо, ведь он еще не успел встретиться с большим числом болезней. Именно поэтому малыши менее устойчивы к разного рода напастям, чем взрослые. Впрочем, даже взрослый и зрелый возраст не обеспечивает нам неуязвимости к бактериям, вирусам и т.д.
Есть средство, которое позволяет «освежить» и укрепить память иммунной системы. Это препарат Трансфер Фактор
. Он имеет биологическое происхождение и содержит информационные молекулы, несущие в себе сведения о том, как иммунной системе нужно правильно работать и как ей реагировать на те или иные раздражители. Особенно значительное влияние препарата отмечается в отношении NK-клеток, активность которых под действием терапии Трансфер Фактором повышается на 283%.
Препарат подходит для пациентов разных возрастов, может применяться в лечебных и профилактических целях. Это одно из самых сильных средств, позволяющих улучшить функции лимфоцитов, поэтому он показан всем людям, которые имеют проблемы с иммунитетом или хотят их избежать.
Можно ли нормализовать количество лимфоцитов
Физиологические изменения состава крови приходят к норме после ликвидации инфекционного очага, признаков воспаления, отмены лекарственных препаратов, снятия интоксикации при отравлениях.
Корень женьшеня в натуральном виде
В период восстановления после перенесенного инфекционного заболевания для поддержки иммунитета можно принимать такие растительные средства, как настойки женьшеня, элеутерококка, алоэ, заманихи. Это слабые иммуномодулирующие средства. Витамино-минеральные комплексы, диета, богатая белками, помогают нормализовать кроветворение.
Если лимфопения или лимфоцитоз связаны с хроническими заболеваниями, то потребуется длительное лечение, возможно переливание крови. Не рекомендуется самостоятельно выбирать лекарства, воздействующие на иммунитет.
Эффект цитостатической и лучевой терапии при злокачественных новообразованиях основан на разрушении атипических клеток. Но, к сожалению, одновременно исчезают и клетки крови. Современные схемы лечения предусматривают минимальное влияние на кроветворение. Контролировать назначение лекарств может только врач-специалист.
Когда лимфоциты снижены
Патогенез снижения количества этих клеток (лимфопении) может происходить двумя путями:
- Клетки уничтожены в борьбе с инфекционным возбудителем, а новые еще не образовались. Подобная ситуация возникает в разгар вирусных заболеваний, когда больной не получает лечения, организм не имеет поддержки «со стороны» и вынужден справляться своими силами.
- Поражены органы, отвечающие за «воспроизводство» клеток. Здесь причины поражения могут быть различными и зависят от конкретного заболевания.
Лимфопения характерна для:
- развития малокровия (анемии);
- онкологических заболеваний (лейкозов, лимфогранулематоза, лимфосаркомы);
- последствий лучевой терапии;
- болезни Иценко-Кушинга (нарушение продукции гипофизарных и надпочечниковых гормонов);
- как результат длительного лечения кортикостероидными гормонами;
- при врожденных аномалиях развития лимфатической системы;
- почечной недостаточности;
- системной красной волчанки;
- СПИДа.