Показания к исследованию
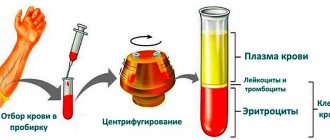
Моча – биологическая жидкость, которая вырабатывается почками. В большей степени она состоит из воды. Также в ней содержатся продукты распада аминокислот, образующиеся при обмене веществ, соли, гормоны, токсины.
Общий анализ мочи позволяет выявлять нарушения работы не только мочевыделительной системы, но также сердечно-сосудистой, эндокринной, пищеварительной и иммунной систем.
Изучая состав урины, можно многое сказать о здоровье пациента. Поэтому общий анализ мочи желательно в профилактических целях сдавать хотя бы раз в год. Это поможет выявить заболевания на ранних стадиях.
Также ОАМ проводится при общем медицинском осмотре, любом комплексном диагностическом обследовании, диспансеризации, госпитализации, для наблюдения за динамикой развития патологии, для оценки прогресса лечения сахарного диабета, патологий почек, мочевого пузыря и других заболеваний.
Анализ мочи рекомендуется сдать через 1-2 недели после успешного завершения лечения стрептококковых инфекций (скарлатины, ангины). Исследование обязательно назначается беременным женщинам
Следует непременно сдать ОАМ при наличии таких симптомов, как:
- общее недомогание, апатия;
- изменение цвета мочи;
- учащение мочеиспусканий;
- редкие позывы к мочеиспусканию;
- боли в области живота, поясницы;
- уменьшение количества урины при мочеиспусканиях;
- частая жажда;
- неприятные ощущения при мочеиспускании;
- помутнение мочи;
- отеки.
Успешное разрешение инфекционного процесса определяется не только эрадикацией возбудителя, но и состоянием иммунитета хозяина. Нередко тяжелые осложнения и даже летальный исход связаны с неадекватной реакцией организма на инфекцию [1]. В норме ответ организма на возбудитель имеет бимодальный характер [2]. На ранней стадии инфекции локальная генерация воспалительных цитокинов фактора некроза опухоли-а (ФНО-а), интерлейкина-1 в (ИЛ-10), ИЛ-8, ИЛ-12, интерферона у и вероятно ИЛ-6 запускается бактериальными продуктами [3]. Такими факторами являются эндотоксины (липополисахариды ЛПС) грамотрицательных бактерий и липотейхоевая кислота грамположительных микроорганизмов. Цитокины имеют короткий период жизни, и магнитуда цитокиновой секреции зависит от вида патогена. Тем не менее, первая волна цитокинов ограничена во времени (24-48 часов), что, по видимому, определяется их достаточно высокой токсичностью по отношению в клеткам хозяина. Некоторые авторы считают важным персистенцию повышенного уровня провоспалительных цитокинов, а не их абсолютные значения [4]. Следовательно, нормализация параметров гуморального иммунитета является частью гомеостатического ответа на инфекцию [4].
Терминацию первой волны продукции провоспалительных медиаторов осуществляют противовоспалительные цитокины (прямая инактивация или ингибиция их синтезов). В основном, это антагонист рецептора ИЛ-1 (ИЛ-ma), ИЛ-10, ИЛ-4, ИЛ-11 и ИЛ-13 [5, 6]. Баланс между прои антивоспалительными медиаторами определяет тяжесть и исход инфекции. Наряду с существующими маркерами протеином С и прокальцитонином уровень провоспалительных цитокинов предлагается использовать для выделения группы пациентов с неблагоприятным прогнозом антибактериального лечения.
Дополнительную сложность прогнозу антибактериального лечения придает возможность влияния на процесс факторов, связанных не только с хозяином и микроорганизмом, но и с самой антибактериальной терапией. Иммуномодулирующий эффект антибактериальных препаратов может влиять на фагоцитоз, хемотаксис, высвобождение эндотоксина и цитокинопродукцию. Хорошо известно, что препараты, разрушающие клеточную стенку ф-лактамы), провоцируют выделение содержимого клеток микроорганизмов в кровь, которые действуют как индукторы воспаления [4, 7].
Влияние на уровень цитокинов оказывают и другие препараты: клиндамицин стимулирует выделение ФНО-а и ИЛ-6, линкомицин стимулирует продукцию ИЛ-4, тейкопланин ФНО-а, ИЛ-1а и ИЛ-6. Напротив, фторхинолоны, эритромицин, рокситромицин и ванкомицин подавляют продукцию ФНО-а [8].
Таким образом, антимикробные средства могут усиливать или тормозить цитокин-индуцированное повреждение органов, что необходимо учитывать особенно при тяжелых инфекциях.
Проблема лечения инфекционновоспалительных заболеваний почек и органов мужской половой системы представляется актуальной. Особую сложность представляет антибактериальная терапия в условиях почечной недостаточности, когда наряду со спектром антимикробной активности приходится учитывать и фармакокинетические особенности препаратов. Необходимо отметить, что хроническая почечная недостаточность расценивается как иммунокомпроментированное состояние, при котором имеется склонность к затяжному течению инфекционновоспалительных процессов с невысокой активностью [9, 10]. Представляется вполне очевидным, что действие антибактериальных препаратов на цитокинопродукцию при заболевании почек должно иметь свои особенности, однако данных по сравнительному изучению влияния антибактериальных средств на цитокинопродукцию иммунокомпетентными клетками в норме и при хронической почечной недостаточности в доступной литературе нами не обнаружено. Поэтому целью данной работы стал анализ влияния антибактериальных препаратов на фитогемаглютинин-стимулированную цитокинопродукцию мононуклеарной фракцией клеток периферической крови пациентов с хронической почечной недостаточностью.
МАТЕРИАЛЫ И МЕТОДЫ
В качестве основной группы были отобраны 8 пациентов, страдающих терминальной стадией хронической почечной недостаточности, получающих заместительную почечную терапию в отделении оперативной нефрологии и пересадки почки ФГУ «НИИ урологии Росмедтехнологий». Причиной почечной недостаточности послужили хронический гломерулонефрит и хронический обструктивный пиелонефрит. Контрольную группу составили 5 призывников, не имеющих соматических заболеваний, поступивших на обследование в городскую клиническую урологическую больницу № 47 Департамента здравоохранения г. Москвы по поводу энуреза и 2 женщины, находящиеся на лечении в этой же клинике, по поводу мочекаменной болезни, не осложненной воспалительными заболеваниями и почечной недостаточностью.
Иммунологические исследования проводились на кафедре молекулярной фармакологии и радиобиологии РГМУ им. Н.И. Пирогова. Для оценки влияния антимикробной терапии на продукцию цитокинов клетками мононуклеарной фракцией было отобрано 5 антибактериальных препаратов, являющиеся характерными представителями фармакологических групп фторхинолон II поколения ципрофлоксацин, цефалоспорин III поколения цефтриаксон, аминогликозид III поколения амикацин, карбапенем меропенем, гликопептид ванкомицин.
Выделение мононуклеарной фракции крови проводили по методу Boyum [11]. Все операции проводились в температурном режиме 0-4оС. Для инкубации клеток мононуклеарной фракции периферической крови с антибактериальными препаратами исследуемые препараты вносили в лунки 96-луночного стерильного плоскодонного планшета (COSTAR), кроме контроля так, чтобы их конечная концентрация в инкубационной среде составила от 3 до 50 мкг/мл в соответствии с Сmax препаратов. Суспензию клеток (~1 млн/лунку) помещали в планшет и культивировали в стерильных условиях при 37°С в условиях 5% СО2 в течение 72 часов с использованием ламинарбокса ЛБ-В (Россия). При культивировании клеток использовали стандартную среду RPMI-1640 с добавлением 20% термоинактивированной эмбриональной телячьей сыворотки, L-глутамина в концентрации 100 мкг/мл (НИИ ЭиМ им. Н.Ф. Гамалеи). Для стимуляции пролиферации в каждую лунку вносили фитогемагглютинин до конечной концентрации в инкубационной среде 1 мкг/мл. Конечный объем инкубационной среды составил 200 мкл. Количество и жизнеспособность клеток оценивали в камере Горяева в присутствии 0,1% раствора трипанового синего. По окончании инкубации для анализа уровня цитокинов иммуноферментным методом отбирали по 100 мкл инкубационной жидкости из каждой лунки. Все исследования проводились в триплетах. Иммуноферментный анализ проводили согласно инструкции, прилагаемой к наборам реагентов ФНО-а, ИЛ-10, ИЛ-4, ИЛ-1в («Вектор-БЕСТ», Россия). Регистрацию результатов проводили с помощью планшетного фотометра («Униплан» АИФР-01, Россия), измеряя оптическую плотность при длине волны 450 нм.
Статистическая достоверность результатов оценивалась с помощью непараметрических критериев Уилкоксона, Манна-Уитни, Крускала-Уоллиса.
РЕЗУЛЬТАТЫ
Основные продуценты ИЛ-1 макрофаги, Т и В клетки. У пациентов с нормальной скоростью клубочковой фильтрации амикацин и ванкомицин стимулируют секрецию ИЛ-1р, в то время как меропенем ингибирует продукцию этого интерлейкина (рисунок 1), что отчасти совпадает с литературными данными. У больных с терминальной стадией хронической почечной недостаточности функциональная активность мононуклеарной фракции клеток периферической крови (цитокинопродукция) значительно снижена S по сравнению с лицами, имеющими нормальную функцию почек. В этих условиях стимулирующее влияние на продукцию ИЛ-1р отмечено только у амикацина, остальные препараты не вызвали значимых изменений.
Основные продуценты ФНО-а макрофаги, Т и В клетки, нейтрофилы. В исследовании активность нейтрофилов не учитывается, поэтому уровень суммарного цитокина плазмы может отличаться от полученных результатов. Продукцию ФНО-а у пациентов с нормальной скоростью клубочковой фильтрации достоверно снижают меропенем, ванкомицин и ципрофлоксацин, что соответствует литературным данным. При хронической почечной недостаточности еще в большей степени, чем ИЛ-1, страдает продукция мононуклеарами ФНО-а. В этих условиях достоверного влияния исследуемых антибактериальных препаратов на продукцию цитокина выявлено не было (рисунок 2).
Рисунок 1. Влияние антибактериальных препаратов на продукцию ИЛ-1 р клетками мононуклеарной фракции периферической крови при нормальной функции почек и в условиях хронической почечной недостаточности.
Рисунок 2. Влияние антибактериальных препаратов на продукцию фактора некроза опухоли-а клетками мононуклеарной фракции периферической крови при нормальной функции почек и в условиях хронической почечной недостаточности.
Таким образом, стимулированная продукция провоспалительных цитокинов в мононуклеарах при ХПН снижена.
ИЛ-10 синтезируется и секретируется макрофагами, Т хелперами 2-го типа и В клетками. Противовоспалительный эффект ИЛ-10 заключается в блокаде продукции провоспалительных цитокинов Т хелперами 1-го типа.
У пациентов с нормальной функцией почек ванкомицин достоверно подавляет выработку ИЛ-10 мононуклеарами; в то время как ципрофлоксацин и амикацин стимулируют ее (р = 0,048 и 0,052 соответственно), что отчасти совпадает с литературными данными. При хронической почечной недостаточности продукцию этого интерлейкина стимулируют амикацин, меропенем и ципрофлоксацин (рисунок 3).
Основные продуценты ИЛ-4 тучные клетки и Т хелперы 2-го типа. ИЛ-4 стимулирует активность тучных клеток, эозинофилов и антителопродукцию В-клетками. Все исследуемые антибактериальные средства в разной степени склонны подавлять продукцию ИЛ-4. При нормальной скорости клубочковой фильтрации амикацин и цефтриаксон в меньшей степени уменьшают выработку этого интерлейкина по сравнению с меропенемом, ванкомицином и ципрофлоксацином. При хронической почечной недостаточности наименьшее влияние на продукцию ИЛ-4 оказывает ципрофлоксацин (рисунок 4).
Отношение уровня плазменного ИЛ-10 к уровню ФНО-а является индикатором воспалительного ответа и прогностическим признаком тяжести и исхода инфекционного процесса [6]. При нормальной функции почек антибактериальные препараты не влияют на соотношение продукции ИЛ-10/ФНО-а мононуклеарами периферической крови. При тяжелой почечной недостаточности выявлено достоверное повышение индикатора воспалительного ответа при использовании всех изучаемых препаратов цефтриаксона, амикацина, меропенема, ванкомицина, ципрофлоксацина (рисунок 5).
ОБСУЖДЕНИЕ
ИЛ-1 в и ФНО-а являются провоспалительными цитокинами. Под их влиянием усиливается активность воспалительного процесса, что проявляется усилением экссудации и мобилизации нейтрофилов в очаг воспаления. Высокие уровни этих цитокинов непосредственно после воздействия повреждающего фактора необходимы для формирования адекватного воспалительного ответа, однако в дальнейшем их продукция должна снижаться. В противном случае воспалительная реакция протекает излишне расторможенно, со склонностью к затяжному течению и аутоиммунному повреждению тканей. В реальной клинической практике необходимость назначения антибактериальных препаратов возникает в большинстве случаев при развернутой клинической картине инфекционно-воспалительного заболевания, то есть на этапе, когда процесс экссудации в самом разгаре, а уровни интерлейкина-1в и фактора некроза опухолиа закономерно высоки. Следовательно, предпочтительнее, чтобы назначаемый лечебный препарат снижал продукцию указанных интерлейкинов. При нормальной функции почек наиболее выраженное подавляющее влияние на выработки интерлейкина-1в и фактора некроза опухолиа обладает меропенем, что должно существенно дополнять его эффект при лечении тяжелых инфекционновоспалительных заболеваний с высокой активностью процесса. Изолированный депрессорный эффект в отношении продукции фактора некроза опухолиа также отмечен у ванкомицина и ципрофлоксацина.
Рисунок 3. Влияние антибактериальных препаратов на продукцию ИЛ-10 клетками мононуклеарной фракции периферической крови при нормальной функции почек и в условиях хронической почечной недостаточности.
Рисунок 4. Влияние антибактериальных препаратов на продукцию ИЛ-4 клетками мононуклеарной фракции периферической крови при нормальной функции почек и в условиях хронической почечной недостаточности.
Рисунок 5. Влияние антибактериальных препаратов на индикатор воспалительного ответа (ИЛ-10/ФНО-а) при нормальной функции почек и в условиях хронической почечной недостаточности на фоне антибактериальной терапии.
У больных, страдающих тяжелой почечной недостаточностью, ситуация диаметрально противоположная. Хроническая почечная недостаточность является очень значимым фактором, снижающим уровень провоспалительных цитокинов. В реальной клинической практике крайне редко встречаются пациенты с аутоиммунными заболеваниями, тем более с высокой активностью, возникшими на фоне предсуществующей тяжелой почечной недостаточности. Поэтому для формирования адекватного воспалительного ответа уровни провоспалительных цитокинов могут оказаться недостаточными. Отсюда следует, что подавлять их выработку в этой ситуации нежелательно. Исследуемые препараты не оказали достоверного подавляющего влияния на выработку провоспалительных цитокинов мононуклеарами периферической крови в условиях хронической почечной недостаточности, а у амикацина выявлен статистически подтвержденный стимулирующий эффект на продукцию интерлейкина-ф. Практическое значение этого эффекта невелико, так как в связи с нефротоксичностью применение амикацина на фоне дефицита фильтрации крайне нежелательно.
Интерлейкин-10 обладает противовоспалительной активностью и является антагонистом интерлейки на-1в и фактора некроза опухолиа. В условиях высокоактивного инфекционно-воспалительного процесса, когда назначается антибактериальная терапия, весьма желательна стимуляция выработки этого цитокина. Согласно результатам проведенного исследования, этот эффект в наибольшей степени присущ ципрофлоксацину и амикацину, причем независимо от функции почек. Стимулирующий эффект меропенема выражен слабее, статистически достоверные различия выявлены только при почечной недостаточности. Также отмечено депрессорное влияние ванкомицина на продукцию интерлейкина-10, но только при нормальной функции почек. Если обратить внимание на стимулирующее влияние ванкомицина в отношении продукции провоспалительных цитокинов, то складывается впечатление, что иммунологические эффекты ванкомицина в условиях нормальной функции почек неблагоприятны. Они усиливают процесс экссудации, способствут длительному течению воспаления с высокой активностью, создают предпосылки для аутоиммунной агрессии. Однако на фоне хронической почечной недостаточности в условиях интоксикации, иммунодефицита эти эффекты помогают сформировать нормальный воспалительный ответ.
Под влиянием ИЛ-4 происходит сдвиг иммунного ответа в сторону образования антител. В настоящее время литературных данных о корреляции между уровнем ИЛ-4 и характеристиками воспалительного процесса мы не нашли. Однако в условиях острого инфекционно-воспалительного заболевания выработка антител к микроорганизму-возбудителю в высоком титре процесс безусловно желательный. Как уже было отмечено выше, все исследуемые препараты вне зависимости от состояния почечной функции склонны подавлять выработку этого интерлейкина. При нормальной функции почек наименьшее влияние на выработку ИЛ-4 оказывает амикацин и цефтриаксон, при хронической почечной недостаточности ципрофлоксацин.
Изменения индикатора воспалительного ответа оказались достаточно неожиданными. При нормальной функции почек создается впечатление, что он вообще не зависит от иммунологических эффектов антибактериальных препаратов. В условиях почечной недостаточности, на наш взгляд, этот показатель практически лишен смысла, так как он подразумевает высокий уровень провоспалительных цитокинов на ранних стадиях воспалительного процесса, который в последующем при благоприятном течении заболевания должен сменяться ростом концентрации противовоспалительных цитокинов. При почечной недостаточности стимулированные эндотоксином уровни провоспалительных цитокинов низки, что делает бессмысленным весь дальнейший расчет.
ЗАКЛЮЧЕНИЕ
Таким образом, у больных с тяжелой почечной недостаточности функциональная активность мононуклеарной фракции клеток периферической крови снижена по сравнению с лицами, имеющими нормальную функцию почек.
Влияние на выработку цитокинов ванкомицина при нормальной функции почек неблагоприятно (стимуляция провоспалительных и подавление противовоспалительных цитонинов), однако при хронической почечной недостаточности эти же самые эффекты позитивны. Цефтриаксон в наименьшей степени влияет на выработку цитокинов. Влияние ципрофлоксацина на выработку цитокинов в целом позитивно не зависимо от состояния почечной функции. Это заключается в подавлении секреции ФНО при нормальной функции почек, стимуляции противовоспалительных цитокинов вне зависимости от скорости клубочковой фильтрации, незначительном подавлении интерлейкина-4, особенно при почечной недостаточности.
Иммунологические эффекты амикацина неоднозначны. Он стимулирует выработку как провоспалительных, так и противовоспалительных цитокинов, этот эффект сохраняется и в условиях почечной недостаточности. Амикацин достаточно слабо подавляет выработку ИЛ-4. Иммунологические эффекты меропенема при нормальной функции почек позитивны. Он подавляет выработку провоспалительных цитокинов, не влияя на выработку противовоспалительных. При хронической почечной недостаточности иммунологические эффекты меропенема выражены в существенно меньшей степени и имеют слабо негативную окраску. Он обладает стимулирующим влиянием на противовоспалительный ИЛ-10, что при изначально низких провоспалительных цитокинах нежелательно.
Ключевые слова: хроническая почечная недостаточность, антибиотики, цитокины. Keywords: chronic renal failure, antibiotics, cytokines.
ЛИТЕРАТУРА
- Bergeron, Y., N. Ouellet, A.M. Deslauriers, M.Simard, M. Olivier and M.G. Bergeron. 1998. Cytokine kinetics and other host factors in response to pneumococcal pulmonary infection in mice. Infect. Immun. 66:912-922.
- Mira J.-P., Max A., Burgel P.-R. The role of biomarkers in community-acquired pneumonia:predicting mortality and response to adjunctive therapy //Critical Care 2008, 12 (Suppl 6):S5 (doi:10.1186/cc7028).
- Pinsky, M.R. 2001. Sepsis: a proand anti-inflammatory disequilibrium syndrome. Contrib. Nephrol. 132:354-366.
- Gogos C.A., A. Skoutelis, A. Lekkou, E. Drosou, I. Starakis, M. N. Marangos and H.P. Bassaris Comparative Effects of Ciprofloxacin and Ceftazidime on Cytokine Production in Patients with Severe Sepsis Caused by Gram-Negative Bacteria \\ Antimicrobial Agents and Chemotherapy, August 2004, p. 2793-2798, Vol. 48, №. 8.
- Opal S.M., V.A. DePalo. 2000. Anti-inflammatory cytokines. Chest 117: 1162-1172.
- Riedemann N.C., R.F. Guo and P. A. Ward. 2003. The enigma of sepsis. J. Clin. Investig. 112: 460-467.
- Spreer A., H. Kerstan, T. Bottcher, J. Gerber, A. Siemer, G. Zysk, T.J. Mitchell, H. Eiffert and R. Nau. 2003. Reduced release of pneumolysin by Streptococcus pneumoniae in vitro and in vivo after treatment with nonbacteriolytic antibiotics in comparison to ceftriaxone. Antimicrob. Agents Chemother. 47: 2649-2654.
- Calbo E., Alsina M., Rodriguez-Carballeira M., Lite J., Garau J. Systemic Expression of Cytokine Production in Patients with Severe Pneumococcal Pneumonia: Effects of Treatment with a в-Lactam versus a Fluoroquinolone Antimicrob Agents Chemother. 2008 July; 52(7): 2395-2402.
- Урология. Под редакцией Н.А. Лопаткина Москва. ГЭОТАР-Медиа. 2002. 519 с.
- Нефрология. Под редакцией Е.М. Шилова Москва. ГЭОТАР-Медиа, 2007, 683 с.
- Boyum A. Separation of leukocytes from blood and bone marrow//Scand. J. Clin. Lab. Investig. 1968. Vol. 21. Suppl. 97. P. 19.
‹ Особенности индукции апоптоза в культуре лимфоцитов периферической крови больных с различными формами острого пиелонефрита Вверх Клиническая эффективность и безопасность препарата Тулозин (тамсулозин) у больных доброкачественной гиперплазией предстательной железы ›
Заболевания, которые можно выявить по результатам анализа
Наиболее часто с помощью ОАМ диагностируют следующие патологии:
- инфекции (уретрит, простатит, цистит и т.д);
- сахарный и несахарный диабет;
- цирроз печени, гепатиты, печеночную недостаточность;
- желчнокаменную болезнь;
- нарушение функции щитовидной железы;
- панкреатит;
- сепсис (заражение крови);
- паразитарные поражения;
- пиело- и гломерунефрит;
- опухолевые заболевания мочеполовой системы.
Важно! Диагноз не ставится на основании одного общего анализа мочи. Его результаты лишь позволяют заподозрить ту или иную патологию и направить пациента на дополнительные исследования: УЗИ, рентген, общий и биохимический анализ крови, биохимический анализ мочи и т.д.
Подготовка к исследованию
На цвет, состав и объем урины могут влиять продукты питания, напитки, некоторые лекарства. Поэтому за день до сбора мочи необходимо отказаться:
- От продуктов, способных изменить цвет мочи – свеклы, лаврового листа, шпината, моркови, копченой и маринованной пищи);
- От некоторых антибиотиков, слабительных, витаминов, релаксантов, способных воздействовать на цвет мочи – если вы принимаете какие-то лекарства, нужно заранее проконсультироваться с врачом по поводу того, влияют ли они на цвет мочи: если влияют, то можно ли их отменить и каким образом.
Справка! Если принимаемые пациентом лекарства нельзя отменить, то врач учтет этот фактор при расшифровке результатов анализа.
Также накануне исследования исключаются:
- Тепловое воздействие на организм (баня, горячие ванны);
- Сильные физические нагрузки;
- Кофе (способствует повышенному образованию мочи);
- Диуретики;
- Половые контакты.
Важно! Общий анализ мочи не сдают во время месячных, при повышенной температуре тела и высоком артериальном давлении. Если пациент проходил цистоскопию, ОАМ можно сдавать не ранее чем через несколько дней после этой процедуры.
Для сбора мочи понадобятся стерильные контейнеры разных размеров (большой и маленький). Их можно купить в аптеке или клинике.
Правила подготовки к сдаче анализа на метаболиты катехоламинов в моче
За несколько дней до сдачи анализа необходимо строго ограничить потребление продуктов: сыры, фрукты (авокадо, бананы), грецкие орехи, бобы, алкоголь, ограничить прием лекарственных препаратов.
Необходимо избегать любых ситуаций, которые могут вызвать повышение катехоламинов: быть в тепле, не перегреваться, пить достаточно воды, ни волноваться, ни подвергаться сильным физическим нагрузкам.
Сбор мочи для исследования:
Для данного исследования собирается суточная моча с добавлением консерванта (навеска лимонной кислоты).
1) В ходе утреннего мочеиспускания, мочевой пузырь полностью опорожнить, эту порцию вылить. Отметить точное время начала сбора мочи. Собирать последующую мочу в емкость (не менее трех литров), которая должна хранится в прохладном месте.
2) Добавить навеску лимонной кислоты к первой порции мочи.
3) После завершения сбора измерьте объем собранной мочи. Данные суточного объема необходимо предоставить в лабораторию, о
4) Тщательно перемешать всю собранную мочу. Около 50мл суточной мочи отобрать в стерильный контейнер и доставить в лабораторию.
За день до сдачи бакпосева, желательно исключить из рациона питания пересоленные, копченые, жирные продукты, алкоголь и лекарственные препараты. Не рекомендуется также употребление большого объема сладкой и кислой пищи, исключить прием антибактериальных препаратов. После приема антибактериальных препаратов рекомендуется сдавать анализ не ранее, чем через 7-10 дней.
Анализ сдать утром, после ночного сна.
Перед сбором мочи необходимо очистить область мочеполовой системы от биологических выделений, то есть подмыться, но при этом, не использовать антибактериальные средства для интимной гигиены.
Для бакпосева нужно сдавать среднюю порцию мочи, в количестве до пятидесяти миллилитров. То есть, первую часть спустить в туалет, среднюю порцию собрать в строго стерильный контейнер, а остаток снова в туалет.
Наполненную емкость желательно сразу сдать в лабораторию, при этом, не сильно взбалтывать и не допускать перепадов температуры. Если анализ мочи не удается сразу отправить на исследование, то можно поместить емкость с мочой в прохладное и темное место, но не больше чем на два часа.
1.За сутки до сдачи мочи необходимо скорректировать свой рацион: отказаться от употребления в пищу мяса, жидкостей ярко окрашенных (морковного, свекольного соков), алкоголя (в том числе пива), газированных напитков, сладостей, меда и кондитерских изделий.
- Исключить применение диуретиков и антибактериальных препаратов, а так же интенсивные физические нагрузки, так как они могут исказить результаты анализа.
- Перед сбором мочи надо произвести гигиенический туалет половых органов.
4.Женщинам не рекомендуется сдавать анализ мочи во время менструации.
- В контейнер для мочи собирается примерно 50 мл утренней мочи.
6.Для правильного проведения исследования при первом утреннем мочеиспускании небольшое количество мочи (первые 1-2 сек) выпустить в унитаз, а затем, не прерывая мочеиспускания собрать примерно 50 мл мочи.
7.Сразу после сбора мочи плотно закройте контейнер и в течение ближайшего времени доставьте в клинику.
Режим приема анализа на Социалистической 208: Пн — Пт: 07:00 — 17:00. Сб.: 07:00 — 12:00
Рекомендации по сбору мочи такие же как на общий анализ мочи, но в контейнер собирается строго средняя порция мочи.
Режим приема анализа на Социалистической 208: Пн — Пт: 07:00 — 17:00. Сб.: 07:00 — 12:00
Сбор мочи для анализа
Урину для анализа пациент собирает дома самостоятельно. Это необходимо делать утром, сразу после пробуждения, до завтрака и употребления любых напитков. Для анализа нужна моча, накопившаяся в мочевом пузыре за всю ночь. Поэтому до сбора урины мочиться нельзя.
Сбор мочи производится следующим образом:
- Нужно подмыться теплой водой с мылом, тщательно ополоснув кожу после его использования.
- Немного мочи выпустить в унитаз, чтобы избавиться от следов моющего средства.
- Всю остальную мочу собрать в большой стерильный контейнер.
- Отлить около 100-150 урины в стерильный контейнер меньшего размера, плотно закрыть крышкой.
- Доставить биоматериал в лабораторию в течение 2 часов – чем скорее, тем лучше.
Важно! До выхода из дома контейнер с мочой хранят в холодильнике.