Что такое осмотическое давление, и как оно влияет на человеческий организм
Осмос возникает в организме человека на границе двух различных растворов, разделенных между собой полупроницаемой мембраной. У одной жидкости есть возможность сквозь стенки проникать во вторую, которая уже подверглась воздействию первой.
На примере человеческого организма можно показать природу осмотического давления: вода проходит сквозь мембрану и попадает в кровь. Плазма содержит определенную концентрацию минеральных солей, глюкозы, белков. Показатель осмотического давления дает знать, достаточно ли обеспечен организм обменом водой между кровяным руслом и органами, которые находятся с внешней стороны сосудов. Осмотическое давление в организме человека — это величина силы, которая заставляет двигаться воду сквозь защитную оболочку эритроцитов.
Влияет на осмос в составе плазмы крови преимущественно соль, потому что белки, сахар и мочевина в ней содержатся в небольших количествах.
Оптимальная концентрация солевого раствора в кровяном русле должна быть 0,9 %. Такой показатель имеет название изотонический. Он равен величине осмоса крови. При величине, превышающей данный показатель, осмотическое давление становится гипертоническим. В случае, если данная цифра ниже, — гипотоническим. Для того чтобы организм человека функционировал в нормальном режиме, осмотическое давление должно быть в пределах оптимальных значений.
Понятно, что показатель осмоса не может быть постоянным, но если концентрация солей повышена или понижена на короткое время, то здоровая выделительная система без проблем удаляет лишнюю жидкость, солевые растворы и другие вещества. В этом случае организм сам заботится о присутствии внутри него правильного количества соли. Когда здоровье человека дает сбой, и осмотическое давление длительный период либо пониженное, либо повышенное, то это может стать причиной возникновения определенных болезней.
Среди наиболее вероятных последствий можно назвать гемолиз. Это такое состояние, при котором лопаются оболочки эритроцитов, и они растворяются в жидкости. Внешний вид крови, содержащей такие погибшие красные тельца, немного прозрачен. Если параметры силы осмоса далеки от оптимальных, то исчезнет упругость клеток, тканей и целых органов. И при повышенном осмотическом давлении, и при пониженном, у эритроцитов крови та же участь — разрушение.
Осмос и осмотическое давление
Если разделить раствор и растворитель при помощи полупроницаемой перегородки (мембраны), пропускающей свободно молекулы растворителя и задерживающей молекулы растворенного вещества, то наблюдается односторонняя диффузия растворителя.
Такого рода диффузия обусловливается тем, что число молекул растворителя в единице объема больше, чем в таком же объеме раствора, так как в растворе часть объема занимают молекулы растворенного вещества. В результате молекулярного движения перемещение молекул растворителя через мембрану из растворителя в раствор преобладает над перемещением их в обратном направлении.
Односторонняя диффузия растворителя к раствору называется осмосом, а сила, обусловливающая осмос, отнесенная к единице поверхности полупроницаемой мембраны, называется осмотическим давлением.
В результате осмоса и диффузии выравнивается концентрация, причем способы, которыми достигается это выравнивание, принципиально различны. В процессе диффузии равенство концентраций достигается перемещением молекул растворенного вещества, а в случае осмоса — перемещением молекул растворителя.
Механизм осмоса нельзя объяснить только тем, что полупроницаемые мембраны играют роль сита с ячейками, через которые свободно проходят молекулы растворителя, но не проходят молекулы растворенного вещества.
По-видимому, механизм осмоса значительно сложнее. Здесь большую роль играют строение и состав мембраны.
В зависимости от природы мембраны механизм осмоса будет различен. В одних случаях через мембрану свободно проходят только те вещества, которые в ней растворяются, в других случаях мембрана взаимодействует с растворителем, образуя промежуточные непрочные соединения, которые легко распадаются, и, наконец, она может представлять и пористую перегородку с определенными размерами пор.
Для измерения осмотического давления в сосуд с полупроницаемыми стенками наливают исследуемый раствор и плотно закрывают пробкой, в которую вставлена трубка, соединенная с манометром. Такой прибор для измерения осмотического давления называется осмометром.
Осмометр с раствором погружают в сосуд с растворителем. В начале процесса растворитель из наружного сосуда диффундирует в осмометр с большей скоростью, чем из него, поэтому уровень жидкости в трубке осмометра поднимается, что создает в ней гидростатическое давление, которое постепенно увеличивается. По мере увеличения гидростатического давления скорости диффузии растворителя в осмометр и из осмометра уравниваются, в результате чего наступает состояние динамического равновесия, подъем жидкости в трубке осмометра прекращается.
Гидростатическое давление, установившееся в результате осмоса, служит мерой осмотического давления.
Измерение осмотического давления при помощи осмометра не всегда возможно с достаточной точностью, так как не существует мембран, способных задерживать все частицы растворенного вещества. Измеряемое значение осмотического давления для одного и того же раствора будет, следовательно, в какой-то мере зависеть от природы мембраны.
Осмотическое давление возникает лишь на границе между раствором и растворителем (или раствором другой концентрации), если эта граница образована полупроницаемой перегородкой. Раствор, содержащийся в обыкновенном сосуде, не оказывает на его стенки никакого иного давления, кроме обычного гидростатического. Поэтому осмотическое давление надо рассматривать не как свойство растворенного вещества, или растворителя, или самого раствора, а как свойство системы из растворителя и раствора с полупроницаемой перегородкой между ними.
Зако́ны Ра́уля — общее название открытых французским химиком Ф. М. Раулем в 1887 г. количественных закономерностей, описывающих некоторые коллигативные (зависящие отконцентрации, но не от природы растворённого вещества) свойства растворов.
Первый закон Рауля [править]
Первый закон Рауля связывает давление насыщенного пара над раствором с его составом; он формулируется следующим образом:
· Парциальное давление насыщенного пара компонента раствора прямо пропорционально его мольной доле в растворе, причём коэффициент пропорциональности равен давлению насыщенного пара над чистым компонентом.
Для бинарного раствора, состоящего из компонентов А и В (компонент А считаем растворителем) удобнее использовать другую формулировку:
· Относительное понижение парциального давления пара растворителя над раствором не зависит от природы растворённого вещества и равно его мольной доле в растворе
.
На поверхности оказывается меньше способных испаряться молекул растворителя, ведь часть места занимает растворённое вещество.
Растворы, для которых выполняется закон Рауля, называются идеальными. Идеальными при любых концентрациях являются растворы, компоненты которых очень близки по физическим и химическим свойствам (оптические изомеры, гомологи и т. п.), и образование которых не сопровождается изменением объёма и выделением либо поглощением теплоты. В этом случае силы межмолекулярного взаимодействиямежду однородными и разнородными частицами примерно одинаковы, и образование раствора обусловлено лишь энтропийным фактором.
Отклонения от закона Рауля [править]
Растворы, компоненты которых существенно различаются по физическим и химическим свойствам, подчиняются закону Рауля лишь в области очень малых концентраций; при больших концентрациях наблюдаются отклонения от закона Рауля. Случай, когда истинные парциальные давления паров над смесью больше, чем вычисленные по закону Рауля, называют положительными отклонениями
. Противоположный случай, когда парциальные давления паров компонентов оказываются меньше вычисленных —
отрицательные отклонения
.
Причиной отклонений от закона Рауля является то обстоятельство, что однородные частицы взаимодействуют друг с другом иначе, чем разнородные (сильнее в случае положительных и слабее в случае отрицательных отклонений).
Реальные растворы с положительными отклонениями от закона Рауля образуются из чистых компонентов с поглощением теплоты (ΔНраств > 0); объём раствора оказывается больше, чем сумма исходных объёмов компонентов (ΔV > 0). Растворы с отрицательными отклонениями от закона Рауля образуются с выделением теплоты (ΔНраств < 0); объём раствора в этом случае будет меньше, чем сумма исходных объёмов компонентов (ΔV < 0).
Второй закон Рауля [править]
Тот факт, что давление паров над раствором отличается от давления паров над чистым растворителем, существенно влияет на процессы кристаллизации и кипения. Из первого закона Рауля выводятся два следствия, касающиеся понижения температуры замерзания и повышения температуры кипения растворов, которые в объединённом виде известны как второй закон Рауля
.
Понижение температуры кристаллизации растворов [править]
Условием кристаллизации является равенство давления насыщенного пара растворителя над раствором давлению пара над твёрдым растворителем. Поскольку давление пара растворителя над раствором всегда ниже, чем над чистым растворителем, это равенство всегда будет достигаться при температуре более низкой, чем температура замерзания растворителя. Так, океанская вода начинает замерзать при температуре около минус 2 °C.
Разность между температурой кристаллизации растворителя T°fr
и температурой начала кристаллизации раствора
Tfr
есть понижение температуры кристаллизации.
· Понижение температуры кристаллизации бесконечно разбавленных растворов не зависит от природы растворённого вещества и прямо пропорционально моляльной концентрациираствора.
Поскольку по мере кристаллизации растворителя из раствора концентрация последнего возрастает, растворы не имеют определённой температуры замерзания и кристаллизуются в некотором интервале температур.
Повышение температуры кипения растворов [править]
Жидкость кипит при той температуре, при которой общее давление насыщенного пара становится равным внешнему давлению. Если растворённое вещество нелетуче (то есть давлением его насыщенных паров над раствором можно пренебречь), то общее давление насыщенного пара над раствором равно парциальному давлению паров растворителя. В этом случае давление насыщенных паров над раствором при любой температуре будет меньше, чем над чистым растворителем, и равенство его внешнему давлению будет достигаться при более высокой температуре. Таким образом, температура кипения раствора нелетучего вещества Tb
всегда выше, чем температура кипения чистого растворителя при том же давлении
T°b
.
· Повышение температуры кипения бесконечно разбавленных растворов нелетучих веществ не зависит от природы растворённого вещества и прямо пропорционально моляльной концентрации раствора
Криоскопическая и эбулиоскопическая константы [править]
Коэффициенты пропорциональности К
и
Е
в приведённых выше уравнениях — соответственно криоскопическая и эбулиоскопическая постоянные растворителя, имеющие физический смысл понижения температуры кристаллизации и повышения температуры кипения раствора с концентрацией 1 моль/кг. Для воды они равны 1.86 и 0.52 K·моль−1·кг соответственно. Поскольку одномоляльный раствор не является бесконечно разбавленным, второй закон Рауля для него в общем случае не выполняется, и величины этих констант получаютэкстраполяцией зависимости из области малых концентраций до m = 1 моль/кг.
Для водных растворов в уравнениях второго закона Рауля моляльную концентрацию иногда заменяют молярной. В общем случае такая замена неправомерна, и для растворов,плотность которых отличается от 1 г/см³, может привести к существенным ошибкам.
Второй закон Рауля даёт возможность экспериментально определять молекулярные массы соединений, неспособных к диссоциации в данном растворителе; его можно использовать также для определения степени диссоциации электролитов.
Растворы электролитов [править]
Законы Рауля не выполняются для растворов (даже бесконечно разбавленных), которые проводят электрический ток — растворов электролитов. Для учёта этих отклонений Вант-Гоффвнёс в приведённые выше уравнения поправку — изотонический коэффициент i
, неявно учитывающий диссоциацию молекул растворённого вещества:
;
Неподчинение растворов электролитов законам Рауля и принципу Вант-Гоффа послужили отправной точкой для создания С. А. Аррениусом теории электролитической диссоциации.
Упругость Насыщения — упругость водяного пара, максимально возможная приданной температуре. Она тем больше, чем выше температура воздуха. По еедостижении начинается конденсация водяного пара.
Эбуллиоскопическая константа– разница между температурой кипения раствора и температурой чистого растворителя.
Криоскопическая константа– разница между температурой замерзания раствора и температурой чистого растворителя.
74. Явление осмоса, его роль в биологических системах. Осмотическое давление. Закон Вант-Гоффа.
Растворы изотонические, гипо- и гипертонические.
Явление осмоса наблюдается в тех средах, где подвижность растворителя больше подвижности растворённых веществ. Важным частным случаем осмоса является осмос через полупроницаемую мембрану. Полупроницаемыми называют мембраны, которые имеют достаточно высокую проницаемость не для всех, а лишь для некоторых веществ, в частности, для растворителя. (Подвижность растворённых веществ в мембране стремится к нулю). Как правило, это связано с размерами и подвижностью молекул, например, молекула воды меньше большинства молекул растворённых веществ. Если такая мембрана разделяет раствор и чистый растворитель, то концентрация растворителя в растворе оказывается менее высокой, поскольку там часть его молекул замещена на молекулы растворённого вещества (см. Рис. 1). Вследствие этого, переходы частиц растворителя из отдела, содержащего чистый растворитель, в раствор будут происходить чаще, чем в противоположном направлении. Соответственно, объём раствора будет увеличиваться (а концентрация вещества уменьшаться), тогда как объём растворителя будет соответственно уменьшаться.
Значение осмоса [править]
Осмос играет важную роль во многих биологических процессах. Мембрана, окружающая нормальную клетку крови, проницаема лишь для молекул воды, кислорода, некоторых из растворённых в крови питательных веществ и продуктов клеточной жизнедеятельности; для больших белковых молекул, находящихся в растворённом состоянии внутри клетки, она непроницаема. Поэтому белки, столь важные для биологических процессов, остаются внутри клетки.
Осмос участвует в переносе питательных веществ в стволах высоких деревьев, где капиллярный перенос не способен выполнить эту функцию.
Осмос широко используют в лабораторной технике: при определении молярных характеристик полимеров, концентрировании растворов, исследовании разнообразных биологических структур. Осмотические явления иногда используются в промышленности, например при получении некоторых полимерных материалов, очистке высоко-минерализованной воды методом обратного осмоса жидкостей.
Клетки растений используют осмос также для увеличения объёма вакуоли, чтобы она распирала стенки клетки (тургорное давление). Клетки растений делают это путём запасания сахарозы. Увеличивая или уменьшая концентрацию сахарозы в цитоплазме, клетки могут регулировать осмос. За счёт этого повышается упругость растения в целом. С изменениями тургорного давления связаны многие движения растений (например, движения усов гороха и других лазающих растений). Пресноводные простейшие также имеют вакуоль, но задача вакуолей простейших заключается лишь в откачивании лишней воды из цитоплазмы для поддержания постоянной концентрации растворённых в ней веществ.
Осмос также играет большую роль в экологии водоёмов. Если концентрация соли и других веществ в воде поднимется или упадёт, то обитатели этих вод погибнут из-за пагубного воздействия осмоса.
Осмотическое давление (обозначается π) — избыточное гидростатическое давление на раствор, отделённый от чистого растворителя полупроницаемой мембраной, при котором прекращается диффузия растворителя через мембрану. Это давление стремится уравнять концентрации обоих растворов вследствие встречной диффузии молекул растворённого вещества и растворителя.
ЗАКОН ВАНТ-ГОФФА описывает зависимость ОСМОТИЧЕСКОГО ДАВЛЕНИЯ разбавленных растворов от температуры и молярной концентрации раствора: Вант-Гофф пришел к заключению, что закон Авогадро справедлив и для разбавленных растворов. Он экспериментально установил, что осмотическое давление, представляющее собой меру стремления двух различных растворов по обе стороны мембраны к выравниванию концентрации, в слабых растворах зависит не только от концентрации, но и от температуры и, следовательно, подчиняется законам термодинамики газов. Вант-Гофф выразил осмотическое давление формулой РV = iRT, где Р означает осмотическое давление вещества, растворенного в жидкости; V – объем; R – газовую постоянную; Т – температуру и i – коэффициент, который для газов часто равен 1, а для растворов, содержащих соли, – больше единицы. Вант-Гофф смог объяснить, почему изменяется значение i, связав этот коэффициент с числом ионов, находящихся в растворе. Проведенные Вант-Гоффом исследования разбавленных растворов явились обоснованием теории электролитической диссоциации С.Аррениуса. Впоследствии Аррениус приехал в Амстердам и работал вместе с Вант-Гоффом.
Изотонический раствор (изоосмотический раствор) — раствор, осмотическое давление которого равно осмотическому давлению плазмы крови; например, 0,9 % водный раствор хлорида натрия, 5 % водный раствор глюкозы. Все эти растворы используются в терапии различных заболеваний с целью снятия интоксикации и других проявлений болезни. Изотонические расвторы, в отличие от гипертонических и гипертонических (не применяются для внутривенного введения) не приводят к гемолизу эритроцитов при внутривенном введении.
Гипотонические растворы отличаются от изотонического меньшей концентрацией и соответственно меньшим осмотическим давлением. При контакте с тканями вода из гипотонических растворов поступает в клетки тканей. Вследствие этого они набухают, а при чрезмерном накоплении в них воды наступает разрыв клеточных оболочек, т. е. лизис клеток.
Применение гипотонических растворов натрия хлорида в практике очень ограничено. В ряде случаев они используются для приготовления растворов веществ, применяемых для инфильтрационной анестезии. Действиеанестетиков в гипотонических растворах усиливается, так как последние способствуют более глубокому проникновению веществ в ткани.
Гипертонические растворы, растворы, осмотическое давление которых выше осмотического давления в растительных или животных клетках и тканях. В зависимости от функциональной, видовой и экологической специфики клеток осмотическое давление в них различно, и раствор, гипертоничный для одних клеток, может оказаться изотоничным или даже гипотоничным для др. При погружении растительных клеток в Г. р. он отсасывает воду из клеток, которые уменьшаются в объёме, а затем дальнейшее сжатие прекращается и протоплазма отстаёт от клеточных стенок (см. Плазмолиз). Эритроциты крови человека и животных в Г. р. также теряют воду и уменьшаются в объёме. Г. р. в сочетании с гипотоническими растворами иизотоническими растворами применяют для измерения осмотического давления в живых клетках и тканях.
Если разделить раствор и растворитель при помощи полупроницаемой перегородки (мембраны), пропускающей свободно молекулы растворителя и задерживающей молекулы растворенного вещества, то наблюдается односторонняя диффузия растворителя.
Такого рода диффузия обусловливается тем, что число молекул растворителя в единице объема больше, чем в таком же объеме раствора, так как в растворе часть объема занимают молекулы растворенного вещества. В результате молекулярного движения перемещение молекул растворителя через мембрану из растворителя в раствор преобладает над перемещением их в обратном направлении.
Односторонняя диффузия растворителя к раствору называется осмосом, а сила, обусловливающая осмос, отнесенная к единице поверхности полупроницаемой мембраны, называется осмотическим давлением.
В результате осмоса и диффузии выравнивается концентрация, причем способы, которыми достигается это выравнивание, принципиально различны. В процессе диффузии равенство концентраций достигается перемещением молекул растворенного вещества, а в случае осмоса — перемещением молекул растворителя.
Механизм осмоса нельзя объяснить только тем, что полупроницаемые мембраны играют роль сита с ячейками, через которые свободно проходят молекулы растворителя, но не проходят молекулы растворенного вещества.
По-видимому, механизм осмоса значительно сложнее. Здесь большую роль играют строение и состав мембраны.
В зависимости от природы мембраны механизм осмоса будет различен. В одних случаях через мембрану свободно проходят только те вещества, которые в ней растворяются, в других случаях мембрана взаимодействует с растворителем, образуя промежуточные непрочные соединения, которые легко распадаются, и, наконец, она может представлять и пористую перегородку с определенными размерами пор.
Для измерения осмотического давления в сосуд с полупроницаемыми стенками наливают исследуемый раствор и плотно закрывают пробкой, в которую вставлена трубка, соединенная с манометром. Такой прибор для измерения осмотического давления называется осмометром.
Осмометр с раствором погружают в сосуд с растворителем. В начале процесса растворитель из наружного сосуда диффундирует в осмометр с большей скоростью, чем из него, поэтому уровень жидкости в трубке осмометра поднимается, что создает в ней гидростатическое давление, которое постепенно увеличивается. По мере увеличения гидростатического давления скорости диффузии растворителя в осмометр и из осмометра уравниваются, в результате чего наступает состояние динамического равновесия, подъем жидкости в трубке осмометра прекращается.
Гидростатическое давление, установившееся в результате осмоса, служит мерой осмотического давления.
Измерение осмотического давления при помощи осмометра не всегда возможно с достаточной точностью, так как не существует мембран, способных задерживать все частицы растворенного вещества. Измеряемое значение осмотического давления для одного и того же раствора будет, следовательно, в какой-то мере зависеть от природы мембраны.
Осмотическое давление возникает лишь на границе между раствором и растворителем (или раствором другой концентрации), если эта граница образована полупроницаемой перегородкой. Раствор, содержащийся в обыкновенном сосуде, не оказывает на его стенки никакого иного давления, кроме обычного гидростатического. Поэтому осмотическое давление надо рассматривать не как свойство растворенного вещества, или растворителя, или самого раствора, а как свойство системы из растворителя и раствора с полупроницаемой перегородкой между ними.
Зако́ны Ра́уля — общее название открытых французским химиком Ф. М. Раулем в 1887 г. количественных закономерностей, описывающих некоторые коллигативные (зависящие отконцентрации, но не от природы растворённого вещества) свойства растворов.
Первый закон Рауля [править]
Первый закон Рауля связывает давление насыщенного пара над раствором с его составом; он формулируется следующим образом:
· Парциальное давление насыщенного пара компонента раствора прямо пропорционально его мольной доле в растворе, причём коэффициент пропорциональности равен давлению насыщенного пара над чистым компонентом.
Для бинарного раствора, состоящего из компонентов А и В (компонент А считаем растворителем) удобнее использовать другую формулировку:
· Относительное понижение парциального давления пара растворителя над раствором не зависит от природы растворённого вещества и равно его мольной доле в растворе
.
На поверхности оказывается меньше способных испаряться молекул растворителя, ведь часть места занимает растворённое вещество.
Растворы, для которых выполняется закон Рауля, называются идеальными. Идеальными при любых концентрациях являются растворы, компоненты которых очень близки по физическим и химическим свойствам (оптические изомеры, гомологи и т. п.), и образование которых не сопровождается изменением объёма и выделением либо поглощением теплоты. В этом случае силы межмолекулярного взаимодействиямежду однородными и разнородными частицами примерно одинаковы, и образование раствора обусловлено лишь энтропийным фактором.
Отклонения от закона Рауля [править]
Растворы, компоненты которых существенно различаются по физическим и химическим свойствам, подчиняются закону Рауля лишь в области очень малых концентраций; при больших концентрациях наблюдаются отклонения от закона Рауля. Случай, когда истинные парциальные давления паров над смесью больше, чем вычисленные по закону Рауля, называют положительными отклонениями
. Противоположный случай, когда парциальные давления паров компонентов оказываются меньше вычисленных —
отрицательные отклонения
.
Причиной отклонений от закона Рауля является то обстоятельство, что однородные частицы взаимодействуют друг с другом иначе, чем разнородные (сильнее в случае положительных и слабее в случае отрицательных отклонений).
Реальные растворы с положительными отклонениями от закона Рауля образуются из чистых компонентов с поглощением теплоты (ΔНраств > 0); объём раствора оказывается больше, чем сумма исходных объёмов компонентов (ΔV > 0). Растворы с отрицательными отклонениями от закона Рауля образуются с выделением теплоты (ΔНраств < 0); объём раствора в этом случае будет меньше, чем сумма исходных объёмов компонентов (ΔV < 0).
Второй закон Рауля [править]
Тот факт, что давление паров над раствором отличается от давления паров над чистым растворителем, существенно влияет на процессы кристаллизации и кипения. Из первого закона Рауля выводятся два следствия, касающиеся понижения температуры замерзания и повышения температуры кипения растворов, которые в объединённом виде известны как второй закон Рауля
.
Понижение температуры кристаллизации растворов [править]
Условием кристаллизации является равенство давления насыщенного пара растворителя над раствором давлению пара над твёрдым растворителем. Поскольку давление пара растворителя над раствором всегда ниже, чем над чистым растворителем, это равенство всегда будет достигаться при температуре более низкой, чем температура замерзания растворителя. Так, океанская вода начинает замерзать при температуре около минус 2 °C.
Разность между температурой кристаллизации растворителя T°fr
и температурой начала кристаллизации раствора
Tfr
есть понижение температуры кристаллизации.
· Понижение температуры кристаллизации бесконечно разбавленных растворов не зависит от природы растворённого вещества и прямо пропорционально моляльной концентрациираствора.
Поскольку по мере кристаллизации растворителя из раствора концентрация последнего возрастает, растворы не имеют определённой температуры замерзания и кристаллизуются в некотором интервале температур.
Повышение температуры кипения растворов [править]
Жидкость кипит при той температуре, при которой общее давление насыщенного пара становится равным внешнему давлению. Если растворённое вещество нелетуче (то есть давлением его насыщенных паров над раствором можно пренебречь), то общее давление насыщенного пара над раствором равно парциальному давлению паров растворителя. В этом случае давление насыщенных паров над раствором при любой температуре будет меньше, чем над чистым растворителем, и равенство его внешнему давлению будет достигаться при более высокой температуре. Таким образом, температура кипения раствора нелетучего вещества Tb
всегда выше, чем температура кипения чистого растворителя при том же давлении
T°b
.
· Повышение температуры кипения бесконечно разбавленных растворов нелетучих веществ не зависит от природы растворённого вещества и прямо пропорционально моляльной концентрации раствора
Криоскопическая и эбулиоскопическая константы [править]
Коэффициенты пропорциональности К
и
Е
в приведённых выше уравнениях — соответственно криоскопическая и эбулиоскопическая постоянные растворителя, имеющие физический смысл понижения температуры кристаллизации и повышения температуры кипения раствора с концентрацией 1 моль/кг. Для воды они равны 1.86 и 0.52 K·моль−1·кг соответственно. Поскольку одномоляльный раствор не является бесконечно разбавленным, второй закон Рауля для него в общем случае не выполняется, и величины этих констант получаютэкстраполяцией зависимости из области малых концентраций до m = 1 моль/кг.
Для водных растворов в уравнениях второго закона Рауля моляльную концентрацию иногда заменяют молярной. В общем случае такая замена неправомерна, и для растворов,плотность которых отличается от 1 г/см³, может привести к существенным ошибкам.
Второй закон Рауля даёт возможность экспериментально определять молекулярные массы соединений, неспособных к диссоциации в данном растворителе; его можно использовать также для определения степени диссоциации электролитов.
Растворы электролитов [править]
Законы Рауля не выполняются для растворов (даже бесконечно разбавленных), которые проводят электрический ток — растворов электролитов. Для учёта этих отклонений Вант-Гоффвнёс в приведённые выше уравнения поправку — изотонический коэффициент i
, неявно учитывающий диссоциацию молекул растворённого вещества:
;
Неподчинение растворов электролитов законам Рауля и принципу Вант-Гоффа послужили отправной точкой для создания С. А. Аррениусом теории электролитической диссоциации.
Упругость Насыщения — упругость водяного пара, максимально возможная приданной температуре. Она тем больше, чем выше температура воздуха. По еедостижении начинается конденсация водяного пара.
Эбуллиоскопическая константа– разница между температурой кипения раствора и температурой чистого растворителя.
Криоскопическая константа– разница между температурой замерзания раствора и температурой чистого растворителя.
74. Явление осмоса, его роль в биологических системах. Осмотическое давление. Закон Вант-Гоффа.
Растворы изотонические, гипо- и гипертонические.
Явление осмоса наблюдается в тех средах, где подвижность растворителя больше подвижности растворённых веществ. Важным частным случаем осмоса является осмос через полупроницаемую мембрану. Полупроницаемыми называют мембраны, которые имеют достаточно высокую проницаемость не для всех, а лишь для некоторых веществ, в частности, для растворителя. (Подвижность растворённых веществ в мембране стремится к нулю). Как правило, это связано с размерами и подвижностью молекул, например, молекула воды меньше большинства молекул растворённых веществ. Если такая мембрана разделяет раствор и чистый растворитель, то концентрация растворителя в растворе оказывается менее высокой, поскольку там часть его молекул замещена на молекулы растворённого вещества (см. Рис. 1). Вследствие этого, переходы частиц растворителя из отдела, содержащего чистый растворитель, в раствор будут происходить чаще, чем в противоположном направлении. Соответственно, объём раствора будет увеличиваться (а концентрация вещества уменьшаться), тогда как объём растворителя будет соответственно уменьшаться.
Значение осмоса [править]
Осмос играет важную роль во многих биологических процессах. Мембрана, окружающая нормальную клетку крови, проницаема лишь для молекул воды, кислорода, некоторых из растворённых в крови питательных веществ и продуктов клеточной жизнедеятельности; для больших белковых молекул, находящихся в растворённом состоянии внутри клетки, она непроницаема. Поэтому белки, столь важные для биологических процессов, остаются внутри клетки.
Осмос участвует в переносе питательных веществ в стволах высоких деревьев, где капиллярный перенос не способен выполнить эту функцию.
Осмос широко используют в лабораторной технике: при определении молярных характеристик полимеров, концентрировании растворов, исследовании разнообразных биологических структур. Осмотические явления иногда используются в промышленности, например при получении некоторых полимерных материалов, очистке высоко-минерализованной воды методом обратного осмоса жидкостей.
Клетки растений используют осмос также для увеличения объёма вакуоли, чтобы она распирала стенки клетки (тургорное давление). Клетки растений делают это путём запасания сахарозы. Увеличивая или уменьшая концентрацию сахарозы в цитоплазме, клетки могут регулировать осмос. За счёт этого повышается упругость растения в целом. С изменениями тургорного давления связаны многие движения растений (например, движения усов гороха и других лазающих растений). Пресноводные простейшие также имеют вакуоль, но задача вакуолей простейших заключается лишь в откачивании лишней воды из цитоплазмы для поддержания постоянной концентрации растворённых в ней веществ.
Осмос также играет большую роль в экологии водоёмов. Если концентрация соли и других веществ в воде поднимется или упадёт, то обитатели этих вод погибнут из-за пагубного воздействия осмоса.
Осмотическое давление (обозначается π) — избыточное гидростатическое давление на раствор, отделённый от чистого растворителя полупроницаемой мембраной, при котором прекращается диффузия растворителя через мембрану. Это давление стремится уравнять концентрации обоих растворов вследствие встречной диффузии молекул растворённого вещества и растворителя.
ЗАКОН ВАНТ-ГОФФА описывает зависимость ОСМОТИЧЕСКОГО ДАВЛЕНИЯ разбавленных растворов от температуры и молярной концентрации раствора: Вант-Гофф пришел к заключению, что закон Авогадро справедлив и для разбавленных растворов. Он экспериментально установил, что осмотическое давление, представляющее собой меру стремления двух различных растворов по обе стороны мембраны к выравниванию концентрации, в слабых растворах зависит не только от концентрации, но и от температуры и, следовательно, подчиняется законам термодинамики газов. Вант-Гофф выразил осмотическое давление формулой РV = iRT, где Р означает осмотическое давление вещества, растворенного в жидкости; V – объем; R – газовую постоянную; Т – температуру и i – коэффициент, который для газов часто равен 1, а для растворов, содержащих соли, – больше единицы. Вант-Гофф смог объяснить, почему изменяется значение i, связав этот коэффициент с числом ионов, находящихся в растворе. Проведенные Вант-Гоффом исследования разбавленных растворов явились обоснованием теории электролитической диссоциации С.Аррениуса. Впоследствии Аррениус приехал в Амстердам и работал вместе с Вант-Гоффом.
Изотонический раствор (изоосмотический раствор) — раствор, осмотическое давление которого равно осмотическому давлению плазмы крови; например, 0,9 % водный раствор хлорида натрия, 5 % водный раствор глюкозы. Все эти растворы используются в терапии различных заболеваний с целью снятия интоксикации и других проявлений болезни. Изотонические расвторы, в отличие от гипертонических и гипертонических (не применяются для внутривенного введения) не приводят к гемолизу эритроцитов при внутривенном введении.
Гипотонические растворы отличаются от изотонического меньшей концентрацией и соответственно меньшим осмотическим давлением. При контакте с тканями вода из гипотонических растворов поступает в клетки тканей. Вследствие этого они набухают, а при чрезмерном накоплении в них воды наступает разрыв клеточных оболочек, т. е. лизис клеток.
Применение гипотонических растворов натрия хлорида в практике очень ограничено. В ряде случаев они используются для приготовления растворов веществ, применяемых для инфильтрационной анестезии. Действиеанестетиков в гипотонических растворах усиливается, так как последние способствуют более глубокому проникновению веществ в ткани.
Гипертонические растворы, растворы, осмотическое давление которых выше осмотического давления в растительных или животных клетках и тканях. В зависимости от функциональной, видовой и экологической специфики клеток осмотическое давление в них различно, и раствор, гипертоничный для одних клеток, может оказаться изотоничным или даже гипотоничным для др. При погружении растительных клеток в Г. р. он отсасывает воду из клеток, которые уменьшаются в объёме, а затем дальнейшее сжатие прекращается и протоплазма отстаёт от клеточных стенок (см. Плазмолиз). Эритроциты крови человека и животных в Г. р. также теряют воду и уменьшаются в объёме. Г. р. в сочетании с гипотоническими растворами иизотоническими растворами применяют для измерения осмотического давления в живых клетках и тканях.
Какие показатели считаются нормой, а какие – отклонением от нормы
Во время данного обследования крови находят точку ее замерзания. Оптимальное значение для кровяного раствора, это минус 0,56-0,58 градусов. Если перевести в атмосферное давление, то нормальными показателями силы осмоса является величина в 7,5-8 миллиметров ртутного столба. При показателе либо большем, либо меньшем, чем указанные границы, его величина будет отклонением от оптимальной.
Белки, как и соли, также создают осмотическое давление плазмы, но более слабое, в сравнении с ними (его величина составляет 26-30 миллиметров ртутного столба). Такое давление еще называют онкотическим, и оно изменяет значение общего показателя.
Что влияет на показатели осмоса
На показатели силы осмоса оказывают влияние правильность питания и питьевой режим, а также здоровая функциональность органов выделения. Количество солей в составе плазмы прямо воздействует на показатели осмотического давления. При их избытке осмос будет повышаться, а при недостатке — понизится.
А норма употребления жидкости должна быть не менее 1,5 литра в сутки, иначе организм будет обезвоживаться, и кровь обретет повышенную вязкость.
Но, к счастью, при дефиците жидкости, у человека возникает жажда, и он пополняет свой запас воды. Работа почек, мочевого пузыря и железы потоотделения также регулируют количество солей и растворителя в организме, но если повышенная концентрация соли постоянна, то это провоцирует ее задержку в клетках. Затем стенки сосудов делаются более толстыми, сужаются просветы межклеточного пространства.
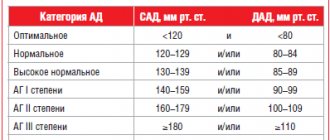
Как результат, возникает задержание жидкости, что приводит к увеличению объемов крови, движущейся по сосудам, что провоцирует возрастание показателей артериального давления. Все это отрицательно влияет на функционирование сердечно-сосудистой системы и вызывает появление отеков.
Роль осмотического давления воды для живых организмов
Осмос имеет большое значение в окружающей среде и деятельности человека. Например, он участвует в переносе жидкости в стволах высоких деревьев, в наполнении водой клеток и межклеточных структур живых организмов. Биологические жидкости человека — тканевые жидкости, кровь, лимфа тоже поддаются законам осмотического давления. В лабораторных условиях с его помощью исследуют характеристики вновь получаемых полимерных веществ, а в промышленности используют для очистки воды от минералов методом обратного осмоса.
Не менее важную роль осмос играет в экологии водоемов. При изменении концентрации солей в воде, обитатели могут погибнуть, так, например, если поместить пресноводное животное в морскую воду, то оно вскоре потеряет пятую часть своего веса, а если морского обитателя перенести в пресную воду, то из-за диффузии молекул повысится уровень внутриклеточной жидкости, клетки его органов разбухнут и лопнут.
Методы измерения
Наиболее широко распространенных способов измерения давления осмоса существует два. Каким из них воспользоваться, врачи выбирают, исходя из ситуации.
Криоскопический способ
Поскольку температура замерзания крови напрямую зависит от количества в ней веществ, то данный метод часто используют. Чем насыщеннее плазма, тем при более низкой температуре она твердеет. Показатель осмоса, это важный параметр в работе организма, и он показывает, в оптимальных ли количествах присутствует в нем растворитель (вода).
Измерение осмометром
Второй вариант измерения предлагает делать это при помощи специального прибора — осмометра. Он представляет собой 2 колбы с перегородкой. Проходимость между ними частичная.
В одну из них наливают кровь и накрывают крышкой со шкалой, а в другую раствор. Он может быть гипертоническим, гипотоническим либо изотоническим. Смотрят на показатели шкалы в сосуде.
От чего зависит осмотическое давление воды
Важным условием осмоса является наличие полупроницаемой мембраны, то есть такого материала, поры которого будут достаточного размера, чтобы свободно пропускать молекулы растворителя и удерживать в растворе частицы растворенного вещества.
Осмотическое давление воды зависит от двух основных факторов:
- концентрация раствора;
- температура.
Это объясняется уравнением Вант-Гоффа. Осмотическое давление воды равно: π = RCT,
где R — универсальная газовая постоянная,
С — концентрация вещества,
Т — температура.
Ученый выявил, что осмотическое давление жидкостных растворов, подчиняется тем же законам, что и давление газовых систем. С помощью данного уравнения определяется величина давления.
Оно не зависит от состава растворенного вещества, поэтому осмотическое давление считается коллигативным свойством раствора, то есть обусловленным самопроизвольным движением молекул, их количеством, а не составом.
Для возникновения осмотического давления воды в системе необходимо два критерия:
- присутствие полупроницаемой мембраны;
- нахождение двух растворов с разной концентрацией по обе стороны от перегородки.
Способы нормализации
Человеческий организм обладает способностью саморегуляции осмотического давления. Когда от головного мозга поступает соответственный импульс об уменьшении объема межклеточной жидкости, то образуется гормон, который поступает в кровь. Затем на его присутствие реагируют почки.
Также способностью привести параметры осмотического давления к оптимальным значениям обладает и кровь, которая исполняет роль буферного устройства, как при повышении давления, связанного с осмосом, так и при его понижении.
Это происходит из-за перераспределения ионов между плазмой крови и красными тельцами, и «умением» белков в составе крови присоединять либо отдавать ионы.
Профилактические методы
На регуляцию силы осмоса оказывают влияние почки. Если организм нуждается в дополнительной жидкости, то насыщенность крови активными веществами будет избыточной, а это провоцирует возрастание значения давления. Поэтому нужно внимательно относиться к своим чувствам, и если возникает жажда, ее тут же нужно утолять.
Также следует придерживаться правильного питания:
- Следят за количеством соли в пище. Пересол и избыточное увлечение пряностями может привести к снижению проницаемости сосудов из-за наличия на их стенках отложений соли.
- Ограничивают такие напитки, как кофе, кока-кола, пиво. Они могут спровоцировать склеивание эритроцитов и обладают мочегонным эффектом, то есть активно выводят жидкость из организма.
- Нужно отказаться от различных диет и голодания. Эти эксперименты над собой приводят к снижению уровня белков в составе крови, а это изменяет вязкость крови и способствует возникновению тромбоза, вызывает истощение и чувство усталости, снижаются защитные силы человека.
Сила осмоса в человеческом организме отвечает за оптимальное перераспределение жидкости, потому что количество активных веществ должно находиться на определенном уровне. Это очень важный показатель, который освещает состояние здоровья. Для того чтобы его значения были в пределах нормы, полезно пить больше воды, а соль добавлять в пищу в умеренных количествах.