Если инфекционным процессом поражен артериовенозный шунт, то это инфекционный эндартериит. Типичным признаком являются вегетации, расположенные на створках клапанов или на эндокарде свободных стенок сердца. Это описание врачи начинали описывать еще в 17-м веке.
При остром течении заболевания без правильной терапии происходит поражение сердца, вероятны осложнения и летальный исход. Если течение затяжное (также называется подострым), то диагностика может быть осложнена. Могут быть маски эндокардита в виде анемии, нефрита, тяжелой СН. Тогда влияние эндокардита на организм обнаруживается поздно, и очень важную роль имеет терапия антибактериальными препаратами.
Течение болезни и эффект от терапии зависят от того, что спровоцировало инфекционный процесс, а также от пораженного отдела эндокарда. Болезнь развивается во многих случаях при сердечной патологии, особенно если поражен митральный клапан. Располагающими к рассматриваемой болезни факторами являются предшествующее протезирование клапана и в/в введение определенных веществ.
В развитых странах, по статистике, на 10000 населения эндокардитом болеют от 2,6 до 7 людей. На сегодня болезнь всё чаще встречается у людей зрелого возраста – от 40 лет.
Этиология
Эндокард может воспалиться под влиянием микроорганизмов. Зачастую это грамположительные бактерии, иногда и грамотрицательные. Именно по этой причине инфекционный эндокардит известен также как бактериальный. В 90 случаях из 100 болезнь вызвана стафилококками, стрептококками, энтерококками. Также возбудителями болезни могут быть грибы, хламидии, риккетсии.
Острый инфекционный эндокардит обычно вызван золотистым стафилококком, который поражает нормальные створки, потому возникают метастатические очаги. Причиной подострого ИЭ зачастую является зеленящий стрептококк. Метастатические очаги при этом не формируются.
Патогенез
Инфекционный эндокардит возникает вследствие взаимодействия трех факторов:
- бактериемии, возникающей при ряде обстоятельств (преходящей бактериемии);
- состояния организма человека;
- тропности микроорганизма к эндокарду и степени вирулентности.
Если в результате воздействия высокоскоростного и турбулентного потока крови возникло повреждение эндотелия, он известен как первичный. Далее возникает адгезия тромбоцитов. Всё больше откладывается фибрин, в зоне пораженного эндотелия формируется тромб. Циркулирующие микроорганизмы оседают в области небактериального эндокардита и размножаются.
Преходящая бактериемия часто возникает при обычной чистке зубов, сопровождающейся кровотечением, удалении зубов и прочих стоматологических вмешательствах.
Микроорганизмы, которые являются возбудителями эндокардиты, попадают в кровь в основном с поверхности слизистых или из очагов инфекции. В организме может индуцироваться прокоагулянтное состояние. Важную роль в прогрессировании процесса играют цитокины, высвобождающиеся в результате повреждения сердечных структур.
На клапанах сердца «оседают» микроорганизмы, которые приводят к иммунным нарушениям. В результате этого может быть повреждение разных органов и тканей. Часто при ИЭ в крови находятся циркулирующие иммунные комплексы, а белки системы комплемента снижены.
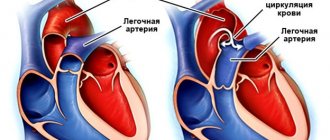
Вегетации чаще расположены в левых отделах сердца — на аортальном и митральном клапанах. В патогенезе имеет важное значение такой фактор как бактериемия, а также метастазы инфекции (в разных органах формируются абсцессы микро размеров).
Клиническая картина заболевания
Клиника инфекционного эндокардита образована тремя компонентами.
Первый — септический (при попадании в кровь любой инфекции развивается высокая температура, выраженная слабость, учащение пульса, нарушения свертывающей системы крови).
Второй компонент — это проявление местной инфекции. Микроорганизмы образуют колонии на внутренней оболочке сердца, чаще всего на клапанах — так называемые вегетации. Вегетации могут выявляться при ультразвуковом исследовании сердца. Иногда при обычной эхокардиографии они не видны, и тогда для диагностики необходимо ультразвуковое исследование через пищевод (похожее на гастроскопию, только специальным ультразвуковым датчиком).
Третий компонент — последствия отрыва вегетаций от клапанов — закупорка вегетациями кровеносных сосудов (эмболия). Куски вегетаций могут «улетать» в любые кровеносные сосуды — мозга, сердца, почек, конечностей, легких, вызывая отмирание соответствующих тканей из-за нарушения кровотока, что сопровождается клиническими проявлениями поражения конкретного органа.
Если у пациента с высокой температурой (лихорадкой) неизвестного происхождения длительностью более недели, не поддающейся обычному лечению антибиотиками, возникают дополнительные симптомы (шум в сердце или нарушения в органах, в сосуды которых «улетел» оторвавшийся кусок вегетации), необходимо обследование на наличие инфекционного эндокардита.
Симптомы
От пациентов с ИЭ поступают различные жалобы. В основном такие:
- озноб
- лихорадка
- повышенная утомляемость
- потливость в ночные часы
- миалгии
- артралгии
Нужно учитывать, что такие симптомы характерны также для эндартериита артериовенозного шунта.
Симптомы инфекционного эндокардита:
- высыпания на коже
- повышение температуры тела (в основном до субфебрильных значений)
- увеличение селезенки
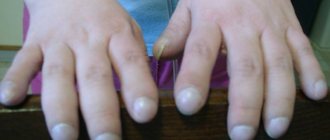
- изменения дистальных фаланг пальцев и ногтей
- артралгии
- протеинурия
- анемия
- тромбоэмболии и тромбоваскулиты
- повышение уровня у-глобулинов
- увеличение СОЭ
Сердечные проявления ИЭ
- шумы
- диффузный миокардит
- абсцесс фиброзного кольца
- инфаркт миокарда
- сердечная недостаточность
Внесердечные проявления ИЭ
- гепатоспленомегалия и лимфаденопатия
- гнойные осложнения в виде абсцессов
- пальцы в виде «барабанных палочек» и ногти в виде «часовых стекол»
- тромбоэмболии, приводящие к инфарктам различных органов
На сегодняшний день отмечают такие особенности болезни:
- у человека может не быть лихорадки
- может начаться длительная лихорадка, при которой не будет явного поражения клапанов сердца
- чаще всего инфекционный эндокардит фиксируют у людей пожилого возраста, у тех, кто потребляет наркотики, у больных с протезированными клапанами сердца
- может быть длительное течение с поражением одного органа или ткани
- лицам из группы высокого риска часто рекомендована профилактика при помощи антибиотиков
Симптомы бактериального эндокардита
Специалисты выделяют специфические и неспецифические проявления заболевания. К последним относят повышение температуры выше 38 градусов, озноб, утомляемость, слабость и боль в суставах. Характерными неспецифическими симптомами является теплая сухая кожа, резкое увеличение селезенки.
Специфические проявления:
- нарушения в работе сердца и признаки сердечной недостаточности (одышка, боль в сердце, тахикардия);
- неврологическая симптоматика;
- ишемия брюшных органов и конечностей;
- геморрагические высыпания в форме петехий;
- увеличение печени.
О клинических рекомендациях при эндокардите речь пойдет дальше.
Диагностика
ИЭ подозревают, если у человека есть лихорадка с ознобом, в сердце есть шумы, меняется форма пальцев, увеличивается селезенка, находят изменения в моче, фиксируют эмболию. Важное значение имеет выделение возбудителя заболевания, чтобы подтвердить диагноз и выбрать противомикробные препараты.
Нельзя сказать, что диагностика ИЭ простая. У человека может не быть лихорадки, если есть СН или выраженная почечная недостаточность. Также лихорадки часто не наблюдают у тех, кто принимает антибиотики или антипиретики. Врачи могут не зафиксировать сердечный шум, он отсутствует примерно у 15% лиц с ИЭ.
Анализ крови
Больше чем у 50% пациентов находят умеренно выраженную нормохромную анемию, особенно при подострой форме инфекционного эндокардита. Почти у 100% больных СОЭ выше нормы, значение иногда достигает 70-80 мм/ч. Даже при эффективной терапии СОЭ будет повышена на протяжении от 3 до 6 месяцев. При нормальной СОЭ нельзя отбрасывать диагноз ИЭ. Типичным проявлением болезни является со сдвигом лейкоцитарной формулы влево, при этом хотя количество лейкоцитов может находиться в пределах нормы или быть сниженным. Часто увеличивается концентрация сиаловых кислот и диспротеинемия с увеличением уровня у-глобулинов.
Для ИЭ характерны такие изменения крови как иммунные комплексы. Их концентрация зависит от длительности болезни, выраженности внесердечных признаков, о которых писали выше. Типично обнаружение СРБ. При адекватном лечении он нормализуется раньше СОЭ.
Анализ мочи
При анализе мочи находят протеинурию и микрогематурию, причиной чего может быть повышение температуры или появление тромбоэмболии. Если развивается гломерулонефрит, в моче находят выраженную стойкую протеинурию и гематурию. При инфекционном эндокардите вероятно прогрессирование нефрита с развитием почечной недостаточности.
Гемокультура
При подостром течении ИЭ бактериемия постоянная. Чтобы обнаружить ее, лучше всего 3 раза провести забор крови из вены в объеме 16-20 мл с интервалом 1 ч между первой и последней венепункциями. Когда будет выявлен возбудитель эндокардита, определяют чувствительность его к антибиотикам.
Примерно у 50; больных кровь при терапии антибиотиками бывает стерильной. Такое может быть также, если возбудителями ИЭ являются грибы и хламидии, а также некоторые бактерии. Чтобы получить результаты, иногда увеличивают время инкубации, применяют серологические исследования с реакцией непрямой иммунофлюоресценции.
Электрокардиография
ЭКГ обнаруживает в 4-16 случаях из 100 нарушения проводимости. Они появляются как результат абсцесса миокарда или очагового миокардита на фоне ИЭ. Если есть эмболическое поражение венечных артерий, можно обнаружить на ЭКГ изменения, как при инфаркте миокарда, то есть будет выражен зубец 0.
Эхокардиография
ЭхоКГ выявляет вегетации, размер который от 4-5 мм. Также вегетации можно выявить, причем более успешно, при чреспищеводной ЭхоКГ. ЭхоКГ позволяет обнаружить перфорацию створок, абсцессы, разрыв синуса Вальсальвы. Этот метод актуален за динамикой процесса и эффективностью проводимой терапии.
Лечение
При выявлении инфекционного эндокардита человека госпитализируют. Ему нужно соблюдать постельный режим, пока не пройдет острая фаза воспаления. Человека лечат в стационаре, пока температура тела и выше описанные лабораторные показатели не нормализуются. Также для выписки из стационара нужно бактериологическое исследование крови и анализ динамики регрессирования симптоматики.
Для лечения ИЭ всегда применяют антибиотики. Назначают лекарство с бактерицидным действием. В вегетациях нужно создать высокую концентрацию препарата. Антибиотики вводятся в/в, курсы лечения длительные. В зависимости от выявленного возбудителя инфекционного эндокардита, выбирают определенные антибиотики. Если возбудитель — грамположительные бактерии, применяют полусинтетические пенициллины, бензилпенициллин, ванкомицин или цефалоспорины I и II поколения.
Если возбудителем ИЭ являются грамотрицательные бактерии, проводят лечение аминогликозидами, цефалоспоринами III поколения, карбапенемами, фторхинолонами. При болезни, вызванной грибками, актуально применение амфотерицина В и флуконазола. Образование вегетаций минимизируется при терапии тиклопидином и ацетилсалициловой кислотой. В случаях, когда данные о возбудителе воспалительного процесса нельзя получить, проводится эмпирическая терапия. При острой форме инфекционного эндокардита назначают оксациллин в комбинации с ампициллином (2 г внутривенно каждые 4 часа) и гентамицином (1,5 мг на 1 кг тела внутривенно каждые 8 часов). При подостром инфекционном эндокардите используют следующую комбинацию: ампициллин по 2 г внутривенно каждые 4 часов в сочетании с гентамицином по 1,5 мг/кг внутривенно каждые 8 часов.
Этиотропное лечение не всегда обеспечивает полное выздоровление. В трети случаев приходится применить хирургические методы лечения. Клапаны протезируют, вегетации удаляют. Абсолютные показания к хирургическому лечению инфекционного эндокардита:
- Устойчивость к антибактериальной терапии в течение 3 недель
- Нарастание сердечной недостаточности или ее рефрактерность к лечению
- Грибковая инфекция
- Абсцессы миокарда, фиброзного клапанного кольца
- Деструкция клапана с развитием его выраженной недостаточности
- Эндокардит искусственного клапана
Относительные показания к хирургическому лечению инфекционного эндокардита:
- Сохранение лихорадки, несмотря на проводимое лечение
- Повторные эмболизации вследствие деструкции вегетации
- Увеличение размеров вегетации в течении прохождения терапии
В большинстве лечебных заведений летальные исходы при ИЭ бывают в 8-16 случаях из 100, а 75% живут после лечения на протяжении 5 лет.
ИНФЕКЦИОННЫЙ ЭНДОКАРДИТ: диагностика, клиническое течение, лечение
Инфекционный эндокардит (ИЭ) относится к числу тяжелых заболеваний с высоким уровнем летальности. В отсутствии лечения смертность при ИЭ составляет 100%. В последние годы отмечается значительный рост числа больных эндокардитом в нашей стране и за рубежом. По данным различных авторов, сегодня выросла заболеваемость в пожилом и старческом возрасте, а также среди лиц в возрасте до 30 лет, использующих внутривенное введение наркотиков [1, 2].
Известно, что ИЭ представляет собой заболевание инфекционной природы с первичной локализацией возбудителя на клапанах сердца, пристеночном эндокарде, протекающее с проявлениями системной инфекции, сосудистыми осложнениями и иммунной реакцией [3, 4, 5].
Традиционно развитие ИЭ связывают с наличием «внутрисердечных» факторов риска, к которым относят врожденные и приобретенные пороки сердца, наличие протезированных клапанов, пролапсов клапанов и другие аномалии [6]. В последние годы к категории лиц повышенного риска отнесены больные с очаговой инфекцией, а также лица, у которых применялись инвазивные методы исследования, включая установку подключичного катетера [7]. Особую группу риска составляют наркоманы, практикующие внутривенное введение наркотиков, у которых ИЭ протекает с поражением интактных клапанов сердца.
В данной работе обобщен опыт диагностики и ведения больных ИЭ на базе общетерапевтического отделения Александровской больницы Санкт-Петербурга за период 1998–2003 гг. Диагностика заболевания осуществлялась в соответствии с критериями Duke [8]. Диагноз ИЭ оценивался как достоверный при наличии двух главных критериев, а именно:
- при выделении типичного для ИЭ возбудителя при посевах крови больного;
- при определении эхокардиографических признаков поражения эндокарда — подвижные вегетации на клапанах сердца, абсцессов в области протеза клапана; образования внутрисердечных фистул и др., в сочетании с тремя или/и пятью вспомогательными критериями, к которым относились сосудистые осложнения (эмболии крупных артерий, септические инфаркты легких, внутричерепные кровоизлияния и др.), иммунологические феномены (гломерулонефрит, узелки Ослера, геморрагический васкулит и др.), а также фебрильная лихорадка, гепато-спленомегалия и другие проявления системной инфекции.
Нами было проведено обследование 105 больных ИЭ, из них у 80 человек в возрасте от 18 до 30 лет (первая группа) основным фактором риска заболевания являлась инъекционная наркомания.
Во второй группе больных (25 чел.) основными предрасполагающими факторами развития ИЭ были врожденные и приобретенные пороки сердца, а также протезированные клапаны.
У лиц старшей возрастной группы дополнительным фактором риска являлись дегенеративно-дистрофические изменения клапанов сердца.
Взаимосвязь характера поражения клапанов сердца и факторов риска ИЭ представлена в таблице 1.
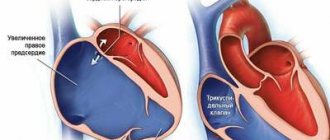
По данным эхокардиографического исследования, у 100% больных первой группы были выявлены подвижные вегетации на створках трикуспидального клапана (ТК), что сопровождалось формированием его недостаточности I—III степени.
Во второй группе больных ИЭ отмечалось поражение левых камер сердца с образованием вегетаций на створках аортального и митрального клапанов. Изолированное поражение митрального клапана наблюдалось у двух человек с ревматическим пороком сердца (митральный стеноз), у одной больной с врожденным дефектом межжелудочковой перегородки и в единственном случае обструктивной формы гипертрофической кардиомиопатии.
Среди лиц пожилого и старческого возраста у девяти человек (36%) определялось изолированное поражение аортального клапана в отсутствии признаков аортального стеноза. Наряду с этим, у пяти больных (20%) в возрасте от 72 до 87 лет ИЭ развился на фоне аортального порока атеросклеротического генеза, причем у всех пятерых было выявлено сочетанное поражение аортального и митрального клапанов. Дегенеративно-дистрофические изменения других клапанов сердца определялись у 100% больных старшей возрастной группы.
Образование вегетаций на створках аортального клапана наблюдалось у двух больных с третичной формой сифилиса на фоне имеющегося аортального порока, связанного со специфическим процессом в аорте.
В двух случаях мы наблюдали развитие эндокардита протезированных клапанов.
При сопоставлении результатов посевов крови в двух группах больных определялись существенные различия как в частоте выделения микробной флоры, так и в видовом составе возбудителей эндокардита. По нашим данным, возбудителем ИЭ у больных-наркоманов в 71,3% наблюдений (57 чел.) являлся золотистый стафилококк, тогда как во второй группе, наряду с кокковой флорой, чаще обнаруживались грамотрицательные микроорганизмы (28%). Отрицательные результаты посевов крови значительно реже наблюдались в первой, чем во второй, группе больных ИЭ: 18,7% и 56% — соответственно. Данные относительно этиологической структуры ИЭ в обследуемых группах больных представлены в таблице 2.
Клиническая характеристика и особенности течения ИЭ
Клиническое течение и характер осложнений инфекционного эндокардита во многом зависят от локализации клапанных вегетаций — в правых или левых камерах сердца, а также степени вирулентности возбудителя заболевания.
Течение ИЭ у больных-наркоманов отличалось особой тяжестью и полисиндромностью. Причиной госпитализации у большинства больных были острые осложнения основного заболевания. Значительная часть больных поступала в реанимационное отделение стационара с клиническими симптомами одно- или двухсторонней многофокусной пневмонии, причиной которой являлась септическая тромбоэмболия ветвей легочной артерии (72% больных). Течение пневмонии сопровождалось тяжелой дыхательной недостаточностью, нередко с развитием респираторного дистресс-синдрома (РДСВ) и очагами деструкции в легких (12%). Проявления вторичной нефропатии, которые обнаруживались у 100% больных в первой группе, иногда ошибочно трактовались как обострение хронического гломеруло- или пиелонефрита, мочекаменной болезни, что служило поводом для госпитализации этих больных в урологическое и нефрологическое отделения.
Во второй группе больных основной причиной госпитализации была длительная фебрильная лихорадка в сочетании с анемией и гепатолиенальным синдромом. Наряду с этим, у пяти человек (20%) поводом для госпитализации послужила прогрессирующая сердечная недостаточность.
Основные клинические синдромы, наблюдаемые у больных ИЭ первой и второй групп, представлены в таблице 3.
По нашим наблюдениям, характерной особенностью клинического течения ИЭ у больных-наркоманов являлась высокая частота септической ТЭЛА с формированием множественных очагов инфильтрации в легких. У многих больных легочные тромбоэмболии носили рецидивирующий характер (31,3% больных) и нередко осложнялись развитием деструктивных очагов в легких.
Образование вегетаций у 100% больных первой группы сопровождалось недостаточностью трехстворчатого клапана I—III степени с формированием потоков регургитации. Вместе с тем, у большинства пациентов не определялось тяжелых нарушений центральной гемодинамики, связанных с дисфункцией ТК. В данной группе больных характерной клинической особенностью был обратимый характер нарушений гемодинамики на фоне проводимой терапии. Острая сердечная недостаточность с дилятацией полостей сердца и снижением фракции выброса до 40% и ниже наблюдалась у 28 больных (35,3%) в связи с присоединением острого миокардита или на фоне сочетанного поражения клапанов сердца.
Вторичная нефропатия являлась одним из самых распространенных синдромов в первой группе больных ИЭ. Острая почечная недостаточность наблюдалась у 16 больных, причем у 10 из них она носила обратимый характер и была связана с острым ДВС-синдромом, а также с острой сердечной недостаточностью с отеками. Инфекционно-токсическая нефропатия регистрировалась в 73,8% наблюдений и сопровождалась мочевым синдромом — гематурией, протеинурией, лейкоцитурией — при достаточном уровне клубочковой фильтрации.
Характерной особенностью ИЭ во второй группе было подострое течение заболевания с длительным периодом лихорадки на догоспитальном этапе, причем в пожилом и старческом возрасте лихорадка носила субфебрильный характер с редкими подъемами температуры до фебрильных цифр.
Большинство больных подострым инфекционным эндокардитом (ПИЭ) поступали в стационар в стадии развернутой клинической картины заболевания с клиническими признаками тромбоэмболии сосудов большого круга кровообращения. В данной группе больных наиболее распространенными следует признать такие осложнения, как церебральные эмболии с развитием ишемических и геморрагических инсультов, эмболии почечных сосудов с болевым синдромом и гематурией, а также формирование острых очаговых изменений в миокарде, связанных с эмболией коронарных сосудов или прикрытием устьев коронарных артерий вегетациями [9].
Септические тромбоэмболии церебральных сосудов нередко сопровождались развитием гнойного менингоэнцефалита с летальным исходом. Вместе с тем, при посевах крови у 56% больных второй группы не получено роста микробной флоры. Обращает на себя внимание тот факт, что септицемия у больных с положительными результатами посевов крови в 28% наблюдений была обусловлена грамотрицательной микрофлорой. В этой категории больных источником бактериемии являлись очаги хронической инфекции в мочеполовой системе, а у двух больных (по данным аутопсии) был выявлен двухсторонний апостематозный нефрит.
У значительного числа больных ПИЭ (62%) определялись признаки острой недостаточности кровообращения с застойными хрипами в легких, легочной гипертензией, увеличением полостей сердца и периферическими отеками.
В этой группе больных чаще, чем в первой, наблюдалась преренальная азотемия и ОПН, связанные с развитием острой недостаточности кровообращения.
Острый диффузный миокардит, типичными проявлениями которого были различные нарушения ритма, диагностирован у 27% больных второй группы.
Анемия со снижением уровня гемоглобина до 80 г/л и менее выявлена у 100% больных второй группы. Значительное увеличение СОЭ (более 45 мм/ч) наблюдалось у 85,8% больных подострым ИЭ.
Кожные изменения в виде геморрагических высыпаний, пурпуры Шенлейн-Геноха, а также другие проявления иммунного воспаления в обеих группах больных встречались нечасто — 6,3 и 4% в первой и второй группах, соответственно.
Лечение больных ИЭ
Консервативная терапия больных ИЭ проводилось с использованием антибиотиков широкого спектра действия в сочетании со средствами дезинтоксикационной, антикоагулянтной и метаболической терапии. В составе антибактериальной терапии больные получали цефалоспорины III-IV поколений в комбинации с аминогликозидами и метронидазолом. Из группы цефалоспоринов назначались: цефтриаксон (лонгацеф) 2 г в сутки внутривенно (в/в), или цефотаксим (тальцеф) 2 г в сутки в/в, или цефепим (максипим) 2 г в сутки в/в в сочетании с аминогликозидами (амикацин в суточной дозе 1,5 г в/в) и метронидазолом по 1,5-2 г в сутки в/в. В случае, если такая терапия оказывалась неэффективной или существовали противопоказания к вышеперечисленным препаратам, применялись антибиотики группы линкозаминов: клиндамицин 1,2 г в сутки в/в или линкомицин 3 г в сутки в/в в сочетании со фторхинолонами (ципрофлоксацин 400 мг в сутки в/в). В условиях отделения реанимации в течение пяти–семи дней проводилась терапия имипинемом (тиенамом) в дозе 2—4 г в сутки в/в или рифампицином в суточной дозе 0,45—0,6 г в/в. Средняя продолжительность курса антибиотикотерапии в обследуемой группе больных составила 28 + 3,5 дней.
Дезинтоксикационная терапия включала в себя внутривенные инфузии реополиглюкина, гемодеза, поляризующих смесей в сочетании с петлевыми диуретиками. Объем вводимой жидкости составлял в среднем 2-2,5 л в сутки. В течение всего периода инфузионной терапии осуществлялся контроль за функциональным состоянием почек, электролитным составом крови, суточным диурезом. В условиях отделения реанимации у всех больных осуществлялся мониторинг ЦВД. Инфузионная терапия проводилась в течение всего острого периода заболевания до купирования проявлений интоксикационного синдрома. Средняя продолжительность курса составила 22 + 4,5 дня.
Развитие легочной эмболии, особенно в сочетании с признаками острого ДВС-синдрома в стадии гиперкоагуляции, служило основанием для назначения антикоагулянтной терапии. Начальная доза гепарина составляла 10 тыс. ЕД внутривенно, струйно, за-тем — по 1000 ЕД в час внутривенно, капельно с переходом на подкожное введение до 30 тыс. ЕД в сутки. Введение гепарина осуществлялось под контролем показателей коагулограммы и времени свертывания крови. Одновременно проводились внутривенные трансфузии свежезамороженной плазмы по 300 мл в сутки с добавлением 2500–5000 ЕД гепарина. Анемия тяжелой степени (Нb менее 80 г/л, Ht ≤25) корригировалась переливаниями эритроцитарной массы (пять–семь доз). При наличии гипопротеинемии использовалось введение растворов аминокислот, альбумина или нативной плазмы. Выявление клинических и рентгенологических признаков отека легких на фоне рецидивирующего течения септической ТЭЛА служило показанием для назначения кортикостероидов (преднизолон от 120 до 200 мг в сутки внутривенно капельно). Терапия антикоагулянтами прямого действия в сочетании с трансфузиями криоплазмы проводилась до стойкого улучшения показателей гемостаза. Критериями нормокоагуляции являлись уровень фибриногена в плазме 3-4 г/л, отсутствие тромбоцитопении, нормализация ВСК, АЧТВ, тромбинового времени, а также отрицательные паракоагуляционные тесты. По нашим данным, купирование проявлений острого ДВС-синдрома на стадии гиперкоагуляции у 75% больных отмечалось на седьмой–десятый день от начала комплексной терапии.
У части больных формировалась резистентность к проводимой антибактериальной терапии, которая характеризовалась нарастанием интоксикации, фебрильной лихорадкой, прогрессирующей анемией, а также высевами из крови возбудителя ИЭ – золотистого стафилококка — в 65% наблюдений. При рентгенологическом обследовании данной категории больных с большой частотой определялись очаги деструкции легочной ткани, а у трех больных гнойный выпот в плевральной полости.
Длительное применение антибиотиков широкого спектра действия у 70,3% больных (38 чел.) сопровождалось развитием побочных эффектов антибактериальной терапии. Кандидоз полости рта глотки, пищевода, а также кишечный дисбактериоз III-IV стадии был выявлен у 36 больных (66,7%). Применение антибиотиков с гепатотоксическими свойствами (цефалоспорины, линкозамины, метронидазол) у двух больных (3,7%) с хроническим гепатитом С и В приводило к прогрессированию печеночной недостаточности, которая сопровождалась высокой ферментемией (АЛТ 1500 ЕД, АСТ 1000 ЕД) и желтухой.
Развитие застойной сердечной недостаточности с появлением акроцианоза, влажных хрипов в базальных отделах легких, периферических отеков в сочетании с кардиомегалией и падением фракции выброса до 50—45% наблюдалось у пяти больных (9,3%) на фоне массивной инфузионной терапии.
Длительная антикоагулянтная терапия в 20,4% (11 чел.) наблюдений сопровождалась повышением толерантности плазмы к гепарину, что клинически выражалось в развитии периферических флеботромбозов, в то время как гепарининдуцированной тромбоцитопении в обследуемой группе больных мы не наблюдали.
Положительные результаты консервативной терапии были получены у 70,2% больных (56 чел.) с поражением ТК и лишь у 32% пациентов (6 чел.) из второй группы. Исходом ИЭ в обеих группах больных являлось формирование недостаточности клапанов сердца.
Госпитальная летальность при ИЭ у наркозависимых лиц составила 29,4% (24 чел.), тогда как у больных с поражением левых камер сердца (вторая группа) уровень смертности составил 68% (19 чел.).
По данным аутопсии, основными причинами смерти больных ИЭ были:
- септикопиемия с формированием гнойных очагов в печени, почках селезенке, головном мозге с развитием полиорганной недостаточности (46,2%);
- сердечная недостаточность на фоне полипозно-язвенного эндокардита с разрушением клапанов сердца, а также острый миокардит с дилятацией полостей сердца (39,4%);
- вторичная нефропатия с развитием почечной недостаточности, отеком легких, отеком головного мозга (14,4%).
Таким образом, характерные особенности ИЭ у лиц с наркотической зависимостью — это острое течение заболевания с поражением правых камер сердца и рецидивами септической ТЭЛА. Возбудителем ИЭ у инъекционных наркоманов в 71,3% является высоковирулентный золотистый стафилококк. Формирование недостаточности трехстворчатого клапана I—III степени стало самым распределенным осложнением ИЭ у наркоманов. При этом у большинства больных не наблюдается тяжелых нарушений центральной гемодинамики, приводящих к развитию острой недостаточности кровообращения.
Подострый ИЭ у больных с предрасполагающими заболеваниями сердца, а также у лиц пожилого и старческого возраста протекает с преимущественным поражением левых камер сердца, причем в старшей возрастной группе преобладает моноклапанное поражение. Наличие сопутствующей патологии у лиц старше 60 лет маскирует течение основного заболевания, чем и обусловлены поздняя диагностика и высокая смертность больных. Для затяжного течения ИЭ характерна низкая высеваемость возбудителя, по сравнению с острыми формами заболевания. Развитие тромбоэмболий сосудов большого круга кровообращения является характерной клинической особенностью подострого ИЭ.
Положительный эффект от проводимой консервативной терапии наблюдается у большинства больных ИЭ с поражением ТК, тогда как при подостром эндокардите левых камер сердца консервативная терапия является малоэффективной у большинства больных.
Госпитальная летальность в обеих группах больных обусловлена диссеминацией возбудителя с формированием гнойных очагов и полиорганной недостаточностью, а также развитием острой недостаточности кровообращения и вторичной нефропатии.
Литература
- Буткевич О. М., Виноградова Т. Л. Инфекционный эндокардит. — М., 1997.
- Симоненко В. Б., Колесников С. А. Инфекционный эндокардит: современное течение, диагностика, принципы лечения и профилактики. — Клин. мед., 1999. — 3. — С. 44-49.
- Тазина С. Я., Гуревич М. А. Современный инфекционный эндокардит. — Клин. мед.,1999. — 12. — С. 19-23.
- Bansal R. C. Infective endocarditis. Med Clin North America 1995; 79 (5): 1205-1239.
- Bayer A. S., Bolger A. F., Taubert K. A. et al. Diagnosis and management of infective endocarditis and its complications. Circulation 1998; 98: 2936-2948.
- McKinsey D. S., Ratts T. E., Bisno A. I. Underlying cardiac lesions in adults with infective endocarditis. The changing spectrum. Amer J Med 1987; 82: 681-688.
- Lamas C. C. Eykyn S. J. Suggested modifications to the Duke criteria for the clinical diagnosis of native valve and prosthetic valve endocarditis: analysis of 118 pathologically proven cases. Clin Infect Dis 1997; 25: 713-719.
- Durack D. T., Lukes A. S., Bright D. K. et al. New criteria for diagnosis of Infective Endocarditis Utilization of Specific Echocardiographic Finding. Amer J Med 1994; 96: 200-209.
- Тюрин В. П., Дубинина С. В. Инфекционный эндокардит у лиц пожилого и старческого возраста. — Клин. мед., 2000. — 4. — С. 53-56.
В. И. Уланова В. И. Мазуров, доктор медицинских наук, профессор Медицинская академия последипломного образования, Санкт-Петербург