Что такое аорта
Аорта — самый большой сосуд в организме человека, который уносит кровь от сердца к органам и конечностям. Верхний отдел аорты проходит внутри грудной клетки, этот отдел называется грудной аортой. Нижняя часть находится в брюшной полости и называется брюшной аортой. Она доставляет кровь к нижней части тела. В нижней части живота брюшная аорта делится на два крупных сосуда — подвздошные артерии, которые несут кровь к нижним конечностям.
Стенка аорты состоит из трех слоев: внутренний (интима), средний (медиа), наружный (адвентиция).
Что мы узнали о венах и артериях
Вены и артерии тела человека являются основой сосудистой системы. Они имеют разную структуру, так как должны выполнять различные функции. Артерия несет в организме обогащенную кислородом кровь к органам прямо из сердца. Чтобы обеспечить движение крови, используются сокращения миокарда, поэтому движение становится интенсивным и может достигнуть скорости 25 см/сек.
В венах кровь движется непосредственно от самих органов к сердцу. Она бедна кислородом, но в ней много углекислого газа и прочих продуктов распада. Движение венозной происходит за счет строения сосуда. Именно поэтому скорость здесь на порядок ниже. Одновременно процент венозной крови составляет 64%, тогда как на артериальную приходится всего 14%.
Аневризма аорты брюшной полости
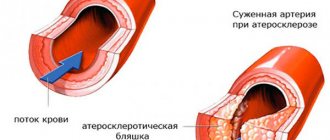
Аневризма брюшной аорты — это хроническое дегенеративное заболевание с угрожающими жизни осложнениями. Под аневризмой брюшной аорты понимают увеличение её диаметра более чем на 50% в сравнении с нормой или локальное выбухание её стенки. Под давлением крови, текущей через этот сосуд, расширение или выбухание аорты может прогрессировать. Диаметр нормальной аорты в брюшном отделе приблизительно равен 2 см. Однако в месте аневризмы аорта может быть расширена до 7 см. и более.
Чем опасна аневризма аорты
Аневризма аорты представляет большой риск для здоровья, так как она может разорваться. Разорванная аневризма может вызвать массивное внутреннее кровотечение, которое, в свою очередь, приводит к шоку или смертельному исходу.
Аневризма аорты брюшной полости может вызывать и другие серьезные проблемы для здоровья. В мешке аневризмы часто формируются сгустки крови (тромбы) или происходит отрыв частей аневризмы, которые с током крови продвигаются по ветвям аорты к внутренним органам и конечностям. Если один из кровеносных сосудов становится блокированным, это может вызывать выраженную боль и приводить к гибели органа или потери нижней конечности. К счастью, если диагностировать аневризму аорты на ранних стадиях, то лечение может быть своевременным, безопасным и эффективным.
Аорта и ее отделы. Ветви дуги аорты, их анатомия, топография, области ветвления (кровоснабжения)
Аорта, aorta — самый большой непарный артериальный сосуд большого круга кровообращения. Аорту подразделяют на три отдела: восходящую часть аорты, дугу аорты и нисходящую часть аорты, которая в свою очередь делится на грудную и брюшную части.
Восходящая часть аорты, pars ascendens aortae,
выходит из левого желудочка позади левого края грудины на уровне третьего межреберья; в начальном отделе она имеет расширение — луковицу аорты,
bulbus aortae
(25—30 мм в поперечнике).
В месте расположения клапана аорты на внутренней стороне аорты имеется три синуса, sinus aortae.
Каждый из них находится между соответствующей полулунной заслонкой и стенкой аорты. От начала восходящей части аорты отходят правая и левая венечные артерии.
Восходящая часть аорты лежит позади и отчасти справа от легочного ствола, поднимается вверх и на уровне соединения II правого реберного хряща с грудиной переходит в дугу аорты (здесь ее поперечник уменьшается до 21—22 мм).
Дуга аорты, arcus aortae,
поворачивает влево и назад от задней поверхности II реберного хряща к левой стороне тела IV грудного позвонка, где переходит в нисходящую часть аорты.
В этом месте имеется небольшое сужение — перешеек аорты, isthmus aortae.
К передней полуокружности аорты с правой и левой ее сторон подходят края соответствующих плевральных мешков.
К выпуклой стороне дуги аорты и к начальным участкам отходящих от нее крупных сосудов (плечеголовной ствол, левые общая сонная и подключичная артерии) прилежит спереди левая плечеголовая вена, а под дугой аорты начинается правая легочная артерия, внизу и чуть левее — бифуркация легочного ствола. Сзади дуги аорты находится бифуркация трахеи.
Между вогнутой полуокружностью дуги аорты и легочным стволом или началом левой легочной артерии имеется артериальная связка, tig.
arteriosum. В этом месте от дуги аорты отходят тонкие артерии к трахее и бронхам. От выпуклой полуокружности дуги аорты начинаются три крупные артерии: плечеголовной ствол, левая общая сонная и левая подключичная артерии.
Нисходящая часть аорты, pars descendens aortae,
— это наиболее длинный отдел аорты, проходящий от уровня IV грудного позвонка до IV поясничного, где она делится на правую и левую общие подвздошные артерии; это место называется бифуркацией аорты,
bifurcdtio aortae.
Нисходящую часть аорты в свою очередь подразделяют на грудную и брюшную части.
Грудная часть аорты, pars thordcica aortae,
находится в грудной полости в заднем средостении.
Верхний участок ее расположен впереди и слева от пищевода. Затем на уровне VIII—IX грудных позвонков аорта огибает пищевод слева и уходит на его заднюю поверхность. Справа от грудной части аорты располагаются непарная вена и грудной проток, слева к ней прилежит париетальная плевра, у места перехода ее в задний отдел левой медиастинальной плевры. В грудной полости грудная часть аорты отдает парные париетальные ветви; задние межреберные артерии, а также висцеральные ветви к органам заднего средостения.
Брюшная часть аорты, pars abdomindlis aortae,
являясь продолжением грудной части аорты, начинается на уровне XII грудного позвонка, проходит через аортальное отверстие диафрагмы и продолжается до уровня середины тела IV поясничного позвонка.
Брюшная часть аорты располагается на передней поверхности тел поясничных позвонков, левее срединной линии; лежит забрюшинно. Справа от брюшной части аорты находятся нижняя полая вена, кпереди — поджелудочная железа, горизонтальная (нижняя) часть двенадцатиперстной кишки и корень брыжейки тонкой кишки. Брюшная часть аорты отдает парные париетальные ветви к диафрагме и к стенкам брюшной полости, а сама непосредственно продолжается в тонкую срединную крестцовую артерию.
Висцеральными ветвями брюшной части аорты являются чревный ствол, верхняя и нижняя брыжеечные артерии (непарные ветви) и парные — почечные, средние надпочечниковые и яичковые (яичниковые) артерии.
Ветви дуги аорты
Плечеголовной ствол, truncus brachlocephdlicus,
отходит от дуги аорты на уровне II правого реберного хряща.
Впереди него находится правая плечеголовная’вена, сзади — трахея. Направляясь кверху и вправо, плечеголовной ствол не отдает никаких ветвей и лишь на уровне правого грудино-ключичного сустава делится на две конечные ветви — правую общую сонную и правую подключичную артерии.
Правая общая сонная артерия, a.
carotis communis dextra, является ветвью плечеголовного ствола, а левая общая сонная артерия,
a. carotis communis sinistra,
отходит непосредственно от дуги аорты.
Левая общая сонная артерия обычно длиннее правой на 20—25 мм. Общая сонная артерия лежит позади грудино-ключично-сосцевидной и ло-паточно-подъязычной мышц, следует вертикально вверх впереди поперечных отростков шейных позвонков, не отдавая по пути ветвей.
Кнаружи от общей сонной артерии располагаются внутренняя яремная вена и блуждающий нерв, кнутри — вначале трахея и пищевод, а выше — гортань, глотка, щитовидная и околощитовидные железы.
На уровне верхнего края щитовидного хряща каждая общая сонная артерия делится на наружную и внутреннюю сонные артерии, имеющие примерно одинаковый диаметр. Это место называется бифуркацией общей сонной артерии. Небольшое расширение у начала наружной сонной артерии — сонный синус, sinus caroticus.
В области бифуркации общей сонной артерии располагается небольшое тело длиной 2,5 мм и толщиной 1,5 мм — сонный гломус,
glomus caroticum
(каротидная железа, межсонный клубочек), содержащий густую капиллярную сеть и много нервных окончаний (хеморецепторов).
Наружная сонная артерия, a.
carotis externa, является одной из двух конечных ветвей общей сонной артерии. Она отделяется от общей сонной артерии в пределах сонного треугольника на уровне верхнего края щитовидного хряща. Вначале она расположена медиальнее внутренней сонной артерии, а затем — латеральнее ее. Начальная часть наружной сонной артерии снаружи покрыта грудино-ключично-сосцевидной мышцей, а в области сонного треугольника — поверхностной пластинкой шейной фасции и подкожной мышцей шеи.
Находясь кнутри от шило-подъязычной мышцы и заднего брюшка двубрюшной мышцы, наружная сонная артерия на уровне шейки нижней челюсти (в толще околоушной железы) делится на свои конечные ветви — поверхностную височную и верхнечелюстную артерии. На своем пути наружная сонная артерия отдает ряд ветвей, которые отходят от нее по нескольким направлениям.
Переднюю группу ветвей составляют верхняя щитовидная, язычная и лицевая артерии. В состав задней группы входят грудино-ключично-сосце-видная, затылочная и задняя ушная артерии.
Медиально направляется восходящая глоточная артерия.
Передние ветви наружной сонной артерии
Верхняя щитовидная артерия,а. thyreoidea superior,
Язычная артерия,a. lingualis,
Лицевая артерия,a. facidlis,
Задние ветви наружной сонной артерии:
1. Затылочная артерия,a.
occipitdlis
2. Задняя ушная артерия,a. auriculdris posterior
Медиальная ветвь наружной сонной артерии — восходящая глоточная артерия, a.
pharyngea ascendens. Это относительно тонкий сосуд, отходит от внутренней полуокружности наружной сонной артерии у ее начала, поднимается вверх к боковой стенке глотки.
От восходящей глоточной артерии отходят: 1) глоточные ветви, rr. pharyngedles,
к мышцам глотки и к глубоким мышцам шеи; 2)
задняя менингеальная артерия, a. meningea posterior,
следует в полость черепа через яремное отверстие; 3)
нижняя барабанная артерир, a.
tympdnica inferior, через нижнее отверстие барабанногскканальца проникает в барабанную полость.
Конечные ветви наружной сонной артерии
Поверхностная височная артерия,a. tempordlis superficid-lis,
Верхнечелюстная артерия,a. maxilldris,
Виды аневризм аорты
Выделяют «истинную» и «ложную» аневризмы аорты. Истинная аневризма развивается вследствие постепенного ослабления всех слоев стенки аорты. Ложная аневризма, как правило, является результатом травмы. Она формируется из соединительной ткани, окружающей аорту. Полость ложной аневризмы заполняется кровью через возникшую в стенке аорты трещину. Сами стенки аорты в формировании аневризмы не участвуют.
В зависимости от формы выделяют:
- мешотчатую аневризму — расширение полости аорты только с одной стороны;
- веретенообразную (фузиформную) аневризму — расширение полости аневризмы со всех сторон;
- смешанную аневризму — сочетание мешотчатой и веретенообразной форм.
Значимость артерий для организма человека
Кровеносная система тела состоит:
- сердца;
- артерий;
- вен.
Также сюда входят кроветворные и кровеносные сосуды. По артериям течет артериальная кровь, являющаяся соединительной тканью и имеющая важное значение для кровообращения. Она проходит через сердце, будучи обогащенной кислородом. Аорта, являясь самой большой артерией тела человека, питается кровью, которая перекачивается сердцем. Диаметр аорты составляет 2,5 см. Характерной особенностью этого сосуда являются прочные стенки, способные выдержать давление, обеспечиваемое сокращением сердца.
Исключительными артериями, не несущими артериальную кровь, являются артерии легочного ствола. В данном случае кровообращение позволяет обогатить жидкость кислородом.
В системе кровообращения выделяют два круга: малый и большой. Первый необходим для снабжения кровью легких. Поступая из правого желудочка, жидкость проходит к легочным капиллярам, после чего насыщается кислородом и отправляется в левое предсердие. Артериальная кровь следует по большому кругу и отправляется в левый желудочек, после чего следует к аорте. В теле человека также есть артериолы — маленькие сосуды, позволяющие транспортировать жидкость по всему организму. Через вены эта кровь поступает в правое предсердие.
Причины и факторы риска развития аневризмы брюшной аорты
Причины развития аневризм брюшной аорты весьма разнообразны. Самой частой причиной развития аневризмы является атеросклероз. На долю атеросклеротических аневризм приходится 96% от общего числа всех аневризм. Помимо этого заболевание может быть как врожденными (фибромускулярная дисплазия, кистозный медионекроз Эрдгейма, синдром Марфана и др.), так и приобретенным (воспалительные и невоспалительные). Воспаление аорты возникает при внедрении различных микроорганизмов (сифилис, туберкулез, сальмонеллёз и пр.) или как результат аллергическо-воспалительного процесса (неспецифический аортоартериит). Невоспалительные аневризмы наиболее часто развиваются при атеросклеротическом поражении аорты. Реже являются результатом травмы её стенки.
Факторы риска развития аневризмы
- Артериальная гипертензия;
- Курение;
- Наличие аневризм у других членов семьи. Что свидетельствует о роли наследственного фактора в развитии этого заболевания;
- Пол: мужчины в возрасте старше 60 лет (у женщин аневризмы брюшного отдела аорты возникают реже).
Причины расширения аорты
Врожденные системные заболевания соединительной ткани: синдром Марфана, Элерса – Данлоса, вызванные генетическими изменениями, при которых стенка аорты имеет неправильное строение, способны стать причиной развития аневризмы.
Приобретенные заболевания, вызывающие аневризматическое изменение стенки аорты: чаще всего это — атеросклероз. Около 80% всех осложненных аневризм аорты — аневризмы, вызванные атеросклеротическим процессом, который приводит к ослаблению стенки сосуда, и невозможности выдерживать нормальное кровеносное давление, а как следствие — к расширению её.
Реже аневризма аорты развивается при воспалительных заболеваниях, вызванных внешними агентами (сифилис, грибковая инфекция, туберкулез) или при аутоиммунных заболеваниях (неспецифический аортоартериит).
Симптомы и признаки аневризмы брюшной аорты
У большинства пациентов аневризмы брюшной аорты протекают без каких-либо проявлений и являются случайной находкой при обследованиях и операциях по другому поводу.
При развитии признаков аневризмы пациент испытывает один или несколько указанных ниже симптомов:
- Ощущение пульсации в животе, подобной сердцебиению, неприятное ощущение тяжести или распирания.
- Тупая, ноющая боль в животе, в области пупка, чаще слева.
Важное значение имеют косвенные признаки аневризмы брюшной аорты:
- Абдоминальный синдром. Проявляется появлением отрыжки, рвоты, неустойчивого стула или запоров, отсутствием аппетита и похуданием;
- Ишиорадикулярный синдром. Проявляется болями в пояснице, нарушениями чувствительности и расстройствами движений в нижних конечностях;
- Синдром хронической ишемии нижних конечностей. Проявляется в появлении боли в мышцах нижних конечностей при ходьбе, иногда в покое, похолодания кожи нижних конечностей;
- Урологический синдром. Проявляется болями и тяжести в пояснице, нарушением мочеиспускания, появлением крови в моче.
Предвестниками разрыва может быть усиление болей в животе.
При разрыве аневризмы, пациент внезапно ощущает усиление или появлении боли в животе, иногда «отдающую» в поясницу, паховую область и промежность, а также выраженную слабость, головокружение. Это симптомы массивного внутреннего кровотечения. Развитие такой ситуации опасно для жизни! Пациенту нужна экстренная медицинская помощь!
Диагностика аневризм брюшной аорты
Наиболее часто аневризмы брюшной аорты выявляют при ультразвуковом исследовании органов брюшной полости. Как правило, обнаружение аневризмы является случайной находкой. Если врач подозревает у пациента аневризму аорты для уточнения диагноза используются современные методы диагностики.
Методы диагностики аневризмы брюшной аорты
- Компьютерная томография в ангиорежиме;
- Магнитно-резонансная томография в ангиорежиме;
- Рентгенконтрастная аорто- и ангиография;
- Ультразвуковое дуплексное или триплексное ангиосканирование брюшной аорты.
При необходимости исследуется брюшной и грудной отдел аорты.
Методы лечения аневризмы аорты
Существует несколько методик лечения аневризмы аорты. Важно знать преимущества и недостатки каждой из этих методик. Подходы к лечению аневризм брюшного отдела аорты:
Наблюдение за пациентом в динамике
При размере аневризмы менее 4,5 см. в диаметре пациенту рекомендовано наблюдение сосудистого хирурга, т. к. риск операции превышает риск разрыва аневризмы аорты. Таким пациентам должны проводится повторные ультразвуковые исследования и/или компьютерная томография не реже 1 раза в 6 месяцев.
При диаметре аневризмы более 5 см. хирургическое вмешательство становится предпочтительным, так как с увеличением размеров аневризмы повышается риск разрыва аневризмы.
Если размер аневризмы увеличивается более чем на 1 см. в год, риск разрыва возрастает и хирургическое лечение также становиться предпочтительным.
Открытое хирургическое вмешательство: резекция аневризмы и протезирование аорты
Хирургическое лечение направлено на профилактику жизнеугрожающих осложнений. Риск хирургического вмешательства связан с возможными осложнениями, которые включают инфаркт, инсульт, потерю конечности, острую ишемию кишечника, сексуальную дисфункцию у мужчин, эмболизацию, инфекцию протеза и почечную недостаточность.
Операция выполняется под общим наркозом. Суть операции в удалении аневризматического расширения и замещение его синтетическим протезом. Средний показатель смертности при открытых вмешательствах составляет 3-5 %. Однако, может быть выше при вовлечении в аневризму почечных и/или подвздошных артерий, а также в силу имеющейся у пациента сопутствующей патологии. Наблюдение в послеоперационном периоде осуществляется один раз в год. Отдаленные результаты лечения хорошие.
Эндоваскулярное протезирование аневризма аорты: установка стент-графта
Эндопротезирование аневризмы аорты является современной альтернативой открытому вмешательству. Операция выполняется под спинальной или местной анестезией через небольшие разрезы/проколы в паховых областях. Через вышеуказанные доступы в бедренную артерию под контролем рентгена вводятся катетеры. По которым, в дальнейшем, будет подводится эндопротез к аневризматическому расширению. Эндопротез или стент-графт брюшной аорты представляет собой сетчатый каркас, выполненный из специального сплава и обернутый синтетическим материалом. Последним этапом операции является установка стент-графта в место аневризматического расширения аорты.
В конечном счете аневризма «выключается» из кровотока и риск ее разрыва становится маловероятным. После эндопротезирования аорты пациент наблюдается в стационаре 2-4 дня и выписывается.
Эта методика позволяет снизить частоту ранних осложнений, сократить сроки пребывания пациентов в стационаре и уменьшить показатель смертности до 1-2%. Наблюдение в послеоперационном периоде осуществляется каждые 4-6 месяцев с использованием ультразвуковых методик, КТ-ангиографии, рентгенконтратной ангиографии. Эндоваскулярный метод лечения, безусловно, менее травматичный. Ежегодно, только в США, проводится около 40 000 подобных операций.
Таким образом, выбор методики лечения аневризмы брюшного аорты основывается на индивидуальных особенностях пациента.
Коарктация аорты у плода. Точность и ошибки диагностики
Журнал «SonoAce Ultrasound»
Содержит актуальную клиническую информацию по ультрасонографии и ориентирован на врачей ультразвуковой диагностики, выходит с 1996 года.
Большинство врожденных пороков сердца (ВПС) относятся к заболеваниям, ставящим под угрозу здоровье или жизнь новорожденного. Опыт российских и зарубежных коллег показывает, что частота врожденных пороков сердца колеблется от 10 до 13 случаев на 1000 новорожденных, из них 4:1000 составляют сложные ВПС. В нашей стране средняя частота ВПС колеблется от 8-9 до 11-13 случаев на 1000 живорожденных. От сердечной патологии в раннем младенчестве погибает до 50% новорожденных.
Распределение диагностики ВПС в зависимости от нозологической формы значительно варьирует. Определенные ВПС пренатальная диагностика позволяет выявить в 90% случаев. Цифры статистики неумолимо показывают низкий процент выявления ВПС (30%) по результатам скринингового исследования. В специализированных учреждениях частота выявления ВПС выше и достигает 54% [1, 2].
Точность ультразвуковой диагностики патологии плода за последние годы многократно подвергается критике со стороны акушеров-гинекологов и в большей степени педиатров. Порой клинические признаки интересуют специалистов значительно меньше, чем данные ультразвукового антенатального исследования плода.
В этой работе представлен анализ возможностей ультразвукового пренатального исследования при коарктации аорты. В работе учтены данные, имеющиеся в публикациях отечественных и зарубежных авторов, а также материал отделения функциональной диагностики Центра.
Латинский термин «сoarctatius» означает «суженный, стиснутый». Впервые его описал J.F. Meckel в 1750 году. Коарктация аорты — это патологическое сужение ее просвета, которое может возникнуть в любом месте по всей ее длине. Частота порока составляет 6,3%, по данным клинических наблюдений из выборки в 2000 случаев [3], и 8,4% по результатам патологоанатомического материала [4].
У детей первого года жизни коарктация аорты занимает четвертое место cреди ВПС. Как правило, она развивается дистальнее места ответвления левой подключичной артерии вблизи артериального протока (ductus arteriosus). В зависимости от локализации сужения аорты относительно артериального протока различают два классических типа коарктации: предуктальную и постдуктальную [5].
При наличии сужения аорты клиническая картина может нарастать как шквал после закрытия артериального протока. В течение первого года погибают 56% пациентов. В основном смертельный исход бывает вызван сочетанием коарктации с другими аномалиями сердца. Изолированная форма в первые недели и дни жизни также характеризуется высоким процентом смертности (34%). Если этот период дети переживают, то продолжительность жизни в среднем составляет 30-50 лет. Причиной смерти у новорожденных является сердечно-легочная недостаточность. При артериальной высокой гипертензии, как исключение, может быть кровоизлияние в мозг.
В ФГБУ «Научный центр акушерства, гинекологии и перинатологии им. В.И. Кулакова » Минсоцразвития РФ за двухлетний период (2010-2011) родились 27 детей с аномалиями аорты, от незначительного сужения до полного перерыва. В 15 наблюдениях в отделении функциональной диагностики диагноз был поставлен антенатально. Это были беременные, обратившиеся в поздние сроки от 35 до 39 нед гестации. Во всех наблюдениях патология аорты сочеталась с гипоплазией левого желудочка. Диагноз был подтвержден во всех случаях. В изолированном виде коарктация аорты за этот период была диагностирована в 6 наблюдениях. В 3 из них диагноз был поставлен антенатально, в 2 — сужение было выявлено у новорожденных на 3-5-е сутки после закрытия артериального протока. В одном случае после рождения был поставлен диагноз кинкинг аорты. Таким образом, наши данные свидетельствуют о сложности и невысоком проценте выявления изолированной коарктации аорты. Лишь в тех наблюдениях, когда имеются выраженные гемодинамические нарушения, приводящие к значительным анатомическим изменениям в виде гипоплазии левого желудочка, диспропорции желудочков сердца, увеличения диаметра легочной артерии диагноз с большой достоверностью может быть поставлен антенатально.
Первые работы по диагностике коарктации аорты у плода относятся к 1984 г. [6, 7]. По данным литературы, трансвагинальный доступ в 12-15 нед гестации позволяет диагностировать коарктацию аорты в 21,4% случаев [1]. При трансабдоминальном доступе частота выявления коарктации аорты увеличивается: в 16-30 нед она составляет 43%, после 30 нед, по мере прогрессирования гемодинамических нарушений, не превышает 54% [8].
Согласно результатам скринингового ультразвукового обследования 20 248 плодов при сроках 19-22 нед беременности в крупном регионе Германии (1990-1994) пренатальный диагноз коарктации аорты не был установлен ни в одном из 7 случаев. Аналогичные данные были получены в Норвегии, даже в специализированном центре пренатальной диагностики. Согласно данным мультицентрового анализа, проведенного в 12 европейских странах, точный пренатальный диагноз изолированной коарктации аорты в конце 90-х гг. был установлен только в 9 (15,8%) из 57 случаев [9]. Средний срок обнаружения изолированной коарктации составил 22 нед, при этом 7 из 9 случаев было выявлено до 24 нед. При сочетании коарктации аорты с экстракардиальными пороками и хромосомными аномалиями точность ее пренатальной диагностики была существенно выше за счет выраженности гемодинамических нарушений и расширенного эхокардиографического исследования плода и составила 52%.
По данным института сердечно-сосудистой хирургии им. А.Н. Бакулева, точность диагностики не превышает 27%. Как правило, патология наиболее часто отмечается при сочетании коарктации аорты с другими кардиальными аномалиями [10].
Таким образом, обобщая статистические данные материала Центра, публикации ведущих специалистов России и зарубежных коллег, можно отметить очень низкий процент диагностики коарктации аорты у плода.
В чем же причина столь низкого процента выявления коарктации аорты антенатально?
Существует несколько факторов, затрудняющих диагностику коарктации аорты антенатально.
Первая причина не диагностированной коарктации аорты это морфогенез патологии и теория первичного нарушения развития дуги аорты. Теория была предложена в 1828 г. [11]. Автор считает, что данная патология связана с недостаточным соединением 4 и 6 дуги аорты с нисходящим ее отделом. Поэтому перешеек — это место, где наиболее часто локализуется участок сужения [12], так как оба отдела образуются из разных эмбриональных зачатков. В норме область перешейка аорты равна 2/3 диаметра восходящего отдела аорты (рис. 1).
энергетического допплера, норма)»/>
Рис. 1.
Восходящий отдел, дуга и нисходящий отдел аорты плода в режиме энергетического допплера в норме.
Согласно «теории дуктальной ткани» коарктация аорты возникает в результате миграции гладких мышечных клеток протока в предуктальную аорту, с последующей констрикцией и сужением просвета аорты [4]. При формировании коарктации аорты в области перешейка сохраняется сужение различной протяженности и формы (рис. 2, 3). Наиболее часто это проявляется в виде локальной перетяжки, выше или ниже которой диаметр аорты сохраняется в норме.
Рис. 2.
Ультразвуковое исследование восходящего отдела, дуги и нисходящего отдела аорты. Стрелкой указано место сужения.
Рис. 3.
Трехмерное изображение сердца и аорты плода в 16 нед беременности. Стрелкой указано место сужения аорты. AO DESC — нисходящий отдел аорты, COR — сердце.
Следовательно, оценка сужения аорты в типичном месте как признак развивающейся патологии не всегда представляется возможной в ранние сроки беременности. Поскольку речь идет о предуктальной коарктации аорты (сужение аорты локализовано проксимальнее протока), то, очевидно, что в период внутриутробной жизни в более поздние сроки отмечается снижение кровотока через левые отделы сердца и перешеек аорты и развивается гипоплазия левого желудочка и аорты. Это и способствует более позднему проявлению патологии и возможности ее ультразвуковой диагностики.
Вторая причина, затрудняющая диагностику коарктации аорты — это теория постнатального развития. У плода перешеек аорты узкий и после рождения и закрытия артериального протока он должен в норме расшириться для обеспечения адекватного кровотока в нисходящий отдел аорты. Таким образом, имеющееся физиологическое сужение перешейка аорты не позволяет предположить формирование коарктации аорты после рождения.
Постдуктальная коарктация развивается уже после рождения и практически всегда представляет собой изолированный дефект. Эта аномалия, вероятнее всего, является результатом разрастания мышечной ткани артериального протока в аорту плода. Когда же проток после рождения сужается, эктопическая ткань внутри аорты также сжимается, перекрывая, как тампоном, просвет сосуда по всей его окружности. В отличие от предуктальной коарктации в данном случае гипоплазия аорты не развивается. Закрытие артериального протока у некоторых детей приводит к наличию сужения аорты и развитию коарктации через 2-3 нед после рождения [13].
Третья причина не диагностированной коарктации аорты состоит в особенностях внутрисердечной гемодинамики у плода. Кровообращение плода, так же, как и взрослого, подчиняется ряду основных закономерностей физического и биологического воздействия. Поток крови движется из зоны высокого давления в область низкого давления. При выраженном потоке размеры увеличиваются, при уменьшении объема потока уменьшаются. Так, гипоплазия левого желудочка и коарктация аорты часто сопутствуют порокам со сниженным выбросом крови в аорту (стеноз аорты, дефект межжелудочковой перегородки) и практически не встречаются при пороках с большим объемом потока через аорту (при тетраде Фалло).
Исходя из особенностей внутрисердечной гемодинамики плода, для диагностики коарктации аорты были предложены косвенные признаки патологии в антенатальном периоде: дилатация правого желудочка и его гипертрофия (см. рис. 3), дилатация легочной артерии [6, 7, 14]. Авторы считают, что это достоверные признаки и встречаются они достаточно часто (в 18 из 24 случаев верифицированных диагнозов коарктации аорты). Поэтому была предложена оценка индексов отношения полости правого желудочка к левому (в норме — 1,1) и легочной артерии к аорте (у здоровых — 1,2). Исходя из увеличения этих параметров, можно предположить наличие затрудненного выброса в аорту или гипоплазию дуги аорты. Тем не менее, по данным предложивших эти косвенные признаки авторов, такие изменения выявляются только в 30% наблюдений (рис. 4).
Рис. 4.
Диспропорция размеров желудочков сердца при коарктации аорты. RV — правый желудочек; LV — левый желудочек; AO DESC — поперечное сечение нисходящего отдела аорты.
Во второй половине 90-х гг. было опубликовано несколько работ, посвященных изучению диагностической ценности увеличения правого желудочка и уменьшения левого желудочка при коарктации аорты. Авторы, опубликовавшие эти результаты [2], считают, что чем раньше проводится исследование (от 14-16 до 25 нед гестации), тем оно информативнее для диагностики коарктации аорты. Доказательством могут служить данные, полученные D. Brown и соавт. [15]. В представленных исследованиях коарктация аорты отмечена у 8 (62%) из 13 плодов с диспропорцией размеров желудочков до 34 нед и только у 6 (21%) из 29 плодов после 34 нед беременности. Несмотря на то, что более половины случаев коарктации аорты сопровождается диспропорцией размеров желудочков, что достаточно легко выявляется при изучении четырехкамерного среза сердца плода, во многих исследованиях в Норвегии она не была диагностирована, даже при обязательном скрининговом изучении размеров сердца до 18 нед беременности [9].
Такие прoтиворечивые результаты можно объяснить гемодинамической теорией [16, 17]. Внутриутробно в восходящий отдел аорты поступает 50% суммарного выброса крови, в нисходящую — 65%, а через перешеек аорты всего лишь 25%. Исходя из уменьшенного объема кровотока возникает его физиологическое сужение, которое усугубляется лишь после рождения.
Допплеркардиография, позволяющая оценить кровоток, информативна лишь при выраженном сужении аорты [18]. При этом возникает обратная зависимость максимальной скорости кровотока в восходящем и нисходящем отделах аорты. В норме скорость в восходящем отделе немного преобладает над скоростью нисходящего отдела.
При перерыве дуги аорты отмечается ретроградный кровоток заполнения участка дуги аорты после перерыва через открытый артериальный проток и отсутствие прямого кровотока на уровне перерыва.
И, наконец, последняя причина не диагностированной коарктации аорты заключается в частоте сочетания с другими аномалиями сердца. Изолированная коарктация аорты составляет всего лишь 15-18%. По данным M. Campell и P. Polani [19], процент сочетания коарктации аорты с кардиальными аномалиями колеблется от 13 до 18%. Наиболее часто (85%) коарктация аорты сочетается с двустворчатым аортальным клапаном [20], нередко сочетается с фиброэластозом эндомиокарда, распространяющимся на выходной тракт левого желудочка и на межжелудочковую перегородку. Возможно, при коарктации аорты аномальное отхождение правой подключичной артерии или обеих подключичных артерий от нисходящей аорты, дистальней коарктации (5%).
Наличие сопутствующей кардиальной патологии может нивелировать типичные для коарктации гемодинамические изменения со стороны сердца плода, на которые обязательно обращает внимание специалист при ультразвуковом исследовании.
Существует еще и понятие как псевдокоарктация, или «кинкинг» аорты — деформация аорты, аналогичная классической коарктации, но препятствие кровотоку незначительное, так как имеется простое удлинение и извилистость аорты (рис. 5).
Рис. 5.
Кинкинг аорты у плода в 34 нед беременности. Исследование в энергетическом режиме.
Итак, становится очевидным, что практически ни один из ультразвуковых признаков в антенатальном периоде не имеет высокой степени диагностической точности.
Известно, что диагноз данного порока сердца опирается на прямой признак — визуализацию места сужения аорты, и, возможно, расширение проксимального отдела аорты. Однако четко визуализировать участок сужения аорты у плода достаточно трудно и удается только в единичных наблюдениях. Порок можно увидеть лишь тогда, когда имеется уменьшение диаметра перешейка аорты более чем на 1/3 по сравнению с нормой для каждого срока беременности (см. рис. 2, 3).
Ключом к пренатальной диагностике коарктации аорты является комплексный учет данных, получаемых как при изучении четырехкамерного среза сердца (дилатация правого желудочка, гипоплазия левого желудочка), так и при оценке самих главных артерий. При наличии коарктации диаметр аорты в среднем в 2 раза меньше диаметра дилатированной легочной артерии. Поэтому для диагностики коарктации аорты следует использовать визуализацию самой аорты, что наиболее целесообразно при скрининговой оценке среза через три сосуда. Помощь в диагностике может оказать измерение диаметра артериального протока, который при коарктации аорты широкий.
Окончательный диагноз коарктации аорты устанавливается при использовании среза через дугу аорты, так как чаще всего сужение аорты отмечается в области ее перешейка — на уровне впадения артериального протока. Следует отметить, что сужение может охватывать большой участок аорты вплоть до тубулярной гипоплазии. Нормальный переход дуги аорты в артериальный проток в норме гладкий и плавный. Кроме того, при исследовании аорты по длинной оси наиболее надежным признаком следует считать гипоплазию поперечной части дуги аорты. Как один из косвенных признаков коарктации аорты можно использовать извилистость дуги аорты при изучении ее по длинной оси [2].
Важное дополнительное значение имеет допплерэхокардиографическое исследование, которое при коарктации орты позволяет выявить ускорение и турбулентный характер кровотока в аорте. Однако в антенатальном периоде этот признак может не проявиться [2]. Более надежно выявление левоправого шунта через овальное окно. Предполагается, что этот шунт является компенсаторным механизмом, обеспечивающим уменьшение потока крови в левый желудочек и аорту. G. Sharland и соавт. [18] отметили левоправый шунт через овальное окно у 7 из 12 плодов с коарктацией аорты. У оставшихся 5 плодов обнаруживалось как левоправое, так и праволевое направления потоков крови через овальное окно.
В случаях резко выраженных анатомических изменений аорты и функции левого желудочка с увеличением постнагрузки может наблюдаться сердечная недостаточность [21]. Нарушения гемодинамики и сердечная недостаточность характеризуются антенатально наличием выпота в перикарде, уменьшением сердечного выброса с уменьшением размеров левого желудочка [22].
После рождения и закрытия артериального протока весь поток крови поступает в восходящий отдел аорты и перешеек расширяется до нормального уровня. После рождения, когда проток перекрывается, коарктация аорты приводит к серьезными клиническим проявлениям.
Итак, анализ возможностей и ошибок ультразвуковой диагностики коарктации аорты в пренатальном периоде показывает насколько проблематично поставить диагноз во всех случаях данного порока сердца у плода. К сожалению, все эхокардиографические антенатальные признаки патологии не обеспечивают высокий процент диагностики.
Хочется надеяться, что развитие новых технологий и накопление позитивного и анализ негативного опыта позволят в будущем повысить процент диагностики такого сложного порока сердца с высокой неонатальной смертностью.
Литература
- Bronshtein M., Zimmer E.Z. Sonographic diagnosis of fetal coarctation of aorta at 14-16 weeks of gestation // Ultrasound Obstetric Gynecologie. 1998. N 11. Р. 254-257.
- Allan L.D., Cook A.C., Huggon I.C. Fetal Echocardiographiy. A practical guide. Cambridge University Press. 2009. P. 258.
- Frederiksen T. Coarctation of the aorta. A genetic study // Acta genet.1963. V. 13. Р. 263.
- Банкл Г. Врожденные пороки сердца и крупных сосудов. М.: Медицина, 1980.
- Oztunc F., Eroglu A.G., Aksoy F. et al. Antenatal diagnosis of posductal coarctation of the aorta report // Turk journal Pediatr. 2001. V. 43. N 1. P. 67-69.
- Allan L.D., Crawford D.C., Tynan M. Evolution of coarctation of the aorta in intrauterine life // Br. Heart J. 1984. V. 52. P. 471.
- Allan L.D., Crawford D.C., Anderson R.H. et al. Echocardiography and anatomical correlations in fetal congenital heart disease // Br. Heart J. 1984. V. 52. P. 542.
- Franklin O., Burch M., Manning N. et al. Prenatal diagnosis of coarctation of the aorta improves survival and reduces morbility // Heart. 2002. V. 87. N 11. P. 67-69.
- Norbenger L.K., Sahn D.J., Kleimann C.S. et al. Antenatal diagnosis of coarctation of the aorta: a multicenter experience // J. Am. Coll. Cardiologie. 1994. V. 23. P. 417-423.
- Беспалова У.Д., Суратова О.Г., Тюменева А.И., Гасанова Р.М. Ультразвуковая диагностика врожденных пороков сердца у плода / Под ред. Бокерия Л.А. М., 2009.
- Rosenberg H. Coarctation of the aorta; Morphology and pathogenesis considerations. In: Perspectives in Pediatric Pathology. V. 1. Chicago, Year Book, 1974.
- Patten B.M. The changes in circulation after birth // Am. Heart J. 1930. V. 6. P. 192.
- Бураковский В.И., Бокерия Л.А. Сердечно-сосудистая хирургия. М.: Медицина, 1989.
- Allan L.D., Chita S.K, Anderson R.H, Fagg N., Crawford D.C., Tynan M.J. Coarctation of the aorta in prenatal life: and echocardiographic, anatomical and functional study // Brit. Heart J. 1988. V. 59. P. 356.
- Brown D.L., Durfee S.M., Hornberger L.K. Ventriculal disgrepancy as a sonographic sign of coarctation of the aorta: how reliable is it? // J. Ulytrasound Med. 1997. V. 16. N 2. P. 95-99.
- Rudolf A., Heyman M.A., Spitznas U. Hemodynamic consideratiоns in the developement of narrowing of the aorta // Am. J. Cardiolog. 1972. V. 30. P. 514.
- Palmer N.S., Berman M.A. Postnatal developement of obstruction in coarctation of the aorta; Role of the ductus arteriosus // Pediatrics. 1975. V. 56. P. 462.
- Sharland G.K., Chan K.Y., Allan L.D. Coarctation of the aorta:difficulties in prenatal diagnosis // Br. Heart J. 1994. V. 71. Р. 70-75.
- Campell M., Polani P.E. Etiology of coarctation of the aorta // Lancet. 1961. V. 1. P. 473.
- Edwards J.E., Burchell H.B. The pathologic anatomy of deficiency betwen the aortic rood and the heart including aortic sinus aneuvrysms // Thorax 1957. V. 12. P. 125.
- Rudolph A.M. Congenital Diseases of the Heart: Clinical-Physiologic Considerations in Diagnosis and Management. Chicago-Year Book. 1974.
- Kleimman C.S., Donnerstein R.L., De Vore G.R. et al. Fetal echocardiography for evaluation of in utero congestive heart failure: A technique for study of nonimmune fetal hydrops. N. Engl. J. Med. 1982.
Журнал «SonoAce Ultrasound»
Содержит актуальную клиническую информацию по ультрасонографии и ориентирован на врачей ультразвуковой диагностики, выходит с 1996 года.