Сердечно-сосудистые болезни находятся по статистике ВОЗ в тройке лидеров среди различных причин смерти. Тромбы в сосудах являются одним из основных факторов развития ишемии сердечной мышцы, а также инфарктов и инсультов. То есть повышенная свертываемость крови провоцирует острые заболевания, которые приводят к тяжелым, часто необратимым осложнениям и гибели больного.
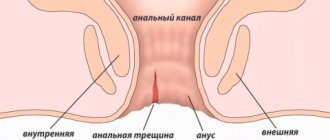
Причины нарушения свёртываемости крови
- Генетические. Иногда механизм свертывания крови имеет врожденные дефекты, обусловленные мутацией в генах. Некоторые мутации передаются по наследству и приводят к заболеваниям, например, гемофилии.
- Лекарственные. Прием препаратов, влияющих на свертывание крови (аспирин и другие нестероидные противовоспалительные препараты, антикоагулянты, фибринолитики).
- Соматические. Возникают на фоне других заболеваний (болезни крови, заболевания печени, дефицит витамина К, массивная кровопотеря и т.д.).
Большинство причин нарушений свертываемости крови требует немедленного лечения. Для их обнаружения сначала необходимо обязательно сделать общий анализ крови на свертываемость крови. Нарушения процессов свертывания могут проявляться двумя путями: повышенной и пониженной свертываемостью крови. Опасность повышенной свертываемости крови объясняется высоким риском образования тромбов в сосудах и ухудшением либо полным прекращением кровоснабжения ткани или органа. Пониженная свертываемость крови, которая бывает врожденной и приобретенной, представляет особую опасность при травмах и операциях.
Диагноз и прогноз
Кроме лабораторных исследований установить диагноз помогут анамнестические данные: склонность к длительным кровотечениям и тромботическим осложнениям у пациента и его родственников, а также положительный симптом Румпеля — Лееде (появление мелкоточечных кровоизлияний дистально от наложенного на плечо жгута). Прогноз при дефиците фактора Хагемана в большинстве случаев благоприятный, лечение не требуется. Коррекции это состояние требует только в связи с хирургическими вмешательствами. В качестве подготовки к операции может быть назначено переливание небольших доз свежезамороженной плазмы.
Период выведения донорского XII фактора — 48–56 ч. Также при наличии этой коагулопатии следует уделять большее внимание профилактике тромботических осложнений: профилактическая компрессия нижних конечностей, УЗИ-контроль состояния вен нижних конечностей и малого таза, особенно при длительном постельном режиме. В послеоперационном периоде для профилактики тромбозов необходимо назначение низкомолекулярных гепаринов, а для терапии кровотечений — отказ от применения ингибиторов фибринолиза, таких как аминокапроновая и транексамовая кислота.
Источники
- Пантелеев М. А., Атауллаханов Ф. И. Свертывание крови: биохимические основы // Клиническая онкогематология. 2008. № 1. URL: https://cyberleninka.ru/article/n/svertyvanie-krovi-biohimicheskie-osnovy
- Литвицкий П. Ф. Патология системы гемостаза // Вопросы современной педиатрии. 2014. № 2. URL: https://cyberleninka.ru/article/n/patologiya-sistemy-gemostaza
- Шулутко А. М., Крылов А. Ю., Просолов Н. В., Петровская А. А. Периоперационное ведение пациента с недостаточностью XII фактора (болезнь Хагемана) //Московский хирургический журнал. 2015. № 4 (44). URL: https://www.mossj.ru/journal/MOSSJ_2015/MXG_2015_04.pdf
Последствия повышенной свёртываемости крови
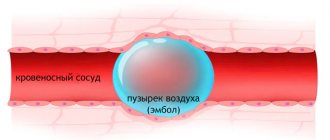
При таких условиях значительно повышен риск образования тромбов. Воспаление тромбированных вен приводит к тромбофлебиту, сопровождающемуся:
- болью;
- отеком;
- покраснением кожи над веной.
Тромбы в сосудах ведут к сужению их просвета и повреждению участков тканей из-за дефицита кровоснабжения. При полном прекращении тока крови по сосуду из-за тромба в ткани возникает участок, лишенный кровоснабжения, который называется очагом ишемии. В этом участке клетки быстро погибают и нормальная работа органа нарушается. Необратимые поражения мозга и сердца являются самыми опасными последствиями тромбоза. Еще одно коварное осложнение — отрыв тромба. Часто диаметр тромба бывает меньше диаметра сосуда, поэтому больной долгое время не подозревает о его наличии. Однако при травмах и сотрясениях тела, в начале приема лекарств, разжижающих кровь, а также при вставании на ноги после длительного нахождения в постели (например, после операций) тромб может оторваться и продолжить движение по кровотоку, пока не закупорит где-то просвет сосуда. Именно из-за таких тромбов развивается грозное и очень опасное осложнение — тромбоэмболия легочной артерии, которое может закончиться гибелью человека, если вовремя не оказать ему медицинскую помощь. Обнаружить их можно только проведением определенных исследований, включающих и общий анализ крови на свертываемость крови.
Основные анализы и их нормальные показатели
Определить способность крови к сворачиванию можно при помощи лабораторных тестов. Для их выполнения подходит, как капиллярная (из пальца), так и венозная кровь. Каждый из анализов требует определенного вида крови и позволит определить состояние отдельных звеньев системы гемостаза (свертывания). Названия и виды основных анализов и их нормы приведены в виде отдельной таблицы.
| Название анализа | Норма показателя | Какая кровь используется |
| Анализ на уровень тромбоцитов | У мужчин и женщин 150-400 г/л | Капиллярная (забор из пальца) |
| У детей 150-350 г/л | ||
| Время свертывания | Норма по Сухареву: начало – 30-120 сек; окончание – между 3 и 5 минутами; | Капиллярная |
| Норма по Ли-Уайту 5-10 минут | Из вены | |
| Длительность кровотечения по Дюке | Не должно превышать 4 минуты | Из пальца |
| Тромбиновое время (ТВ) | 12-20 секунд | Из вены |
| Протромбиновый индекс (ПТИ) | Капиллярной крови 93-107% | Анализ из пальца |
| Венозной крови 90-105% | Анализ из вены | |
| Активированное частичное тромбопластиновое время (АЧТВ) | Для всех возрастных групп, не зависимо от пола 35-50 секунд | Венозная |
| Фибриноген | Взрослые 2-4 г/л; у ребенка первых дней жизни 1,25-3,0 г/л | Из вены |
Тромбоциты – главные клетки крови, ответственные за ее свертываемость
В таблице приведены далеко не все возможные показатели свертывающей системы крови. Их существует очень много и все они входят в объем коагулограммы. Но диагностика проблем с коагуляцией всегда начинается из тех методов, которые описаны в рамках данной статьи. Все дополнительные и более специфичные анализы назначаются только при необходимости получения более детальной информации о системе гемостаза.
Важно помнить! Показатели свертываемости у женщин подвержены большим колебаниям. Их норма может быть значительно, но кратковременно снижена в период менструаций или повышена на фоне приема гормональных препаратов!
Последствия пониженной свёртываемости крови
При этом состоянии человек имеет повышенный риск кровотечения. Одно из распространенных последствий — желудочно-кишечное кровотечение на фоне имеющейся язвы. Кровопотеря при таких состояниях из-за длительности кровотечения может быть очень серьезной. При низкой свертываемости крови повышается риск внутренних кровотечений, которые часто бывают замечены слишком поздно. Поэтому необходимо проведение общего анализа крови на свертываемость крови перед любой операцией, а также на фоне лечения препаратами, обладающими эффектом разжижения крови (антикоагулянты, антиагреганты, фибринолитики и др.).
Как тромбоциты ускоряют свёртывание крови
Кирилл Стасевич, биолог
«Наука и жизнь» №10, 2016
Если посмотреть на каплю крови в микроскоп (пусть это будет световой микроскоп, но достаточно мощный), то можно увидеть клетки трёх типов: многочисленные эритроциты, или красные кровяные тельца, немногочисленные, но довольно крупные лейкоциты и мельчайшие тромбоциты, которые удаётся разглядеть с некоторым трудом. Эритроциты, плотно набитые белком гемоглобином, переносят кислород: гемоглобин связывает его в лёгких и отдаёт в тканях и органах, которые в нём нуждаются. Лейкоциты — клетки иммунной системы, и они вместе с иммунными белками защищают нас от инфекций и от некоторых неинфекционных заболеваний, например от рака. Лейкоцитов существует несколько типов, отличающихся в том числе и по численности; возможно, из лейкоцитов нам попадутся Т-лимфоциты, которые целенаправленно распознают и сами уничтожают как чужеродные, так и наши собственные клетки, которым не повезло заболеть. Наконец, тромбоциты. Про тромбоциты мы знаем, что они нужны для свёртывания крови.
Кто не представляет, как работает система свёртывания крови? Уколовши палец, мы наблюдаем, как он сначала кровоточит, а потом перестаёт — образовавшийся тромб остановил кровь. Если бы кровь не свёртывалась, то разбитый нос мог бы оказаться смертельным ранением. Но, наверно, едва ли не более важная функция механизма свёртывания — предотвращение внутренних кровотечений, которые часто случаются при различных заболеваниях (например, при тяжёлой инфекции или при злокачественной опухоли). При этом система свёртывания должна быть очень точно сбалансирована: если она будет работать плохо, то пойдут неостанавливаемые кровотечения, внутренние и наружные; если же механизм свёртывания будет слишком активным, начнут формироваться тромбы, грозящие закупоркой сосудов и остановкой кровоснабжения. В медицине есть масса примеров, когда процессы свёртывания крови и тромбообразования идут не так, как надо, и не там, где надо. Причиной тому могут быть либо другие болезни, и тогда нарушения системы свёртывания крови — это просто сопутствующий симптом, либо же сами эти нарушения представляют собой отдельные, самостоятельные заболевания (вроде небезызвестной гемофилии или болезни Виллебранда).
Бороться с аномалиями системы свёртывания можно по-разному, и сейчас есть медицинские средства, которые позволяют эффективно регулировать её работу. Но чтобы такие средства работали ещё лучше, чтобы сделать их ещё более совершенными, нужно как можно точнее знать, как на молекулярно-клеточном уровне устроен механизм свёртывания крови. Его изучают уже более ста лет, и сейчас его схему можно найти в любом школьном учебнике; правда, схему эту большинство из нас старается забыть, как страшный сон: ещё бы, около двух десятков белков, соединённых стрелками, — кто-то кого-то активирует, кто-то кого-то ингибирует. Однако если рассматривать свёртывание по этапам, то всё становится более или менее понятно.
Стоит сразу сказать, что собственно свёртывание — лишь часть более общего процесса гемостаза (от греч. haimatos
— кровь,
stasis
— остановка). И этот процесс начинается как раз с тромбоцитов. Они происходят от мегакариоцитов — гигантских клеток костного мозга. От зрелых мегакариоцитов «отшнуровываются» куски цитоплазмы, которые и становятся безъядерными клетками тромбоцитами (хотя, учитывая их происхождение и отсутствие ядра, более корректно называть их просто тельцами крови или кровяными пластинками). Тромбоциты циркулируют по крови, пока не «заметят» брешь в сосуде. Сигналом для них служит соединительнотканный белок коллаген. Он обычно спрятан внутри стенки сосуда, но при её повреждении оказывается лицом к лицу с тромбоцитами и другими белками крови. На мембране тромбоцитов есть специальный рецептор, который хватает коллаген и заставляет кровяные пластинки прилипнуть к месту повреждения. Тут в дело вступает один из факторов свёртывания под названием «фактор фон Виллебранда». Это гликопротеин (его молекула состоит из белковой и углеводной частей), который помогает другим рецепторам тромбоцитов зацепиться за торчащий из стенки сосуда коллаген. Благодаря фактору фон Виллебранда тромбоциты не только прочнее взаимодействуют с местом повреждения, но и дополнительно активируются — подают молекулярные сигналы другим тромбоцитам и белкам свёртывания, меняют внешнюю форму и активно слипаются друг с другом. В результате на стенке кровеносного сосуда появляется затычка из тромбоцитов.
Одновременно с формированием тромбоцитарной пробки происходит процесс собственно свёртывания крови — свёртывания в строгом смысле слова. В нём участвует множество белков плазмы крови, большинство из них — ферменты-протеазы, то есть белки, отщепляющие куски от других белков. Если до расщепления «жертва» протеазы была неактивным белком-ферментом, то после расщепления фермент активируется и, если он сам протеаза, тоже может кого-то расщепить. Суть ферментативных реакций, которые идут во время свёртывания, в том, что белки активируют друг друга, и в итоге всё заканчивается появлением активного белка фибрина, который быстро полимеризуется, превращаясь в нити — фибриллы. Из нитей фибрина формируется фибриновый сгусток, дополнительно укрепляющий тромбоцитовую «затычку», — образуется тромбоцитарно-фибриновый тромб. Когда сосуд восстанавливается, тромб рассасывается.
Оба этапа — и формирование тромбоцитарной пробки, и свёртывание крови с участием плазматических факторов-ферментов — подчиняются множеству регуляторов. Для организма важно, чтобы система гемостаза работала как можно более точно, и многостадийность как раз помогает выполнять тонкую настройку: на каждом этапе, на каждой реакции ферменты и другие молекулы, задействованные в процессе, проверяют, не ложный ли сигнал к ним пришёл и действительно ли есть необходимость в тромбе. Естественно, тромбоциты и факторы свёртывания теснейшим образом связаны друг с другом и тромбоциты нужны не только для того, чтобы первыми заткнуть брешь в сосуде. Во-первых, они также выделяют белки, которые ускоряют восстановление стенки сосуда. Во-вторых, что особенно важно, кровяные пластинки нужны ещё для того, чтобы ферменты свёртывания продолжали работать.
После запуска процесса гемостаза мембрана некоторых тромбоцитов изменяется особым образом, так что теперь на неё могут садиться ферменты реакций свёртывания: после приземления на такие тромбоциты они начинают работать намного быстрее. Что при этом происходит, удалось выяснить лишь относительно недавно. Активированные тромбоциты, то есть те, которые почувствовали повреждение сосуда, бывают двух форм: простые (агрегирующие) и сверхактивированные (прокоагулянтные). Простые агрегирующие тромбоциты отчасти похожи на амёбы: они образуют выпячивания мембраны, похожие на ножки, которые помогают им лучше сцепляться друг с другом, и становятся более плоскими, как бы растекаясь по поверхности. Такие клетки формируют основное тело тромба. Сверхактивированные тромбоциты ведут себя иначе: они приобретают сферическую форму и увеличиваются в несколько раз, становясь похожими на воздушные шарики. Они не просто укрепляют тромб, но и стимулируют реакцию свёртывания, почему их и называют прокоагулянтными.
Почувствовав, что стенка кровеносного сосуда повреждена, тромбоциты активируются. Обычные активированные тромбоциты (
слева
; фото со сканирующего электронного микроскопа) делаются плоскими и образуют, подобно амёбам, многочисленные выросты мембраны; сверхактивированные, или прокоагулянтные, тромбоциты (
справа
; фото с просвечивающего электронного микроскопа) превращаются в шар и становятся площадкой для сборки и активации ферментативных комплексов аппарата свёртывания крови. Фото Михаила Пантелеева, МГУ
Как одни тромбоциты становятся простыми, а другие — сверхактивированными? Известно, что в прокоагулянтных тромбоцитах очень высок уровень кальция (ионы кальция вообще один из главных регуляторов гемостаза) и что у них выходят из строя митохондрии. Связаны ли эти изменения в клеточной физиологии со сверхактивацией тромбоцитов?
В прошлом году Фазли Атауллаханов, директор Центра теоретических проблем физико-химической фармакологии РАН, вместе с Михаилом Пантелеевым, заведующим лабораторией молекулярных механизмов гемостаза центра и профессором кафедры медицинской физики физического факультета МГУ, опубликовали в журнале Molecular BioSystems
статью с описанием модели митохондриального некроза как особой формы клеточной смерти. Мы знаем, что клетка может погибнуть в результате апоптоза, включив программу самоуничтожения (при апоптозе всё происходит по плану и с минимальным беспокойством для клеток-соседей), или в результате некроза, когда гибель случается быстро и незапланированно, например из-за разрыва наружной мембраны или из-за масштабных внутренних неприятностей, вроде вирусной или бактериальной инфекции.
Поперечный срез через митохондрии клетки лёгкого. Митохондрии выглядят как цистерны, окружённые двойной мембраной; поперечные полосы на снимке — впячивания их внутренней мембраны, на которой сидят ферменты энергетического обмена веществ. Фото: Louisa Howard/Wikimedia Commons
В чём особенность митохондриального некроза? Митохондрии, как известно, служат источниками энергии для любой нашей клетки: в митохондриях происходит кислородное окисление «питательных» молекул, а освобождённая при этом энергия запасается в удобной для клетки форме. Побочным продуктом при работе с кислородом оказываются агрессивные кислородные радикалы, которые могут испортить любую биомолекулу. Сами митохондрии стараются уменьшать концентрацию радикалов и не выпускать их из себя в клеточную цитоплазму.
При митохондриальном некрозе происходит следующее: митохондрии вбирают в себя кальций, и в какой-то момент, когда кальция становится слишком много, они разрушаются, выплёскивая в цитоплазму и кальций, и активные формы кислорода. В результате в клетке распадается внутриклеточный белковый скелет и клетка сильно увеличивается в объёме, превращаясь в шар. (Как мы помним, шарообразная форма характерна для сверхактивированных тромбоцитов.) Кроме того, и ионы кальция, и активные формы кислорода активируют фермент скрамблазу, который перебрасывает фосфатидилсерин — один из липидов цитоплазматической мембраны — из внутреннего слоя мембраны в наружный. И вот на такую модифицированную мембрану округлившихся тромбоцитов, обогащённую фосфатидилсерином, прилипают некоторые важные факторы свёртывания: здесь они собираются в комплексы, активируются, и в результате реакция свёртывания ускоряется в 1000–10 000 раз.
В новой статье, опубликованной в июне этого года в Journal of Thrombosis and Haemostasis
, Михаил Пантелеев, Фазли Атауллаханов и их коллеги описывают эксперименты, которые полностью подтверждают такую модель активации тромбоцитов: кровяные пластинки стимулировали тромбином, одним из белков системы свёртывания, после чего митохондрии наполнялись ионами кальция, а в митохондриальных мембранах появлялись поры. Проницаемость митохондрий увеличивалась, и в какой-то момент, когда изменение проницаемости делалось необратимым, весь запасённый кальций оказывался в цитоплазме и запускал процесс «переформатирования» наружной мембраны.
Получается следующая картина: тромбоциты, подчиняясь внешним активаторам, впитывают кальций. Из их цитоплазмы кальций переходит в митохондрии. В самой цитоплазме уровень ионов кальция то повышается, то понижается (осциллирует), но в митохондриях он неуклонно растёт, и наступает момент, когда они уже не могут удерживать кальциевые ионы внутри себя. Весь кальций (с кислородными окислителями) выходит в цитоплазму и включает фермент, перебрасывающий липиды в цитоплазматической мембране тромбоцита. В результате на поверхности сверхактивированного и, очевидно, доживающего свои последние минуты тромбоцита собираются ферментативные комплексы, ускоряющие реакцию свёртывания.
Почему же не все тромбоциты становятся сверхактивированными — прокоагулянтными? Вероятно, потому, что для активации требуется сумма сигналов от разных регуляторов. Мы уже сказали, что тромбоциты чувствительны к тромбину, который плавает в плазме крови, а в начале статьи говорили, что одним из первых активирующих сигналов для кровяных пластинок служит коллаген из повреждённой стенки сосуда. Коллаген и тромбин действительно сильные активаторы, но кроме них тромбоциты «прислушиваются» и к некоторым другим молекулам. Степень активации зависит от количества разных входных сигналов, и превращение в прокоагулянтную форму, очевидно, происходит тогда, когда суммарный сигнал извне оказывается для конкретного тромбоцита особенно сильным.
Практические аспекты полученных результатов понятны каждому: чем больше подробностей узнаем про свёртывание крови, тем скорее научимся управлять этим процессом, ускоряя или замедляя его в соответствии с медицинскими показаниями.
Интервью с Фазли Атауллахановым, «Наука и жизнь» № 1, 2011 г.
Кому необходимо определять свёртываемость крови
Чтобы снизить риск развития сосудистых катастроф и неожиданных кровотечений, необходимо периодически контролировать состояние свёртывающей системы крови лабораторным методом. Особенно важно это для:
- людей старше 40 лет;
- женщин в период менопаузы и после нее;
- женщин во время беременности;
- людей, которые регулярно принимают препараты, разжижающие кровь (аспирин);
- больных, страдающих варикозной болезнью;
- тех, кто готовится к операции и т.д.
Врач обязательно назначает на показатели свёртываемости крови при подозрении на гемофилию (обычно эта болезнь обнаруживается в раннем детском и молодом возрасте) либо при лечении с помощью фибринолитической терапии и антикоагулянтов уже имеющегося тромбоза.
Что может спровоцировать развитие гиперкоагуляции?
Гиперкоагуляция крови может быть вызвана самыми разнообразными причинами, среди которых:
- Вынашивание ребенка. Кровь сгущается из-за происходящих в организме изменений.
- Рвота и диарея, учащенное мочеиспускание на фоне сахарного диабета, патологии мочевыделительной системы, заболевания легких, травмы и ожоги – все эти факторы способны спровоцировать развитие гиперкоагуляции крови. Чем быстрее организм теряет запасы жидкости, тем гуще у него становится кровь. Обезвоживание негативным образом сказывается на работе головного мозга, на состоянии сердечно-сосудистой системы. Чтобы прервать прогрессирование гиперкоагуляции, необходимо прекратить дальнейшее обезвоживание и восстановить водно-натриевый баланс в организме.
- Прием лекарственных средств, например, гормональных контрацептивов, негативным образом сказывается на текучести крови, сгущая ее. После отказа от препаратов данной группы, концентрация крови нормализуется.
- Погрешности в питании, употребление слишком жирных продуктов влечет за собой повышение уровня холестерина в крови, что делает кровь густой и вязкой. Чтобы она продолжала течь по сосудам, сердцу приходится работать в усиленном режиме.
- Проникновение в организм патогенных агентов: вирусов, бактерий, паразитов.
- Наследственные и приобретенные в течение жизни ферментопатии способствуют замедлению тока крови и ее сгущению.
- Патологии печени, такие как гепатит и цирроз, вызывают нарушение микроциркуляции и проблемы с питанием тканей.
- Раковые заболевания: миома, гемангиома, липома лейкозы, миелома.
- Наследственная предрасположенность к гиперкоагуляции крови.
- Патологии кровеносной системы: тромбофилия, атеросклеротическая болезнь, эритремия, варикоз, ДВС-синдром.
- Вредные привычки и ведение нездорового образа жизни: курение, недостаточная двигательная активность.
- Ожирение.
- Проведенные операции на сердечных клапанах.
- Системные патологии: системная красная волчанка, васкулит, склеродермия.
- Нарушения в работе надпочечников, амилоидоз.
Гиперкоагуляция может развиться у любого человека. Если это случилось, то необходимо обращаться за врачебной помощью. Самостоятельно выбирать и принимать препараты, разжижающие кровь, запрещено.
Механизмы, которые приводят к развитию гиперкоагуляции:
- Увеличение количества прокоагулянтов в крови, повышение их активности. Подобная ситуация развивается на фоне тромбоцитоза, гиперфибриногенемии, гиперпротромбинемии.
- Шок, сепсис, ожог, ДВС-синдром – все эти состояния способствуют увеличению активности антикоагулянтов.
- Тромботический синдром, поврежденные сосудистые стенки, васкулит, атеросклероз – подобные нарушения вызывают нехватку фибринолитических факторов крови и провоцируют сбои в их работе.
При тяжелом течении гиперкоагуляции в сосудах формируются тромбы, которые нарушают ток крови, могут становиться причиной тяжелых осложнений для здоровья, а также несут угрозу жизни.
Как проверить свёртываемость своей крови
Свертывание крови — сложный процесс, состоящий из нескольких разных звеньев и этапов. Поэтому анализ на свертываемость крови должен помогать оценить работу каждого составляющего звена. Свертывание крови происходит при взаимодействии многих факторов по цепочке. Результаты общего анализа крови на свертываемость крови помогают установить, работа какого из факторов нарушена, что облегчает дальнейшую диагностику и выбор лечения. Например, анализ на оценку АЧТВ (Активированное частичное тромбопластиновое время) помогает выявить нарушение работы «внутреннего» пути свертывания и установить склонность к кровотечению. А протромбиновое время позволяет оценить «внешний» путь свертывания крови, обнаружить нарушение работы печени и недостаток витамина К. Еще один важный показатель, который очень помогает врачам при планировании операций и оценке риска тромбозов (в том числе и в период беременности) — это анализ крови на Д-димер. Он дает возможность:
- определить степень риска острых и тяжелых сердечно-сосудистых состояний;
- спрогнозировать дальнейшее течение тромбоза;
- наблюдать за результатами лечения в динамике.
Проведение общего анализа свертываемости крови — важное исследование, которое помогает значительно снизить риск неожиданных осложнений и смертность после болезней, операций, родов. Данные анализа дают врачу возможность ожидать объективных результатов от предстоящего лечения и контролировать его, а пациенту — шанс обезопасить себя от нежелательных последствий нарушений свертываемости крови.
Система свертывания крови
Система включает активные элементы, или факторы свертывания крови. Вещества, находящиеся в плазме, относятся к группе белков и непосредственно участвуют в процессе гемокоагуляции. Их называют плазменными факторами и обозначают римскими цифрами. Вырабатываются они в организме неактивными, когда активируются, то к римской цифре добавляют букву «a». К нескольким из них добавлено имя больного, у которого впервые была выявлена нехватка этого вещества. Среди них следующие факторы:
- I – фибриноген. Образуется в печени, а также в селезенке, костном мозге, лимфоузлах. Преобразуется в нерастворимый белок фибрин при участии тромбина.
- II – протромбин. Если его содержание составляет менее 40 процентов от нормы, скорость гемостаза понижается.
- III – тканевый тромбопластин. Содержится неактивным в разных тканях организма. Участвует в формировании протромбиназы, с помощью которой протромбин превращается в тромбин.
- IV – ионы кальция. Участвуют во всех трех фазах гемокоагуляции. При отсутствии слипание тромбоцитов и ретракция сгустка нарушаются.
- V – AC-глобулин. Синтезируется в печени, быстро разрушается. Необходимая концентрация для свертывания – не менее 10%.
- VI – исключен из списка.
- VII – проконвертин. Производится в печени с участием витамина K. Активируется в самой первой фазе, во время свертывания не расходуется, остается в сыворотке крови. Уровень для гемостаза должен составлять не менее 5%.
- VIII – антигемофильный глобулин A. Вырабатывается в печени, селезенке, почках, лейкоцитах, клетках эндотелия. Усиливает влияние фактора IX на фактор X. Необходимая концентрация – около 35%.
- IX – фактор Кристмаса. Образуется в печени, при этом необходимо участие витамина K. Долго сохраняется в крови (сыворотке и плазме). Свертывание крови происходит, если его уровень не менее 20%.
- X – Стюарта – Прауэра. Вырабатывается неактивным в печени с участием витамина K. Минимальная концентрация для гемостаза – 10-20 процентов.
- XI – антигемофильный глобулин C. Образуется в печени, становится активным под действием факторов XII, Флетчера, Фитцджеральда и активирует фактор IX.
- XII – Хагемана (фактор контактный). Синтезируется неактивным в печени. Свертывание происходит, даже если его уровень составляет всего 1%.
- XIII – фибриназа, или фибринстабилизирующий фактор. В плазме крови находится в соединении с фибриногеном. Активируется при участии тромбина. Для гемостаза достаточно 5 %.
- XIV – Флетчера, или прокалликреин. Производится в печени, для свертывания достаточно 1%.
- XV – Фитцджеральда – Фложе. Необходимая концентрация – 1%.
Недостаточная активность факторов приводит к плохой свертываемости крови и кровотечениям. Это может произойти при недостатке витамина K, болезнях печени, при нарушении всасывания жиров в кишечнике, сниженном образовании желчи, генетических заболеваниях, таких как гемофилия, при которой кровь не свертывается. Витамин K нужен для выработки II, VII, IX и X факторов. Он содержится в продуктах растительного происхождения, их всасывание происходит в кишечнике.
При свертывании крови необходимы активные вещества, находящиеся в тромбоцитах. Они носят название тромбоцитарных (пластинчатых) факторов и обозначаются арабскими цифрами. К ним относятся следующие:
- акцелератор-глобулин;
- акцелератор тромбина (влияет на скорость превращения фибриногена);
- тромбоцитарный тромбопластин;
- антигепариновый;
- свертываемый;
- тромбостенин;
- котромбопластин тромбоцитарный;
- антифибринолизин;
- фибриностабилизирующий;
- серотонин;
- АДФ (аденозиндифосфат).