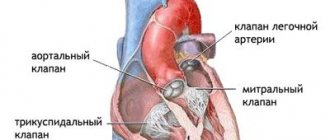
Острый коронарный синдром (ОКС) — комплекс клинических признаков и симптомов, которые позволяют предположить у больного инфаркт миокарда (ИМ) или нестабильную стенокардию (НС). Это значит, что диагноз носит собирательный характер. Установление диагноза «острый коронарный синдром» требует начала неотложных терапевтических и диагностических мероприятий без ожидания постановки нозологического диагноза. В основе всех форм ОКС лежит один и тот же патофизиологический процесс: недостаточное кровоснабжение миокарда вследствие окклюзии различной степени выраженности коронарных сосудов. Наиболее частая причина окклюзии – атеросклероз.
- Диагностика
- Электрокардиография
- Нарушения ритма сердца
- Инфаркт миокарда и его разновидности
- Нестабильная стенокардия
- Лечение инфаркта миокарда с подъемом сегмента ST
- Антиагрегантная и антикоагулянтная терапия в послеоперационном периоде
Инфаркт миокарда развивается из-за разрыва или надрыва атеросклеротической бляшки в коронарной артерии, что ведет к активации тромбоцитов и образованию тромба. Тромботическая окклюзия коронарной артерии при неразвитых коллатеральных артериях обычно приводит к инфаркту миокарда с подъемом сегмента ST. Неокклюзирующий тромб в просвете крупной коронарной артерии, окклюзия коронарной артерии мелкого калибра (диаметр 1-2 мм), наличие нестабильных атеросклеротических бляшек (неровные контуры, подрытые края) приводят к развитию инфаркта миокарда без подъема сегмента ST или стенокардии. Другие причины окклюзии: воспалительные заболевания коронарных артерий,тромбоэмболии (в том числе и ятрогенные – при вмешательствах на коронарных артериях), коронароспазм.
ОКС включает в себя:
- инфаркт миокарда с подъемом ST (ИМП ST);
- инфаркт миокарда без подъема ST (ИМБП ST);
- ИМ, диагностированный по изменениям ферментов, по биомаркерам, по поздним ЭКГ-признакам;
- Нестабильную стенокардию.
Диагностика
ОКС следует предполагать у мужчин возраста более 30 лет и женщин, которые старше 40 лет, если основным симптомом является дискомфорт или боль в груди. Поскольку патогенез всех форм ОКС схож и различается в основном обширностью и степенью поражения миокарда, то и клинически (по симптомам) разные формы ОКС имеют похожие проявления, в основном это ангинозные боли.
Боль при ОКС необходимо отличать от боли при тромбоэмболии легочной артерии, пневмонии, перикардите, пневмотораксе, миокардите, переломе ребер, гипертоническом кризе, спазме пищевода,диафрагмальной грыже, почечной колике, остром расслоении аорты, остеохондрозе. В большинстве случаев ангинозная боль имеет явные характерные особенности, что позволяет с уверенностью поставить предварительный диагноз:
- По описанию пациента, боль носит сжимающий, иногда жгучий характер;
- Боль локализуется чаще всего за грудиной – в средней и нижней ее части.
- Боль – разлитая, имеет большую площадь на передней поверхности грудной клетки.
Хорошо запоминающееся описание коронарогенной боли приводится в своей замечательной книге «Азбука ЭКГ» (автор Зудбинов Ю.И.):
«Если объединить вышеперечисленные свойства коронарогенной боли и попросить больного показать ее, то больной раскрытой ладонью опишет круг или несколько кругов на уровне средней и нижней части грудины, а затем сожмет разведенные пальцы в кулак. Пациент как бы подсознательно указывает на чувство сдавления, сжатия в средненижней части грудины и разлитой характер боли. Это и есть симптом «сжатого кулака», описанный Юшаром – один из достоверных признаков коронарогенной боли».
Если речь идет о стенокардии, то характерно чередование приступов боли и периодов, когда боль полностью проходит. Сублингвальный прием нитроглицерина (таблетка под язык) быстро прекращает боль или значительно уменьшает ее. Сам приступ носит волнообразный характер – сначала болевые ощущения становятся всё сильнее, а потом идут на спад. Обычно продолжительность приступа стенокардии составляет 2-7 минут. Также характерна стереотипность – каждый последующий приступ практически ничем не отличается от предыдущего.
Для инфаркта миокарда (ИМ) характерна сильнейшая давящая или сжимающая боль в груди, часто иррадиирующая в левую руку и сопровождающаяся страхом смерти. В целом, по своим характеристикам и локализации, болевые ощущения сходны со стенокардией, но бывают более сильными, длятся >20 мин и не проходят в покое и после приема нитроглицерина.
Обязательно уточните у пациента, наблюдались ли у него ранее такие боли, и если да, то чем они закончились? Были ли предвестники в виде неприятных ощущений в грудной клетке или учащения приступов стенокардии? Постепенное усиление болевых ощущений характерно для инфаркта миокарда.
При ТЭЛА и расслаивающей аневризме аорты боль в основном возникает резко. При разрывающей или кинжальной боли, иррадиируюшей в спину, резистентной к назначению наркотических анальгетиков, следует заподозрить расслаивающую аневризму аорты. Иногда боль при ИМ больной ощущает только в местах иррадиации, а не за грудиной. Например, достаточно часто боли в эпигастрии принимают за желудочно-кишечные нарушения.
Формы ИМ без боли встречаются приблизительно у 20% пациентов. Они характерны: для пожилых пациентов, больных сахарным диабетом и в случае интраоперационного развития ИМ. Другие признаки инфаркта миокарда – одышка, потливость, слабость, головокружение, сердцебиение, боль в животе, спутанность сознания, тошнота, рвота. Жалобы, напоминающие болезни ЖКТ, особенно часты при нижнем инфаркте.
Другие диагностические исследования при ОКС
- Рентгенография органов грудной клетки;
- ЭхоКГ при атипичном течении. Если есть такая возможность, ЭхоКГ нужно проводить всем больным с острым ИМ, чтобы оценить сократительную функцию левого желудочка, дисфункции сосочковых мышц, выявления аневризмы левого желудочка, признаков гипокинезии миокарда и т.д;
- Определяют: мочевину, глюкозу, креатинин, натрий, калий, магний крови, общий анализ крови, протромбиновое время, число тромбоцитов, фибриноген, МНО, АЧТВ;
- Холестерин, липопротеиды низкой плотности (ЛПНП) крови. Это исследование нужно выполнить в течение первых суток после ИМ. При выполнении анализа в более поздние сроки полученные результаты не засчитывают.
Мониторинг
ЭКГ, неинвазивное артериальное давление, пульсоксиметрия (с момента поступления) – в течение 1 суток при неосложненном ИМ, и до стабилизации состояния – при осложненном инфаркте миокарда. При осложненных формах ИМ (сердечная недостаточность, кардиогенный шок) – возможно применение инвазивных методов контроля гемодинамики.
Определение риска смерти
Современные рекомендации по диагностике и лечению ОКС рекомендуют в обязательном порядке в ранние сроки с момента поступления пациента, определение вероятности риска его смерти, используя минимум три градации – высокий, промежуточный, низкий риск. В первую очередь, это дает возможность идентифицировать пациентов, для которых инвазивная стратегия лечения ОКС была бы наиболее эффективной. Но даже если лечебное учреждение не имеет соответствующих возможностей, всегда полезно знать предположительный прогноз хотя бы для того, чтобы определить правильную стратегию в общении с родственниками больного.
Шкала GRACE
Предложено достаточно много шкал стратификации риска, имеющие свои достоинства и недостатки (PURSUIT, TIMI, SCORE). Они могут помочь врачу определить степень риска и выбрать правильную стратегию терапии. Российские рекомендации предлагают использовать шкалу оценки GRACE для оценки риска смерти при ОКС без подъема сегмента ST.
Подсчет баллов по шкале GRACE можно выполнить вручную по соответствующей таблице, или при помощи калькулятора – на сайте. Риск, оцениваемый по шкале GRACE, принято интерпретировать как:
1. Низкий риск – смертность менее 1% (при расчете при помощи автоматического калькулятора), количество баллов (при выполнении расчетов вручную) менее 109;
2. Средний риск – смертность от 1% до 3% (при расчете при помощи автоматического калькулятора); количество баллов (при выполнении расчетов вручную) от 109 до 140;
3. Высокий риск – смертность более 3% (при расчете при помощи автоматического калькулятора); количество баллов (при выполнении расчетов вручную) более 140.
Шкала Killip
Классификация Killip, характеризующая выраженность сердечной недостаточности (острой или хронической), является достоверным предиктором смертности у пациентов с ОКС.
Классификация острой сердечной недостаточности по Киллип (Killip T, Kimballe J, 1967)
| Таблица. Классификация Killip | ||
| Класс | Характеристика | Летальность |
| I | Нет сердечной недостаточности | 6-8% |
| II | Влажные хрипы <50% легочных полей, III тон, легочная гипертензия. | 30% |
| III | Влажные хрипы >50% легочных полей. | 40% |
| IV | Наличие кардио-генного шока | >50% |
В большинстве случаев, и особенно, если планируется проведение тромболитической терапии, катетеризация центральных вен противопоказана. Морфин оказывает анальгетическое, противотревожное действие и уменьшает потребление миокардом кислорода. Чтобы уменьшить вероятность побочных действий (угнетение дыхания, гипотензия), 10 мг морфина медики разводят в 10 мл 0,9% натрия хлорида и вводят внутривенно по 2-3 мл с интервалом 5 мин, или используют дозатор. Из-за риска появления побочных эффектов (угнетение дыхания, гипотензия, рвота) не стоит вводить морфин более 20 мг/час. При сопутствующих обструктивных болезнях легких предпочтение отдают фентанилу или промедолу.
Нестероидные противоспалительные препараты (НПВП) для обезболивания нельзя использовать – они замедляют регенерацию поврежденного миокарда, увеличивают риск его разрыва и повышают сопротивление коронарных сосудов.
Нарушения ритма сердца
При ОКС и ИМ встречаются самые разнообразные нарушения ритма сердца. 70% больных с инфарктом миокарда погибают в первые 6 часов! Фибрилляция желудочков, желудочковая тахикардия – наиболее частая причина смерти. Спустя 12 часов фибрилляция желудочков развивается редко. В случае возникновения фибрилляции желудочков проводят дефибрилляцию с начальной мощностью разряда 150-200 Дж для бифазного дефибриллятора, и 360 Дж – для монофазного. И проводится, при необходимости, развернутая СЛР по принятым правилам.
Чтобы предотвратить рецидив фибрилляции, в/в вводят амиодарон 150-300 мг за 20-30 минут. Суточную доза препарата составляет 800-1200 мг внутрь или в/в. Обычно применяется в сочетании с бета-адреноблокаторами. Частые (более 5 за 1 мин) политопные экстрасистолы, особенно ранние, могут привести к фибрилляции желудочков. В таких случаях можно применить амиодарон по приведенной выше схеме.
Инфаркт миокарда и его разновидности
Как уже говорилось выше, диагноз ИМ ставится на основании клинических проявлений болезни, данных ЭКГ и определении в крови биохимических маркеров, которые отражают некротические изменения в кардиомиоцитах. В типичных случаях клинические проявления достаточно характерны:
- Внезапно появляются боли за грудиной и (или) в области сердца давящего, сжимающего или жгучего характера;
- Часто боль иррадиирует («отдает») в верхние конечности, шею, нижнюю челюсть, спину, эпигастральную область;
- Длительность боли превышает 20 мин. У многих больных возникает чувство страха и холодный пот. В отличие от обычной стенокардии, нитроглицерин эти приступы не купирует, или приносит только кратковременное облегчение.
Стоит отметить, что современные инвазивные методы лечения ОКС не только улучшили исходы лечения, но и сильно разнообразили причины, которые приводят к развитию ИМ.
Типы инфаркта миокарда
| Типы ИМ | Характеристика |
| 1 тип | Спонтанный инфаркт миокарда, обусловленный ишемией миокарда вследствие эрозии и/или надрыва атеросклеротической бляшки. |
| 2 тип | Инфаркт миокарда, который обусловлен ишемией миокарда вследствие увеличения потребности миокарда в кислороде или ухудшения кровоснабжения, например, в результате спазма коронарных артерий, их эмболии, аритмии, анемии, повышения или снижения артериального давления. |
| 3 т | Сердечная смерть с признаками возможного инфаркта миокарда, когда невозможно оценить биомаркеры повреждения сердца. |
| 4а тип | Инфаркт миокарда, который связан с чрескожным коронарным вмешательством. |
| 4b тип | Инфаркт миокарда, связанный с тромбозом стента по данным ангиографии или аутопсии. |
| 5 тип | Инфаркт миокарда, связанный с коронарном шунтированием. |
Проведение тромболизиса у пациентов без подъема сегмента ST не показано.
ЧКВ в кардиологии — что это такое
Расшифровка ЧКВ – чрескожное коронарное вмешательство, оно применяется в кардиологии для восстановления проходимости артерии сердца. Рекомендуется при атеросклерозе сердечных сосудов – стенокардии, инфаркте миокарда. Чрескожным называется потому, что в сосуд проникает катетер, введенный через кожу. Для этого обычно используется бедренная артерия, а ход инструментария отслеживается при помощи рентгенографии.
Существует 3 способа ЧКВ – баллонная ангиопластика, стентирование и лазерная реваскуляризация. В первом случае просвет расширяется при помощи раздувающегося баллона, он раздавливает бляшку, во втором дополнительно в эту зону ставят стент (каркас из металла), а в третьем лучи лазера разрушают скопления холестерина.
Рекомендуем прочитать статью о ЧПЭФИ сердца. Из нее вы узнаете о преимуществах и недостатках метода, показаниях к ЧПЭФИ сердца, а также о том, как проводится чреспищеводное электрофизиологическое исследование. А здесь подробнее о разрыве миокарда.
Показания к ЧКВ
К показаниям для проведения операции ЧКВ относятся:
- инфаркт миокарда;
- стенокардия с нестабильным течением или предынфарктным состояниям (приступы становятся чаще и сильнее, есть нарушения ритма, типичные изменения ЭКГ, ферментов крови, сердечная недостаточность);
- стабильная стенокардия при устойчивости к медикаментам или противопоказаниях для их постоянного применения;
- нестабильная атеросклеротическая бляшка (опасная в отношении инфаркта), обнаруженная при обследовании;
- сужение просвета сосуда после операции аортокоронарного шунтирования или уже проведенном ранее стентировании.
Противопоказания к проведению
Невозможно провести ЧКВ только при обширном кровотечении (нельзя принимать потом противосвертывающие препараты) и распространенном поражении сосудистой сети, когда катетер сложно завести в место сужения. Все остальные противопоказания к ангиопластике врач оценивает только в индивидуальном порядке, сопоставляя риск от операции и ее отсутствия:
- просвет артерии до 3 мм, а участок сужения более 20 мм;
- множественные изменения коронарных сосудов;
- низкая свертывающая активность крови, анемия;
- поражение сосудов в конечностях (особенно бедренной), через которые будет вводиться катетер;
- невозможность провести коронарографию из-за непереносимости контрастных веществ;
- артериальная гипертензия, которую не удается контролировать медикаментами;
- высокая температура тела, инфекция, обострение воспаления;
- декомпенсированный сахарный диабет;
- противопоказания для применения препаратов для разжижения крови после операции (помимо кровотечения);
- недостаточность функции почек, печени;
- нарушение кровообращения в мозговых артериях;
- болезни психики;
- новообразования;
- поражение клапанов сердца;
- бактериальный эндокардит;
- ревматизм, миокардит.
Нестабильная стенокардия
Нестабильная стенокардия (НС) – это острая ишемия миокарда вследствие снижения коронарного кровотока, тяжесть и продолжительность которой недостаточны для развития некроза миокарда. Но в любое время НС может трансформироваться в инфаркт миокарда. На основании симптомов и данных ЭКГ, врачи на раннем этапе лечения часто не могут отличить НС и ИМ без подъема сегмента ST.
При НС приступы коронарных болей возрастают по частоте, продолжительности и интенсивности, резко уменьшается переносимость физической нагрузки, снижается эффективность нитроглицерина. Наряду с этим появляются изменения ЭКГ, ранее неотмеченные. К НС относится и постинфарктная (возвратная) стенокардия (ПС) – возникновение или учащение приступов стенокардии через сутки и до 8 недель после развития ИМ.
Ее разделяют на раннюю (до двух недель) и позднюю постинфарктную стенокардию. При наличии ранней ПС летальность больных; перенесших инфаркт миокарда, на протяжении 1 года повышается с 2 до 17-50%. Основным осложнением, прямо связанным с ПСК, является расширение зоны некроза, наблюдающееся у 20-40% таких больных.
ЭКГ признаки нестабильной стенокардии, регистрируемые во время приступа, заключаются в депрессии сегмента ST, реже – в его подъеме выше изоэлектрической линии, появлении высоких зубцов Т в грудных отведениях, их инверсии или сочетание указанных изменений. Признаки ишемии нестойки и исчезают либо вскоре после прекращения приступа боли, реже – на протяжении ближайших 2-3 дней.
В довольно частых случаях ЭКГ остается в пределах нормы. Фактически, от ИМ без подъема сегмента ST, НС стенокардия отличается только отсутствием повышения в крови биомаркеров некроза миокарда в количествах, достаточных для диагноза инфаркта миокарда.
В последнее время с появлением высокочувствительных тестов (тропонины, H-FABP) на маркеры некроза миокарда, частота диагностики ИМ без подъема сегмента ST значительно возросла. Это говорит о том, что разница между этими двумя формами ОКС – достаточно относительная. Лечение НС и ИМ без подъема сегмента ST, по крайней мере, медикаментозное, должно быть однотипным.
Осложнения после
После операции стентирования возможны такие осложнения (помимо рестеноза):
- повышение температуры – считается нормой рост до 37,3 градусов в первые 2-3 дня, потом это признак инфицирования;
- кровотечение из бедренной артерии, где был заведен катетер;
- нарушение функции почек из-за введения контраста – боли в пояснице, учащенное мочеиспускание;
- травмирование сосуда катетером;
- аритмия, остановка сокращений сердца, инфаркт (частота ниже 1%).
Они, как правило, проявляются в ранний послеоперационный период, пока пациент находится в стационаре. После выписки опасными симптомами, требующими срочного обращения к врачу, являются:
- лихорадка,
- озноб,
- сильная боль в грудной клетке,
- жжение за грудиной,
- ощущение перебоев ритма,
- внезапная слабость,
- потливость.
Экстренное ЧКВ
Экстренное ЧКВ, выполняемое в течение первых двух часов с момента поступления в стационар, показано у следующей группы пациентов с острым коронарным синдромом без подъема сегмента ST:
1. Наличие продолжающейся или рецидивирующей ишемии миокарда;
2. Изменения сегмента ST в динамике (депрессия более 1 мм или транзиторный подъем (менее 30 мин) более 1 мм от изолинии);
3. Наличие глубокой депрессии сегмента ST в отведениях V2-V4, свидетельствующей о продолжающемся трансмураль-ом повреждении задних отделов миокарда левого желудочка;
4. Острая сердечная недостаточность (III-IV класс по Killip);
5. Наличие жизненноугрожающих аритмий (фибрилляция желудочков, желудочковая
тахикардия);
Позднее ЧКВ
Позднее ЧКВ, которое проводят на протяжении первых 72-х часов с момента поступления больного в стационар, показано у следующей группы пациентов с острым коронарным синдромом без подъема сегмента ST:
- Бальная оценка по шкале GRACE <140 но >108 (при выполнении расчетов вручную), расчетный показатель смертности менее 3% но >1% (при расчете при помощи автоматического калькулятора);
- Пациентам с отсутствием множественных других критериев высокого риска, у которых наблюдается рецидив симптоматики на фоне назначения интенсивной медикаментозной терапии или отмечается появление индуцированной ишемии миокарда в ходе проведения нагрузочного тестирования.
Лечение инфаркта миокарда с подъемом сегмента ST
Наиболее частой причиной инфаркта с подъем ST является острая ишемия и некроз миокарда вследствие тромбоза коронарной артерии. Разработаны два основных способа восстановления перфузии миокарда: тромболитическая терапия и хирургическая реваскуляризация миокарда (с помощью баллонной, или с применением ангиопластики, эксимерного лазера, коронарного стентирования или операции коронарного шунтирования).
Чрескожные коронарные вмешательства (ЧКВ) — предпочтительный метод реперфузии в первые 2 часа после первичного контакта врачей с больным человеком. Если же проведение ЧКВ в эти сроки недоступно по каким-то причинам, то нужно выполнить тромболизис (либо в стационаре, либо еще на догоспитальном этапе).
Заметим, что успешно проведенная реперфузия совсем не означает достижения успеха в лечении ИМ и сама может способствовать развитию реперфузионных повреждений в виде:
- Микроэмболизации микроциркуляторного русла с нарушением кровотока – феномен «no reflow»;
- Фатального повреждения жизнеспособных до момента реперфузии кардиомиоцитов;
- Оглушенного (станированного) миокарда, т.е. длительной сократительной дисфункции кардиомиоцитов;
- Разнообразных аритмий, в том числе, и потенциально фатальных – фибрилляции или желудочковой тахикардии.
Врачам необходимо заранее подготовиться к наиболее вероятным реперфузионным осложнениям – нарушениям ритма сердца и углублению сердечной недостаточности. Медики убеждаются в доступности, готовности и исправности дефибриллятора. Далее нужно набрать в шприц 10-20 мл 0,9% натрия хлорида и 1 мг адреналина.
Чем ЧКВ отличаются от открытых операций на сердце
Чрескожное коронарное вмешательство отличается от открытых операций на сердце не только большей безопасностью, но и техникой своего проведения.
Помимо этого, среди характерных черт можно также выделить:
- отсутствие необходимости помещать человека под общий наркоз на продолжительное время (с возрастом, а также ввиду наличия ряда обстоятельств пациентам бывает сложно выходить из «медикаментозного сна»);
- менее долгий реабилитационный процесс (целостность кожного покрова после чрескожного коронарного вмешательства восстанавливается уже спустя несколько недель после проведения операции);
- большое количество противопоказаний, носящих «временный характер» (например, лихорадочные состояния, отказ больного от дальнейшего сопровождения или отсутствие возможности поддерживать контакт с оперируемым);
- отсутствие необходимости длительной подготовки к проведению операции (обычно наблюдающий пациента кардиолог рекомендует сдать анализы крови на выявление патологий, а также пройти ультразвуковое исследование отдельных систем организма и получить заключение узких специалистов).
Оборудование, используемое во время проведения ЧСВ менее дорогостоящее, чем «рабочие инструменты» хирургов, работающих с открытыми операциями на сердце. Это обуславливает возможность проводить медицинские манипуляции такого типа в большинстве больниц, имеющих кардиологическое отделение.
Показания к реперфузионной терапии
Реперфузионную терапию нужно провести, если от начала ангинозного приступа прошло не более 12 ча-сов, а на электрокардиограмме отмечается подъем сегмента ST ≥0,1 mV, как минимум в двух последовательных грудных отведениях или в 2-х отведениях от конечностей, или появляется блокада ЛНПГ.
Введение тромболитиков или проведение ЧКВ нужно делатьв те же сроки при ЭКГ признаках истинного заднего инфаркта миокарда (высокие зубцы R в правых прекардиальных отведениях и депрессия сегмента ST в отведениях V1-V4 с направленным вверх зубцом T). Рекомендовано рассмотреть целесообразность/возможность проведения реперфузии и в том случае, если с момента начала симптомов прошло более 12 часов (по утверждению пациента), но имеются клинические и/или электрокардиографические подтверждения продолжающейся ишемизации миокарда. Проведение ЧКВ на полностью окклюзированной инфаркт обусловившей артерии, по прошествии 24 ч от начала клинических появлений у стабильных пациентов, не рекомендовано.
Разновидности стентов
ЧКВ в кардиологии – это процесс, подразумевающий использование передовых изобретений. К одному из таких относится стент. Он представляет собой тонкую металлическую трубку, сформированную из мелких ячеек. После внедрения в организм стент раздувается до размеров сосуда специальным баллоном, вводимым через артерию.
Различия между его типами обусловлены многими факторами: материалом, используемыми при изготовлении, покрытием, наносимым поверхность, типом раскрытия после установки в сосуде и так далее.
Основная классификация подразумевает подразделение имплантатов на:
- Проволочные (при производстве используется 1 тип проволоки).
- Тубулярные (в основе их конструкции лежит трубка в форме цилиндра).
- Кольцевые (конструкция подразумевает наличие нескольких колец, скрепленных между собой).
- Сетчатые (внешне выглядят как сетка).
- Самораскрывающиеся (после установки в сосуд увеличиваются в нем до требуемых размеров без использования дополнительного оборудования).
- Раскрывающиеся с помощью «баллончика» (приобретают необходимый размер после «раздувания» приспособлением, вводимым через артерию).
Разновидность стента, выбранная хирургом для конкретного человека, зависит от места внедрения имплантата, а также наличия противопоказаний у самого оперируемого (например, аллергические реакции на металлический сплав).
Мониторинг
Следует наладить стандартный мониторинг (неинвазивное АД, частота сердечных сокращений, ЧД, сатурация крови, электрокардиография, температура тела).
Антиагрегантная и антикоагулянтная терапия при проведении чрескожных коронарных вмешательств:
1. Как только медики приняли решение о проведении чрескожного коронарного вмешательства (ЧКВ), следует дать пациенту внутрь нагрузочную дозу препаратов:
- Ацетилсалициловая кислота – 325-500 мг, разжевать;
- Плюс один из ингибиторов P2Y12 рецептора:
— Тикагрелор 180 мг;
— Клопидогрел – 600 мг.
2. В разы быстрее развивается эффект другого класса антиагрегантов – блокаторов ГП IIb/IIIa рецепторов тром-боцитов. Если почему-то причинам человек заранее не получил клопидогрел или тикагрелор или к началу проведения ЧКВ действие этих лекарств не успевает проявиться, медики должны назначить абсиксимаб. Он вводится внутривенно болюсом 0,25 мг/кг с немедленным началом инфузии 0,125 мкг/кг/мин (максимально 10 мкг/мин). Введение следует начать за 10-60 минут до процедуры, продолжать во время нее, и в последующие 12 часов.
Комбинация абсиксимаба с АСК и НФГ имеет преимущества перед сочетанием АСК и НФГ при первичной транслюминальной баллонной ангиопла-стикой (ТБА) у больных ИМпST. Монофрам обладает тем же механизмом действия, что и абсиксимаб, но имеет больший период полувыведения, и поэтому может вводиться в виде однократного болюса 0,25 мг/кг массы тела.
3. Больным, получающим ацетилсалициловую кислоту и ингибиторы P2Y12 рецепторов, направленным на первичное ЧКВ, рекомендована поддерживающая терапия антикоагулянтами в следующих режимах:
Бивалирудин — препарат выбора в качестве поддерживающего антикоагулянта при первичном ЧКВ. Рекомендуемая доза бивалирудина для взрослых, в том числе пожилых, – 0,75 мг/кг, которую вводят внутривенно болюсно, далее немедленно проводят внутривенную инфузию со скоростью 1,75 мг/кг/ч в течение всего периода проведения реваскуляризационной процедуры.
Гепарин (НФГ) вводят внутривенно болюсом в дозе 70-100 МЕ/кг, если больной не получает блокаторы ГП IIb/IIIa ре-цепторов тромбоцитов, и 50-70 МЕ/кг, если терапия включает препараты этой группы.
4. После выполнения ЧКВ рекомендован прием антиагрегантов длительным курсом.
Выполнение первичного чрескожного коронарного вмешательства (ЧКВ) — основной современный метод лечения пациентов с инфарктом миокарда (ИМ) с подъемом сегмента ST (пST) [10]. Основной проблемой после выполнения ЧКВ у таких пациентов являются выраженная обструкция микрососудов или феномен no-reflow [5]. Результаты ряда исследований продемонстрировали, что у пациентов с феноменом no-reflow чаще встречаются ранние осложнения ИМ (аритмии, выпот в полость перикарда, тампонада сердца, ранняя застойная сердечная недостаточность); неблагоприятное ремоделирование левого желудочка; повторные госпитализации по поводу сердечной недостаточности и увеличивается летальность [1, 2, 6, 7, 12]. Следовательно, выявление, профилактика и лечение феномена no-reflow имеют наиважнейшее значение для результатов первичного ЧКВ.
Возникновение феномена no-reflow служит причиной меняющейся комбинации четырех патогенетических компонентов: 1) дистальной атеротромботической эмболии; 2) ишемического повреждения; 3) реперфузионного повреждения; 4) чувствительности микроциркуляции миокарда к повреждению [14].
Логическими предпосылками в профилактике дистальной эмболии при проведении ЧКВ является использование устройств для аспирации тромба, так как с их помощью можно уменьшить объем тромба в просвете артерии, лучше визуализировать истинное поражение и выполнить прямое стентирование без предварительной баллонной ангиопластики. В настоящее время представлены несколько моделей для тромбэктомии, которые можно разделить на катетеры для ручной аспирации тромбов и устройства для реолитического разрушения и аспирации тромбов за счет эффекта Вентури [13, 16].
Стратегии, направленные на сокращение времени от начала болевого синдрома за грудиной до выполнения баллонной анигиопластики, широко изучены и могут уменьшить частоту возникновения no-reflow посредством сокращения общего времени ишемии. Кроме того, известные лекарственные препараты, уменьшающие потребность миокарда в кислороде и, следовательно, значимость ишемии, могут улучшать результаты, по крайней мере частично, посредством улучшения перфузии миокарда [14].
Результаты ряда исследований, в которые были включены пациенты с высоким риском возникновения феномена no-reflow, имеющих факторы риска повреждения, связанного с реперфузией, продемонстрировали противоречивые результаты по эффективности использования блокаторов IIb/IIIa гликопротеиновых рецепторов тромбоцитов. Необходимо отметить, что по данным других исследований, использование блокаторов IIb/IIIa гликопротеиновых рецепторов связано с увеличением числа кровотечений при проведении ЧКВ [10].
Несмотря на то что генетически определенную чувствительность к микроциркуляторному повреждению сложно корректировать, приобретенная чувствительность может поддаваться лечению. Действительно, оптимальное и быстрое лечение гипергликемии — вероятно, наиболее важная цель в профилактике no-reflow. Согласно результатам исследования DIGAMI, снижение уровня глюкозы в крови связано с сокращением размеров инфаркта. Более того, статины также потенциально способны сократить размеры реперфузионного повреждения [11]. К. Iwakura и соавт. [9] продемонстрировали, что постоянная терапия статинами у пациентов с гиперхолестеринемией или без нее связана с более низкой частотой no-reflow и лучшим функциональным восстановлением.
Цель исследования — определение эффективности и безопасности использования устройств аспирации тромба в комбинации с внутривенным введением эптифибатида в профилактике выраженной обструкции микрососудов (феномена no-reflow) при выполнении первичного ЧКВ у пациентов с ИМпST.
Материал и методы
С октября 2009 г. по февраль 2011 г. на базе отделения рентгенохирургических методов диагностики и лечения ГКБ №12 проводилось лечение 92 пациентов с острым ИМ. Критериями включения в исследование являлись давность ИМпST не более 12 ч, ангиографические признаки тромба в просвете эпикардиальной коронарной артерии. Критерии исключения: наличие ИМ в анамнезе, кардиогенный шок, перенесенное коронарное шунтирование, блокада левой или правой ножек пучка Гиса, ритм электрокардиостимулятора.
Все пациенты были разделены на две группы: 1-ю группу составили 45, 2-ю группу — 47. Пациенты 1-й и 2-й групп были сопоставимы по исходным клиническим характеристикам (табл. 1).
Перед выполнением вмешательства все пациенты получали 600 мг клопидогрела и 300 мг ацетилсалициловой кислоты перорально. После этого пациентам выполняли коронарографию, по результатам которой в сопоставлении с данными ЭКГ определяли локализацию поражения в инфаркт-ответственной артерии (табл. 2).
У всех пациентов в 1-й и во 2-й группах наблюдения определялись ангиографические признаки тромба в просвете инфаркт-ответственной артерии.
Во время проведения ЧКВ всем пациентам 1-й и 2-й групп внутривенно вводили 70 ед/кг нефракционированного гепарина. Первым этапом ЧКВ выполняли механическую реканализацию проводником. Затем в 1-й группе пациентов осуществляли аспирацию тромба с помощью катетера Export («Medtronic», США) и вводили блокатор IIb/IIIa гликопротеиновых рецепторов тромбоцитов эптифибатид, внутривенно струйно 180 мкг/кг с последующей постоянной инфузией 2,0 мкг/кг/мин в течение ЧКВ и 12 ч после выполнения операции. Во 2-й группе выполняли баллонную ангиопластику. ЧКВ как в 1-й, так и во 2-й группах завершали выполнением стентирования.
Адекватность реперфузии после выполнения вмешательства оценивали по степени кровотока по шкале TIMI и миокардиального контрастирования по результатам коронарографии и снижению сегмента ST по результатам электрокардиографии. Адекватной считали реперфузию при степени кровотока TIMI 3 в сочетании со степенью миокардиального контрастирования 2 или 3 и снижение подъема сегмента ST более чем на 70% через 1 ч после завершения вмешательства. Неадекватную реперфузию (феномен no-reflow) констатировали при кровотоке по шкале TIMI <3 или 3 со степенью миокардиального контрастирования от 0 до 1 и снижении подъема сегмента ST на 70% и менее через 1 ч после завершения вмешательства.
На госпитальном этапе наблюдения оценивали следующие показатели: повторный ИМ, повторное ЧКВ, клинически значимые кровотечения и смерть. К клинически значимым кровотечениям относили внутричерепные кровотечения; кровотечения, вызывающие нестабильность гемодинамики или требующие вмешательства; кровотечения, требующие переливания крови, но не приводящие к нарушению гемодинамики.
В отдаленном периоде наблюдения (через 12 мес) оценивали следующие показатели: повторные ИМ, возврат клинических проявлений стенокардии, функциональный класс (ФК) сердечной недостаточности (СН) по классификации Нью-Йоркской Ассоциации кардиологов (NYHA) и смертность.
Статистический анализ выполняли с использованием программы Statistica 7.0 («StatSoft Inc.», США). Сравнение количественных переменных производили с использованием критерия Манна—Уитни, качественных переменных — с использованием двустороннего критерия Фишера и критерия χ2 Пирсона. Различия считали статистически значимыми при p<0,05.
Результаты
При выполнении ЧКВ в 1-й группе с использованием устройства для аспирации тромба у 34 (75,6%) пациентов были получены макроскопические фрагменты тромба. Ангиографические критерии эпикардиального кровотока и тканевой перфузии после выполнения стентирования в 1-й и во 2-й группах представлены в табл. 3.
По ангиографическим критериям адекватная реперфузия определялась статистически значимо чаще в 1-й группе пациентов.
Через 1 ч после завершения вмешательства в отделении реанимации снимали ЭКГ и оценивали динамику сегмента ST (табл. 4).
Были выявлены статистически значимые различия по снижению сегмента ST через 1 ч после ЧКВ в пользу группы, где выполнялась тромбоэкстракция с одновременным введением эптифибатида.
В течение 30 дней оценивали кардиальные осложнения и кровотечения (табл. 5).
Статистически значимо чаще летальные исходы были зарегистрированы в группе, где выполнялось стандартное ЧКВ. При анализе летальных исходов у пациентов 2-й группы установлено, что в данных наблюдениях после ЧКВ не были достигнуты критерии адекватной реперфузии.
Через 12 мес были изучены отдаленные результаты у 40 пациентов 1-й группы и у 38 2-й группы (табл. 6).
Статистически значимых различий между 1-й и 2-й группами пациентов по показателям частоты повторного ИМ, возврата стенокардии и смертности не выявлено.
У пациентов без повторных ИМ и возврата стенокардии через 12 мес наблюдения определяли ФК СН по классификации NYHA (табл. 7).
Статистически значимо чаще во 2-й группе пациентов определялся III ФК СН по NYHA через 12 мес наблюдения. При анализе пациентов 2-й группы с СН III ФК было установлено, что после выполнения ЧКВ у них не были достигнуты критерии адекватной реперфузии.
Обсуждение
В настоящее время в Европе и США проведен ряд исследований у пациентов с ИМпST, в которых использовались различные системы для аспирации тромба и защиты микроциркуляторного русла.
В проспективное рандомизированное исследование TAPAS был включен 1071 пациент с ИМпST. Результаты исследования продемонстрировали, что у пациентов с ИМпST стратегия аспирации коронарного тромба перед первичным ЧКВ со стентированием не только приводит к улучшению перфузии миокарда сразу после операции, но и сопровождается лучшими отдаленными клиническими результатами по сравнению со стандартным вмешательством [16]. Результаты исследований DEAR-MI и REMEDIA также продемонстрировали лучшую реперфузию миокарда непосредственно после вмешательства при использовании катетеров для аспирации тромбов [4, 15]. Показательными являются результаты метаанализа 11 исследований, в которые были включены 2686 пациентов. На основании полученных данных был сделан вывод, что использование устройств для аспирации тромба значительно улучшает клинические результаты у пациентов с ИМпST, подвергающихся механической реперфузии [3].
В нашем исследовании в группе пациентов, у которых использовались устройства для аспирации тромба в комбинации с внутривенным введением эптифибатида, результаты по восстановлению эпикардиального кровотока и перфузии миокарда после выполнения ЧКВ были статистически значимо лучше, чем в контрольной группе.
В этой группе пациентов также чаще определялось снижение сегмента ST более 70% через 1 ч после выполнения ЧКВ. В госпитальном периоде наблюдения были получены статистически значимые различия по летальности в пользу группы, где использовались устройства для аспирации тромба в комбинации с внутривенным введением эптифибатида. Необходимо отметить, что использование эптифибатида в 1-й группе пациентов не увеличивало количество кровотечений. В течение 12 мес наблюдения группы пациентов не различались по частоте развития повторного ИМ, повторного выполнения ЧКВ и смертности. Однако статистически значимо реже в группе пациентов, где использовалась профилактика обструкции микрососудов, определялся III ФК СН по NYHA в отдаленном периоде наблюдения.
Выводы
1. При выполнении первичного ЧКВ с использованием устройств для аспирации тромба в комбинации с внутривенным введением эптифибатида выраженная обструкция микрососудов (феномен no-reflow), оцениваемая по ангиографическим и ЭКГ-критериям, определяется статистически значимо реже.
2. При выполнении первичного ЧКВ с использованием устройств для аспирации тромба в комбинации с внутривенным введением эптифибатида статистически значимо снижаются летальность в госпитальный период наблюдения и число пациентов с III ФК СН по классификации NYHA в отдаленном периоде наблюдения.
3. Использование эптифибатида в комбинации с двухкомпонентной антиагрегантной терапией и гепаринотерапией при выполнении первичного ЧКВ не связано с увеличением количества клинически значимых кровотечений.
Антиагрегантная и антикоагулянтная терапия в послеоперационном периоде
В послеоперационном периоде рекомендовано назначение эноксапарина или фондопаринукса в течение 2-8 суток.
Антиагрегантная терапия в случае имплантации голометаллических стентов
Ацетилсалициловая кислота – 75-100 мг пожизненно;
Клопидогрел – 75 мг 1 раз/сутки или тикагрелор 90 мг 2 раза в сутки курсом 12 мес.
Антиагрегантная терапия в случае имплантации стентов с медикаментозным покрытием
- Ацетилсалициловая кислота – 160-325 мг 1 раз/сутки в течение первых 3-х месяцев. Начиная с 4-го месяца, препарат назначается в дозировке 75-100 мг 1 раз/сутки пожизненно;
- Клопидогрел – 75 мг 1 раз/сутки или тикагрелор 90 мг 2 раза в сутки курсом 12 мес.
Тромболитическая терапия
На сегодня тромболитическая терапия не является методом выбора для лечения инфаркта миокарда. Она проводится, если первичная ангиопластика не может быть выполнена в данном лечебном заведении.
Тромболизис рекомендуют также проводить, если время доставки пациента в сосудистый центр более 2 часов, или у человека находят признаки отѐка лѐгких или кардиогенного шока. Чем быстрее начата терапия от минуты появления симптомов, тем лучшими будут результаты тромболитической терапии.
Лучшее время для начала тромболизиса – первые полчаса после тромбоза коронарной артерии. Приемлемое время — до 6 часов от начала болезни, максимальное — до 12 часов.
ЭКГ показания для тромболизиса: подъем сегмента ST больше или равно 0,1 mV, как минимум в 2-х последовательных грудных отведениях или в 2-х отведениях от конечностей, или появляется блокада левой ножки пучка Гиса. Введение тромболитиков целесообразно проводить в те же сроки при ЭКГ признаках истинного заднего инфаркта миокарда (высокие зубцы R в правых прекардиальных отведениях и депрессия сегмента ST в отведениях V1-V4 с направленным вверх зубцом T).
Назначение антиагрегантов при проведении тромболизиса
До начала тромболизиса:
Ацетилсалициловую кислоту (АСК) дают пациенту в дозировке 150-350 мг, ее нужно разжевать. На следующий день и в дальнейшем показано то же средство по 75-150 мг 1 раз в сутки. Препарат назначают при всех вариантах ИМ. Одновременно с АСК для усиления антиагрегационной эффективности терапии советуют применять ингибиторы P2Y12 рецептора – клопидогрел или тикагрелор.
При инфаркте миокарда у пациентов возраста менее 75 лет, с целью ускорения развития лекарственного воздействия в первые сутки, рекомендуется увеличить дозу клопидогрела до 300 мг/сут, далее делают переход на прием стандартной дозы 75 мг в сутки.
Для пациентов, которым более 75 лет, показан клопидогрел дозеой 75 мг. Назначение нагрузочной дозы препарата не показано. Тикагрелор (нагрузочная доза 180 мг, затем 90 мг два раза в день) назначают вместо клопидогрела. Длительность приема клопидогрела или тикагрелора – минимум 6 месяцев.
Антикоагулянтная терапия при проведении тромболизиса
Одновременно с введением перечисленных ниже тромболитических лекарственных средств, за исключением стрептокиназы, назначают введение нефракционированного или низкомолекулярного гепарина.
В зависимости от ситуации, нужно выбрать один из вариантов:
- Фондапаринукс, синтетический ингибитор Xa фактора, вводят в/в 2,5 мг до начала введения тромболитика. Далее медики вводят в дозе 2,5 мг один раз в сутки в течение 5-8 суток. Препарат не назначать, если скорость клубочковой фильтрации < 30 мл/мин;
- Эноксапарин (Клексан):
- Если возраст больного менее 75 лет – 30 мг внутривенно за 15 минут до введения тромболитика. Затем по 1 мг/кг подкожно (но не более 100 мг) через 12 часов в течение 5-8 дней;
- Если возраст больного более 75 лет – по 0,75 мг на 1 кг тела человека подкожно через 12 часов курсом 5-8 дней.
- Если скорость клубочковой фильтрации менее 30 мл/мин – 1 мг/кг один раз в сутки в течение 5-8 суток;
- Гепарин врачи вводят внутривенно болюсом 5000 ЕД, а после этого инфузией со скоростью 1000-1200 ЕД/час на протяжении 24-48. Потом назначается гепарин по 5000 ЕД 3 раза в сутки курсом 5-8 дней с контролем активированного частичного тромбопластинового времени.
Питание после ЧКВ
Диета является одним из обязательных условий реабилитационного периода, нужно исключить из рациона:
- жирное мясо (свинина, баранина, утка), субпродукты;
- все колбасные изделия;
- полуфабрикаты;
- консервы;
- копчения, соления, маринады;
- магазинные соусы;
- маргарин, сметанные и сырные продукты;
- жирные сливки, сметану и творог выше 9% жира, сливочное масло (можно до 20 г);
- нектары, сладкую газировку;
- торты, пирожные.
Разрешены:
- первые блюда из овощей и круп (без мяса и рыбы);
- отварные, паровые, запеченные овощи;
- нежирная курица и рыба (нельзя обжаривать или тушить с маслом);
- овощной салат с заправкой из трав и лимонного сока, чайной ложки растительного масла;
- фрукты, ягоды;
- цельнозерновой хлеб и с отрубями, каши, хлебцы;
- свежеприготовленные кисломолочные напитки без сахара, творог 2-5%, 1-2 столовые ложки сметаны 10% в день;
- яйца для омлета, пашот, отварные – 3 желтка в неделю, белок можно каждый день;
- бобовые – фасоль, чечевица, горох;
- семечки и орехи, мед – 1-2 столовые ложки.