Знаете ли вы о том, что существует более 100 разновидностей дефектов структуры сердца и коронарных сосудов, которые принято называть врожденными пороками, или ВПС? Глобальная статистика утверждает, что частота ВПС у детей составляет приблизительно 8 на каждую тысячу. От 0.7 до 1.7 % малышей рождаются с различными дефектами строения этого органа. Порок сердца у новорожденного — это проблема, требующая обязательного решения. Своевременное обнаружение и адекватная терапия этой аномалии позволяют не только сохранить ребенку жизнь, но и дать ему возможность полноценно развиваться.
ВПС: общее представление
Под врожденными дефектами педиатрия понимает нарушения строения органов или систем, которые возникают внутриутробно. За долгие 40 недель плод проходит поэтапно все стадии своего развития, от крохотной клетки-зиготы до маленького человечка — почти точной копии родителей. Во время беременности постепенно формируются все внутренние системы плода. В норме они должны развиваться по определенной программе, заложенной природой. И, если все идет по плану, на 37—41-й неделе малыш появляется на свет с полностью сформированными и готовыми к работе органами.
Случается, что отлаженная эволюцией система дает сбой. В какой-то момент происходит поломка в привычном механизме, и орган перестает развиваться по заложенному плану. Это может случиться с любым внутренним органом, но нас интересует сердце. Наиболее уязвимым оно является в периоде со 2-й по 8-ю недели после зачатия. В это время женщина зачастую даже не знает о зарождении внутри нее новой жизни. Любое негативное влияние в это время может оказаться фатальным и стать фактором, спровоцировавшим появление ВПС.
Диагностика и детализация состояния плода
Основной показатель нормального развития плода – его сердечный ритм.
Нормальные уровни:
- 110-130 ударов до восьмой недели беременности;
- 175-185 до конца первого триместра;
- 145-160 до родов.
На пороки развития сердечно-сосудистой системы плода указывают:
- брадикардия или тахикардия;
- различные временные интервалы между ударами;
- приглушенные звуки сердцебиения – признак кислородного голодания плода.
Порок сердца у плода на УЗИ становится очевидным в случае визуализации дефекта камер органа. ЧСС будущего ребенка можно посчитать уже в первом триместре беременности на рутинном обследовании при помощи акушерского стетоскопа. Более полную информацию о работе сердца плода даст КТГ, которое назначается после 32 недели беременности. Оценив его результаты, акушеры определяют параметры состояния малыша.
Основные заключения анализа показателей состояния плода:
- ниже 1,0 — норма;
- 0,8-1,0- пограничное состояние;
- до 2,0 — первичные отклонения. Показано повторное КТГ в течение недели;
- до 3,0 — тяжелые отклонения. Показано стационарное лечение;
- более 3,0- критичное состояние плода, указывающее на его выраженные страдания.
Это доступные и для пациентки, и для врача методики обследования. Они не требуют особой подготовки и не занимают много времени.
Но лидером в исследованиях гемодинамических процессов в сердце и сосудах плода считается доплер-эхокардиография.Этот метод оценивает три основных показателя –направление, скорость и характер кровотока. Процедура такова:на животе беременной устанавливается датчик УЗИ. На экран передается цветное изображение. Красным обозначается течение крови, которая двигается в сторону датчика.Синий цвет указывает на объем крови, идущий в обратном направлении. Максимальная интенсивность того или иного цвета обозначает повышенную гемодинамику.
Чрезвычайно ценную информацию о сердце и самом плоде дает ЭХО-КГ. Исследование может назначаться на любом сроке беременности, но, как правило, выполняется начиная с 12 недели после получения настораживающих показаний первого скрининга.
Это исследование определит:
- направление и скорость кровотока в сосудах;
- проходимость кровяного русла;
- соотношение объемов входящей и выходящей из сердца плода крови;
- ЧСС.
Лучше всего проводить процедуру на сроке от 18 до 24 недели, так как именно в этот срок обеспечивается максимальный визуальный эффект.
Исследования, проведенные ранее этого времени, не будут достаточно объективными из-за малых размеров сердца. К концу беременности ЭХО-КГ плода редко используется из-за большого объема живота, затрудняющего визуализацию органа.
К решению вопросов, касающихся результатов исследования плода с ВПС, привлекается детский кардиолог и кардиохирург.
Почему появляются дефекты
Нам достоверно неизвестны причины пороков у плода. Мы можем лишь предполагать влияние некоторых факторов:
- Хромосомные аномалии – структурные или количественные изменения генного материала. Дефектной может быть и материнская, и отцовская клетка. Вероятен и наследственный изъян, и впервые возникшая мутация. Даже если родители здоровы, по каким-то причинам иногда развивается дефект одной-единственной половой клетки. Если именно эта клетка станет основой зародыша, возникнет нарушение.
- Влияние внешних тератогенов. Опасен постоянный контакт с токсинами, особенно в 1-м триместре. ВПС плода на УЗИ мы чаще выявляем у женщин, занятых на лакокрасочном производстве. К тем же последствиям может привести прием некоторых медикаментов в I триместре (противоэпилептические средства, Ибупрофен, препараты лития и другие). Опасны избыток витамина A, ионизирующая радиация, проживание в экологически неблагоприятном районе.
- Внутриутробные инфекции. Это, прежде всего, краснуха — при первичном заражении организма возникают дефекты сердца плода, поражение глаз и органа слуха. Опасен в I триместре беременности грипп и цитомегаловирус, любое вирусное заражение с лихорадкой.
- Материнские факторы. Риск развития ВПС у детей выше при отягощенном акушерском анамнезе. Всегда настораживает, если раньше были выкидыши, особенно на 13-24 неделях, — вероятное следствие недиагностированного порока. Чреваты опасностью для будущего ребенка прием алкоголя матерью, курение. Вероятность рождения младенца с ВПС выше у рожениц от 35-ти лет и при сахарном диабете.
- Семейные факторы. Прием наркотиков (кокаина, марихуаны) отцом младенца повышает риск развития ВПС.
Важно знать причины и последствия порока сердца у новорожденного и плода, но зачастую нельзя однозначно сказать, какой фактор стал решающим. Невозможно отследить, что именно привело к появлению дефекта. Стала ли фатальной таблетка Ибупрофена, принятая матерью от головной боли, или причиной болезни выступил «подхваченный» вирус? Мы можем лишь предполагать и стараться исключить все негативные факторы.
Особенности ведения беременности при пороках сердца
Ведение беременности у женщин с пороками сердца, как уже было сказано выше, проводится с участием нескольких специалистов. Оно требует не только координированной деятельности специалистов женской консультации, но и дисциплинированного поведения самой женщины: ранней постановки на учет в женской консультации, своевременного посещения врачей и сдачи анализов, полного обследования, своевременного комплексного лечения.
Если есть возможность, то, конечно, лучше доверить свое здоровье крупному медицинскому центру, специализирующемуся на данной проблеме. Это может быть отделение для женщин с сердечно-сосудистой патологией при институте или специализированное отделение на базе крупного роддома, где грамотные специалисты, имеющие опыт ведения пациенток с такой патологией, смогут эффективно помочь.
Течение беременности у женщин с пороками сердца имеет свои особенности. Часто встречаются такие осложнения, как гестозы (осложнения беременности, проявляющиеся появлением отеков, белка в моче, повышением артериального давления), которые характеризуются скрытым течением и плохо поддаются лечению. Беременность у таких пациенток часто осложняется угрозой прерывания — число самопроизвольных абортов и преждевременных родов значительно превышает средние показатели. Кроме того, течение беременности может осложняться нарушением маточно-плацентарного кровотока, что приводит к гипоксии (кислородному голоданию) или задержке внутриутробного развития плода. Высок также риск отслойки плаценты. Накопление тромбов в плаценте ведет к выключению части плаценты из кровотока и усилению кислородного голодания плода.
По всем приведенным выше причинам женщины с пороками сердца и, другой патологией сердечно-сосудистой системы за время беременности должны быть госпитализированы в стационар не менее трех раз:
Первая госпитализация — на 8-10-й неделе беременности для уточнения диагноза и решения вопроса о возможности сохранения беременности. Вопрос о прерывании беременности до 12 недель решают в зависимости от выраженности порока, функционального состояния системы кровообращения и степени активности ревматического процесса.
Вторая госпитализация — на 28-29-й неделе беременности для наблюдения за состоянием сердечно-сосудистой системы и, при необходимости, для поддержания функции сердца в период максимальных физиологических нагрузок. Это обусловлено тем, что именно в этот период в норме значительно возрастает нагрузка на сердце (один из периодов максимальной физиологической нагрузки) — почти на треть увеличивается так называемый сердечный выброс, в основном за счет увеличения частоты сердечных сокращений.
Третья госпитализация — на 37-38-й неделе для подготовки к родам и выбора метода родоразрешения, составления плана родов.
При появлении признаков недостаточности кровообращения, обострения ревматизма, возникновении мерцательной аритмии (частого неритмичного сокращения сердца), гестоза или выраженной анемии (снижения количества гемоглобина) и других осложнений необходима госпитализация независимо от срока беременности.
Вопрос о прерывании беременности на более поздних сроках является достаточно сложным. Нередко врачам приходится решать, что менее опасно для больной: прервать беременность или позволить ей развиваться дальше. В любых случаях при появлении признаков недостаточности кровообращения или каких-либо сопутствующих заболеваний больная должна быть госпитализирована, подвергнута тщательному обследованию, лечению.
Если же ситуация не требует таких кардинальных мер, беременная должна соблюдать максимальную осторожность. Прежде всего необходимо позаботиться о достаточном отдыхе и продолжительном, 10-12-часовом сне. Полезен дневной 1-2-часовой сон. Достаточно эффективными средствами лечения и профилактики являются лечебная физкультура, утренняя гимнастика, прогулки на свежем воздухе. Комплекс утренних упражнений должен быть самым простым, не приводящим к чрезмерным перенапряжениям, усталости.
Питание необходимо сделать максимально разнообразным, полноценным, с повышенным содержанием белковых продуктов (до 1,5 г/кг массы тела). Необходим прием поливитаминов. Кроме того, врач может назначить сеансы гипербарической оксигенации (сеансы в барокамере, куда под давлением подается воздух с повышенным содержанием кислорода), общее ультрафиолетовое облучение.
Многоликость пороков сердца: классификация и виды
Интереса заслуживает клиническая классификация ВПС:
- Цианозные (сопровождаются синюшностью кожи, слизистых). Это тетрада Фалло, общий артериальный ствол, транспозиция магистральных артерий.
- Сопровождающиеся бледностью (характерно сужение сосудов в коже и слизистых). Так бывает при открытом артериальном протоке, дефектах перегородок между желудочками и предсердиями, клапанном стенозе легочного ствола.
- Приводящие к системной гипоперфузии (ослабленному кровотоку). Это характерно для дефектов аорты (стеноза или коарктации).
Еще одна рабочая система предполагает деление ВПС по особенностям нарушения гемодинамики — тока крови по сосудам. Здесь важно выделять такие варианты:
- связанные с фетальными коммуникациями (особенностями системы кровотока у плода). Движение крови по большому кругу зависит от проходимости особой структуры, называемой открытым артериальным протоком, или ОАП.
- ВСП, не связанные с сохранением фетальных структур.
Первый случай является критическим для новорожденного. Его кровообращение зависит от того, как долго будут существовать открытое овальное окно и ОАП. Они должны закрываться в процессе рождения. Тогда возможен полноценный переход к новому режиму кровообращения с двумя кругами. Но при этом типе ВПС кровеносная система может функционировать только при сохранении фетальных структур — открытого овального окна или артериального протока. Если они закрываются, развивается критическая ситуация, и возникает сердечная недостаточность.
Симптомы и признаки ВПС
Порок сердца у новорожденных может проявляться по-разному. Клиническая картина зависит от типа дефекта, степени нарушения гемодинамики, наличия сопутствующей патологии и иных факторов. Некоторые ВПС остаются бессимптомными и в периоде новорожденности не выявляются. Они диагностируются позже — у грудничка в возрасте 1—6 месяцев. Реже ВПС выявляются после первого года жизни.
Ведущие симптомы врожденной патологии сердца:
- цианоз или бледность кожи и слизистых оболочек;
- кардиальные шумы;
- признаки сердечной недостаточности.
В течении заболевания у новорожденных выделяют два критических периода:
- 3—5-й день: происходит закрытие овального окна;
- 3—6 недель: снижается сосудистое легочное сопротивление.
В эти периоды нарушается гемодинамика, и состояние ребенка ухудшается.
У грудничка и малыша младше 3 лет о наличии ВПС могут говорить такие симптомы:
- синюшность или бледность кожи;
- быстрая утомляемость при кормлении;
- одышка;
- дефицит веса;
- отставание в физическом развитии;
- частые заболевания бронхов и легких.
Некоторые пороки сердца остаются недиагностированными до подросткового возраста. Заподозрить патологию можно по таким признакам:
- отставание в физическом развитии (низкий вес и рост);
- быстрая утомляемость, слабость;
- учащенное сердцебиение;
- отеки конечностей;
- бледность или цианоз кожи;
- повышенная потливость;
- кардиовокальный синдром (осиплость голоса, стридор – свистящее шумное дыхание).
Если подросток демонстрирует эти симптомы, стоит обратиться к врачу: выяснить причину такого состояния, исключить врожденный порок сердца.
Причины ВПС
В качестве основных ведущих причины в формировании пороков, чаще всего, выступают структурные и количественные хромосомные аномалии, и мутации, т.е. первичные генетические факторы.
Также необходимо уделять внимание потенциально тератогенным факторам внешней среды: различные внутриутробные инфекции (вирусы краснухи, цитомегаловирус, коксаки, инфекционные заболевания у матери в первом триместре), лекарственные препараты (витамин А, противоэпилептические средства, сульфазалазин, триметоприм), постоянный контакт с токсичными веществами (краски, лаки). Кроме того, нужно помнить, что отрицательное влияние на внутриутробное развитие оказывают как материнские факторы: предшествующие данной беременности репродуктивные проблемы, наличие сахарного диабета, фенилкетонурии, алкоголизма, курение, возраст, но также, и факторы со стороны отца – возраст, употребление наркотических средств (кокаин, марихуана).
Ведущая роль принадлежит мультифакториальной теории развития врожденных пороков сердца (до 90%).
Виды врожденных пороков сердца
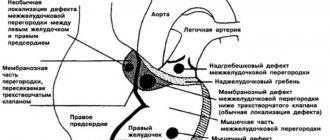
- Дефект межпредсердной перегородки (ДМПП) или открытое овальное окно – диагностируется при выявлении одного либо нескольких отверстий в межпредсердной перегородке. Один из часто встречающихся врожденных пороков сердца. В зависимости от расположения дефекта, его величины, силы тока крови определяются более или менее выраженные клинические признаки. Часто ДМПП сочетается с другими аномалиями сердца и определяться при синдроме Дауна.
- Дефект межжелудочковой перегородки (ДМЖП) – диагностируется при недоразвитии межжелудочковой перегородки на различных уровнях с формированием патологического сообщения между левым и правым желудочками. Может встречаться как изолированно, так и вместе с другими аномалиями развития. При малом дефекте – чаще нет выраженного отставания в физическом развитии. ДМЖП опасен тем, что может приводить к развитию легочной гипертензии, и потому, должен своевременно корректироваться оперативным путем.
- Коартация аорты – сегментарное сужение просвета аорты с нарушением нормального кровотока из левого желудочка в большой круг кровообращения. Выявляется до 8% всех случаев ВПС, чаще у мальчиков, нередко сочетается с другими аномалиями.
- Открытый артериальный проток – диагностируется при не заращении Баталлова протока, определяемого у новорожденных и зарастающего в последующем. В результате, происходит частичный сброс артериальной кровь из аорты в легочную артерию. При данном ВПС чаще не бывает тяжелых клинических проявлений, однако, патология требует хирургической коррекции, поскольку сопряжена с высоким риском внезапной сердечной смерти.
- Атрезия легочной артерии – диагностируется недоразвитие (полное либо частичное) створок клапана легочной артерии с развитием обратного заброса крови из легочной артерии в полость правого желудочка. В последующем приводит к недостаточному кровоснабжению легких.
- Стеноз клапана легочной артерии – аномалия, при которой диагностируют сужение отверстия клапана легочной артерии. В результате патологии, чаще всего, створок клапана, нарушается нормальный кровоток из правого желудочка в легочный ствол.
- Тетрада Фалло – сложный сочетанный ВПС. Объединяет дефект межжелудочковой перегородки, стеноз легочной артерии, гипертрофию правого желудочка, декстрапозицию аорты. При данной патологии происходит смешение артериальной и венозной крови.
- Транспозиция магистральных сосудов – также сложный ВПС. При данной патологии аорта отходит от правого желудочка и несет венозную кровь, а легочный ствол отходит от левого желудочка и несет артериальную кровь, соответственно. Парок протекает тяжело, сопряжен с высокой летальностью новорожденных.
- Декстрокардия – аномалия внутриутробного развития, арактеризующаяся правосторонним размещением сердца. Зачастую, наблюдается «зеркальное» расположениее других непарных внутренних органов.
- Аномалия Эбштейна – редко встречающийся врожденный порок сердца, диагностируется при изменении месторасположения створок трехстворчатого клапана. В норме — от предсердно-желудочкового фиброзного кольца, при аномалии — от стенок правого желудочка. Правый желудочек имеет меньшие размеры, а правое предсердие удлинено, вплоть до аномальных клапанов.
Клинический случай
На консультацию поступил грудничок в возрасте 3 месяцев. Из анамнеза известно: беременность вторая, родоразрешение путем операции кесарева сечения на сроке 39—40 недель. Вынашивание ребенка протекало на фоне гестоза, в I триместре женщина перенесла ОРВИ (лечилась дома самостоятельно).
Врожденный порок сердца заподозрил неонатолог в родильном доме на третьи сутки после рождения малыша. Врач выслушал грубый систолический шум вдоль левого края грудины и направил ребенка на обследование. На пятые сутки была проведена эхокардиография. Выставлен диагноз: открытый атриовентрикулярный канал, неполная форма. При этой патологии возникает дефект в нижней части межпредсердной перегородки, а также расщепляется двустворчатый (митральный) клапан.
Назначена поддерживающая терапия: сердечные гликозиды, диуретики. На фоне лечения состояние ребенка оставалось стабильным.
В возрасте 3 месяцев проведено повторное обследование. По результатам было принято решение о госпитализации и подготовке к операции. Объем хирургического вмешательства — радикальная коррекция дефекта в условиях искусственного кровообращения. Была поставлена заплата из собственного перикарда (сумки, окружающей сердце), проведено ушивание митрального клапана. Послеоперационный период протекал без особенностей. При дальнейшем наблюдении состояние пациента оставалось стабильным.
Схема диагностики
Как обследовать ребенка при подозрении на врожденные пороки сердца? Схема диагностики такова:
- Физикальный осмотр. Оценивается общее состояние, подсчитывается пульс и частота дыхания. Особого внимания заслуживает цвет кожных покровов и слизистых оболочек (важно выявить бледность или цианоз). Проводится аускультация (прослушивание) сердца и легких.
- Инструментальные исследования. В случае выявления отклонений при физикальном осмотре показано дополнительное обследование. Нужно выявить порок сердца, установить его разновидность, оценить степень нарушения гемодинамики.
Аускультация сердца — ключевой момент в первичной диагностике врожденных пороков. Оценка сердечных тонов проводится неонатологом в родильном доме или педиатром на приеме. Важно помнить, что сердечные шумы выявляются у 60—70 % новорожденных в течение первой недели жизни, однако это не всегда говорит о патологии. Зачастую они связаны с перестройкой кровообращения и являются вариантом нормы.
Шумы, вызванные нарушениями гемодинамики при ВПС, обычно выявляются на 4—5-й день жизни или позже. Внимания заслуживают шумы, сохраняющиеся более 3 дней, а также сочетающиеся с признаками сердечной недостаточности:
- одышкой;
- учащенным сердцебиением и дыханием;
- отеками конечностей;
- увеличением печени;
- усиленной потливостью;
- снижением диуреза;
- слабым сосанием груди (у новорожденных и детей до года).
Отсутствие шума в сердце не исключает порока его развития. Если есть иные симптомы патологии, нужно обязательно провести обследование пациента.
При выявлении патологических шумов или иных признаков ВПС ребенок попадает под наблюдение кардиолога и обследование продолжается:
- Электрокардиография (ЭКГ) — оценка основных показателей работы сердца.
- ЭхоКГ — ультразвуковое исследование сердца. На экране врач видит двух- или трехмерное изображение, может выявить дефекты развития сердца, оценить ток крови.
- Пульсоксиметрия — позволяет оценить степень насыщения крови кислородом и выявить гипоксию (кислородную недостаточность).
- Рентгенография грудной клетки. Проводится для оценки размеров сердца. Помогает выявить некоторые пороки. Оценивается также состояние легочного рисунка. Его изменения говорят о нарушении тока крови по малому (легочному) кругу кровообращения и помогают в диагностике многих ВПС.
- Компьютерная томография. Позволяет получить подробное изображение камер сердца и близлежащих сосудов. В качестве альтернативы рассматривается МРТ.
- Катетеризация сердца. Проводится только после полного эхографического обследования, дает более подробную информацию о работе органа.
Неонатальный скрининг
Согласно протоколу, всем новорожденным рекомендуется проводить пульсоксиметрию непосредственно в родильном доме (или в отделении патологии новорожденных, если младенец был туда госпитализирован). Тест проводится в первые 24—48 часов жизни. Он позволяет выявить недиагностированные внутриутробно пороки, в том числе критические (ВПС, угрожающие жизни ребёнка). Допускается проведение теста в первые сутки после рождения при ухудшении состояния малыша.
Пульсоксиметрию проводит медсестра отделения новорожденных. Выполняется оценка степени насыщения кислородом (SaO2) на правой руке и ноге. Результаты теста оценивает врач:
- Отрицательный тест — SaO2 более 95 % на обеих конечностях; разница между показателями на руке и ноге не более 3 %. Это хороший результат, он говорит о том, что кровоток не нарушен.
- Положительный тест — SaO2 менее 95 % на одной конечности и 90—95 % на другой или менее 90 % на руке и ноге; разница составляет более 3 %. Это неблагоприятный результат — требуются консультация кардиолога и дообследование.
Золотым стандартом диагностики ВПС считается эхоКГ. Полный объем обследования определяется лечащим врачом с учетом конкретной клинической ситуации.
Диагностика пороков сердца у детей
При первичном осмотре педиатр, неонатолог или детский кардиолог проводит осмотр, аускультацию возможных шумов в сердце. Проверяется наличие отечности, одышки, нарушений ритма сердца, проблемы с физическим или интеллектуальным развитием. По результатам осмотра решается вопрос о необходимом обследовании.
Эхокардиография сердца (ЭхоКГ) – объединяет в себе УЗИ сердца и кардиограмму. Метод определяет ритмограмму и структурные изменения в сердце. ЭхоКГ информативный метод.
Рентгенология показывает реальные размеры сердца, его камер и соотношение органа с размером грудной клетки.
Коронарография – через вены или артерии на руке, паху, или шеи (только через вену) вводят катетер, который достигает сердца. Затем по нему пропускают контрастное вещество. Этот метод определяет сократительную функцию сердца.
В медицинском используется оборудование экспертного класса от производителей с мировым именем.
Задача детского отделения Медицинского — предоставить полный комплекс медицинской помощи от профилактики до лечения, при появлении симптомов порока с момента рождения до 18 лет.
В нашем детском отделении прием ведут врачи, которые прошли специальную подготовку для выявления нарушений здоровья у детей и младенцев, с учётом всех возрастных особенностей.
Детские врачи клиники “Парацельс” работают по принципам доказательной медицины (международным протоколам, составленным на основе клинических испытаний). Это сводит к минимуму вероятность постановки ложного диагноза.
Большая роль в ранней диагностике пороков сердца у детей принадлежит родителям. От того, насколько родители внимательно следят за здоровьем своего ребенка, насколько правильно смогут описать его состояние врачу, зависит в каком направлении будет проводиться предварительное обследование.
Методы лечения пороков
Принцип лечения определяется индивидуально. Мы учитываем существующие протоколы, рекомендации и определяем тактику ведения пациента с учетом типа порока, состояния кровотока, других параметров.
Принимают ли лекарства
Нельзя избавиться от анатомического дефекта за счет таблеток или уколов. Мы назначаем ребенку медикаменты только на этапе подготовки к операции. Используются препараты из различных групп:
- гликозидные сердечные средства;
- АПФ-ингибиторы;
- блокаторы кальциевых каналов;
- антагонисты рецепторов к альдостерону;
- вазодилататоры;
- диуретики.
Цели такого лечения — скомпенсировать возникшую сердечную недостаточность и облегчить состояние больного. В ряде случаев медикаментозная терапия продолжается и после операции (особенно, если вмешательство не было радикальным).
В дополнение к основной терапии назначаются витамины. Показана санация очагов хронической инфекции для профилактики бактериальных осложнений. При недостаточности кровообращения проводится оксигенотерапия — насыщение крови кислородом.
Хирургия и показания к ней
Операция требуется, если наблюдается:
- критический ВПС у новорожденного;
- признаки острой, застойной кардионедостаточности;
- сильная легочная гипертензия (повышение давления в сосудах легких);
- значительное снижение насыщения тканей кислородом;
- нарушение работы клапанов сердца;
- выраженная задержка физического развития;
- нарушение работы других органов на фоне порока сердца.
Варианты хирургического вмешательства:
- Радикальная операция — полная анатомическая коррекция порока, устранение аномалий развития.
- Коррекция гемодинамики — разделение кровотока на венозный и артериальный. Она проводится в том случае, если полностью восстановить целостность сердца и устранить порок нельзя.
- Паллиативная операция — хирургическое вмешательство, при котором не происходит исправления дефекта. Цель такого лечения — временно улучшить ток крови, избежать развития осложнений. Нередко становится подготовительным этапом к дальнейшей радикальной или гемодинамической операции.
Таблица ниже приводит объемы и сроки для хирургического лечения самых распространенных пороков.
| ВПС | Объем | Сроки операции |
| Дефект перегородки между желудочками | Пластика заплаткой из ксеноперикарда, чрескатетерное закрытие окклюдером (заплаткой из стальных нитей) | 1 месяц при быстром нарушении гемодинамики; 4—6 месяцев при умеренном нарушении кровотока; До 2-х лет при компенсированном ВПС |
| Дефект перегородки между предсердиями | Радикальная операция: пластика дефекта заплаткой | От 2-х до 5-и лет |
| Незакрытие артериального протока | Клипирование, перевязка сосуда | 1—5 лет |
| ТМА (взаимоперемещение аорты и легочного ствола) | У новорожденных — предварительно расширяют межпредсердное сообщение. С 3-х до 6-и месяцев делают гемодинамическую операцию | 1-й месяц, второй триместр I года. |
| Атриовентрикулярная коммуникация | Радикально: пластика перегородки между предсердиями и створок | Полная форма с 3-х до 6-и месяцев; неполная форма с 1-го до 2-х лет |
Хирургическое лечение выполняется в двух вариантах:
- Закрытая операция. Возможно эндоваскулярное вмешательство, когда все манипуляции проводятся без разрезов, через сосуды. Наркоз не требуется, достаточно местной анестезии. К закрытым относятся и операции, при которых проводится вскрытие грудной клетки без доступа к сердечным камерам.
- Открытая операция. Проходит в условиях искусственного кровообращения. В ходе операции вскрываются камеры сердца. Так выполняются все сложные реконструктивные вмешательства.
Как пройдет беременность при пороке сердца у матери?
Прогноз беременности зависит от степени и сочетания поражения, а также от активности ревматического процесса (другими словами, от того, имеется ли в данный момент его обострение) и от выраженности нарушения кровообращения.
Вопрос о сохранении или прерывании беременности решается коллегиально кардиологом и акушером-гинекологом в каждом случае индивидуально. Если беременность наступила после операции на сердце, нужна консультация кардиохирурга. Следует знать, что далеко не всегда корригирующие операции на сердце приводят к ликвидации органических изменений в клапанном аппарате или устранению врожденных аномалий развития. Нередко после хирургического лечения наблюдается рецидив основного заболевания, например, в виде рестеноза (повторного сужения) после некоторых операций.
Чрезвычайно сложно решить вопрос о допустимости беременности у женщин с протезированными клапанами сердца. У них высока опасность образования тромбов, поэтому беременные с механическими клапанами постоянно получают антикоагулянтную (противосвертываюшую) терапию.
Конечно, вопрос о сохранении беременности у женщин с сердечно-сосудистыми заболеваниями лучше решать заблаговременно, до ее наступления. Основой правильного ведения и лечения таких беременных является точная диагностика, учитывающая причину заболевания.
Пороки со сбросом крови направо служат противопоказанием к беременности, как и любой вид пороков с декомпенсацией, при которых уже сформирована недостаточность кровообращения.
Последствия: что будет, если не лечить?
Врожденный дефект сердца — это не та ситуация, которую можно пустить на самотек. Без лечения ВПС ведет к развитию осложнений:
- сердечная недостаточность — состояние, при котором орган неспособен выполнять свою работу;
- нарушение ритма;
- инфекционный эндокардит — бактериальное поражение клапанов сердца;
- бронхолегочные заболевания (бронхит, пневмония).
Все эти состояния существенно нарушают нормальное течение жизни, препятствуют полноценному развитию и могут вызвать инвалидность.
Как рожать здоровых детей? Совет специалиста
Первичная профилактика — это устранение всех факторов, способных привести к рождению ребенка с пороком сердца. Для этого рекомендуется:
- Сделать будущей матери прививку против краснухи до зачатия. Доказано, что это заболевание ведет к появлению у плода тяжелых ВПС. Планировать беременность можно спустя 3 месяца после вакцинации.
- Поднять иммунитет. В I триместре повышается подверженность инфекциям. Нужно своевременно позаботиться об укреплении иммунитета. Важно следить за рационом, зимой и весной принимать витамины.
- Быть осторожной. Избегать самолечения и обращаться к врачу. Многие лекарственные препараты запрещены будущим мамам: они могут стать причиной аномалий развития плода.
- Отказаться от вредных привычек. При планировании беременности нельзя курить и злоупотреблять алкоголем.
- Пройти лечение. Сахарный диабет и ожирение у женщины повышают риск развития пороков сердца у плода. Нужно сбросить вес и научиться контролировать сахар в крови до зачатия ребенка.
Во время беременности ведется вторичная профилактика. Уже нельзя предупредить появление ВПС, но можно обнаружить их в первой половине гестации — до 20—22 недель. Для этого женщина должна регулярно проходить пренатальные ультразвуковые скрининги в установленные сроки:
- 12—14 недель;
- 18—21 неделя.
УЗИ выполняется всем без исключения пациенткам, но есть группа особого риска — те, у кого вероятность рождения ребенка с ВПС выше. Это женщины, перенесшие вирусную инфекцию в первом триместре, страдающие диабетом и ожирением, принимающие запрещенные лекарства на ранних сроках, имеющие возраст старше 35 лет. Им однозначно не стоит отказываться от УЗИ — быстрого и безопасного способа внутриутробной диагностики пороков сердца.
Важно помнить, что ВПС плода нередко сочетаются с хромосомными аномалиями, поэтому требуются консультация генетика и кариотипирование.
После обнаружения на УЗИ уточняет диагноз ФЭхКГ. Фетальная эхокардиография считается совершенно безопасным методом и проводится на любом сроке беременности.
Врожденные пороки сердца
Этиология врожденных пороков сердца может быть обусловлена хромосомными нарушениями (5%), генной мутацией (2-3%), влиянием факторов среды (1-2%), полигенно-мультифакториальной предрасположенностью (90%).
Различного рода хромосомные аберрации приводят к количественным и структурным изменениям хромосом. При хромосомных перестройках отмечаются множественные полисистемные аномалии развития, включая врожденные пороки сердца. В случае трисомии аутосом наиболее частыми пороками сердца оказываются дефекты межпредсердной или межжелудочковой перегородок, а также их сочетание; при аномалиях половых хромосом врожденные пороки сердца встречаются реже и представлены, главным образом, коарктацией аорты или дефектом межжелудочковой перегородки.
Врожденные пороки сердца, обусловленные мутациями единичных генов, также в большинстве случаев сочетаются с аномалиями других внутренних органов. В этих случаях сердечные пороки являются частью аутосомно-доминантных (синдромы Марфана, Холта-Орама, Крузона, Нунана и др.), аутосомно-рецессивных синдромов (синдром Картагенера, Карпентера, Робертса, Гурлер и др.) или синдромов, сцепленных с Х-хромосомой (синдромы Гольтца, Аазе, Гунтера и др.).
Среди повреждающих факторов внешней среды к развитию врожденных пороков сердца приводят вирусные заболевания беременной, ионизирующая радиация, некоторые лекарственные препараты, пагубные привычки матери, производственные вредности. Критическим периодом неблагоприятного воздействия на плод являются первые 3 месяца беременности, когда происходит фетальный органогенез.
Внутриутробное поражение плода вирусом краснухи наиболее часто вызывает триаду аномалий – глаукому или катаракту, глухоту, врожденные пороки сердца (тетраду Фалло, транспозицию магистральных сосудов, открытый артериальный проток, общий артериальный ствол, клапанные пороки, стеноз легочной артерии, ДМЖП и др.). Также обычно имеют место микроцефалия, нарушение развития костей черепа и скелета, отставание в умственном и физическом развитии.
Кроме краснухи беременной, опасность для плода в плане развития врожденных пороков сердца представляют ветряная оспа, простой герпес, аденовирусные инфекции, сывороточный гепатит, цитомегалия, микоплазмоз, токсоплазмоз, листериоз, сифилис, туберкулез и др.
В структуру эмбриофетального алкогольного синдрома обычно входят дефекты межжелудочковой и межпредсердной перегородки, открытый артериальный проток. Доказано, что тератогенное действие на сердечно-сосудистую систему плода оказывает прием амфетаминов, приводящий к транспозиции магистральных сосудов и ДМЖП; противосудорожных средств, обусловливающих развитие стеноза аорты и легочной артерии, коарктации аорты, открытого артериального протока, тетрады Фалло, гипоплазии левых отделов сердца; препаратов лития, приводящих к атрезии трехстворчатого клапана, аномалии Эбштейна, ДМПП; прогестагенов, вызывающих тетраду Фалло, другие сложные врожденные пороки сердца.
У женщин, страдающих преддиабетом или диабетом, дети с врожденными пороками сердца рождаются чаще, чем у здоровых матерей. В этом случае у плода обычно формируются ДМЖП или транспозиция крупных сосудов. Вероятность рождения ребенка с врожденным пороком сердца у женщины с ревматизмом составляет 25 %.
Кроме непосредственных причин, выделяют факторы риска формирования аномалий сердца у плода. К ним относят возраст беременной младше 15-17 лет и старше 40 лет, токсикозы I триместра, угрозу самопроизвольного прерывания беременности, эндокринные нарушения у матери, случаи мертворождения в анамнезе, наличие в семье других детей и близких родственников с врожденными пороками сердца.