Что представляет собой аневризма аорты?
Аневризмой называют увеличение просвета сосуда более чем в 2 раза на ограниченном участке вследствие его истончения или растяжения. При этом образуются выпячивания или карманы, в результате чего нарушается кровоток. Обычно патология возникает из-за аномального процесса в соединительной ткани. При этом внутренняя часть стенки истончается, под высоким напором крови она растягивается и начинает выпячиваться. Со временем это явление прогрессирует и аневризма увеличивается.
Аорта является одним из основных кровеносных сосудов человека, обеспечивая оксигенированной кровью практически все органы. Также расширение корня аорты (особенно синуса Вальсавы) может привести к сдавливанию коронарных артерий, питающих сердечную мышцу, что часто заканчивается развитием ишемической болезни. Одним из опаснейших осложнений аневризмы аорты является ее разрыв, который приводит к внезапной смерти.
Выделяют три основные формы аневризмы грудной аорты:
- мешотчатая (стенка выпячивается незначительно на небольшом участке);
- расслаивающаяся (формируется в результате надрыва интимы);
- веретенообразная (аорта сердца расширена по всей окружности).
Коарктация аорты у плода. Точность и ошибки диагностики
УЗИ сканер HS60
Профессиональные диагностические инструменты.
Оценка эластичности тканей, расширенные возможности 3D/4D/5D сканирования, классификатор BI-RADS, опции для экспертных кардиологических исследований.
Большинство врожденных пороков сердца (ВПС) относятся к заболеваниям, ставящим под угрозу здоровье или жизнь новорожденного. Опыт российских и зарубежных коллег показывает, что частота врожденных пороков сердца колеблется от 10 до 13 случаев на 1000 новорожденных, из них 4:1000 составляют сложные ВПС. В нашей стране средняя частота ВПС колеблется от 8-9 до 11-13 случаев на 1000 живорожденных. От сердечной патологии в раннем младенчестве погибает до 50% новорожденных.
Распределение диагностики ВПС в зависимости от нозологической формы значительно варьирует. Определенные ВПС пренатальная диагностика позволяет выявить в 90% случаев. Цифры статистики неумолимо показывают низкий процент выявления ВПС (30%) по результатам скринингового исследования. В специализированных учреждениях частота выявления ВПС выше и достигает 54% [1, 2].
Точность ультразвуковой диагностики патологии плода за последние годы многократно подвергается критике со стороны акушеров-гинекологов и в большей степени педиатров. Порой клинические признаки интересуют специалистов значительно меньше, чем данные ультразвукового антенатального исследования плода.
В этой работе представлен анализ возможностей ультразвукового пренатального исследования при коарктации аорты. В работе учтены данные, имеющиеся в публикациях отечественных и зарубежных авторов, а также материал отделения функциональной диагностики Центра.
Латинский термин «сoarctatius» означает «суженный, стиснутый». Впервые его описал J.F. Meckel в 1750 году. Коарктация аорты — это патологическое сужение ее просвета, которое может возникнуть в любом месте по всей ее длине. Частота порока составляет 6,3%, по данным клинических наблюдений из выборки в 2000 случаев [3], и 8,4% по результатам патологоанатомического материала [4].
У детей первого года жизни коарктация аорты занимает четвертое место cреди ВПС. Как правило, она развивается дистальнее места ответвления левой подключичной артерии вблизи артериального протока (ductus arteriosus). В зависимости от локализации сужения аорты относительно артериального протока различают два классических типа коарктации: предуктальную и постдуктальную [5].
При наличии сужения аорты клиническая картина может нарастать как шквал после закрытия артериального протока. В течение первого года погибают 56% пациентов. В основном смертельный исход бывает вызван сочетанием коарктации с другими аномалиями сердца. Изолированная форма в первые недели и дни жизни также характеризуется высоким процентом смертности (34%). Если этот период дети переживают, то продолжительность жизни в среднем составляет 30-50 лет. Причиной смерти у новорожденных является сердечно-легочная недостаточность. При артериальной высокой гипертензии, как исключение, может быть кровоизлияние в мозг.
В ФГБУ «Научный центр акушерства, гинекологии и перинатологии им. В.И. Кулакова » Минсоцразвития РФ за двухлетний период (2010-2011) родились 27 детей с аномалиями аорты, от незначительного сужения до полного перерыва. В 15 наблюдениях в отделении функциональной диагностики диагноз был поставлен антенатально. Это были беременные, обратившиеся в поздние сроки от 35 до 39 нед гестации. Во всех наблюдениях патология аорты сочеталась с гипоплазией левого желудочка. Диагноз был подтвержден во всех случаях. В изолированном виде коарктация аорты за этот период была диагностирована в 6 наблюдениях. В 3 из них диагноз был поставлен антенатально, в 2 — сужение было выявлено у новорожденных на 3-5-е сутки после закрытия артериального протока. В одном случае после рождения был поставлен диагноз кинкинг аорты. Таким образом, наши данные свидетельствуют о сложности и невысоком проценте выявления изолированной коарктации аорты. Лишь в тех наблюдениях, когда имеются выраженные гемодинамические нарушения, приводящие к значительным анатомическим изменениям в виде гипоплазии левого желудочка, диспропорции желудочков сердца, увеличения диаметра легочной артерии диагноз с большой достоверностью может быть поставлен антенатально.
Первые работы по диагностике коарктации аорты у плода относятся к 1984 г. [6, 7]. По данным литературы, трансвагинальный доступ в 12-15 нед гестации позволяет диагностировать коарктацию аорты в 21,4% случаев [1]. При трансабдоминальном доступе частота выявления коарктации аорты увеличивается: в 16-30 нед она составляет 43%, после 30 нед, по мере прогрессирования гемодинамических нарушений, не превышает 54% [8].
Согласно результатам скринингового ультразвукового обследования 20 248 плодов при сроках 19-22 нед беременности в крупном регионе Германии (1990-1994) пренатальный диагноз коарктации аорты не был установлен ни в одном из 7 случаев. Аналогичные данные были получены в Норвегии, даже в специализированном центре пренатальной диагностики. Согласно данным мультицентрового анализа, проведенного в 12 европейских странах, точный пренатальный диагноз изолированной коарктации аорты в конце 90-х гг. был установлен только в 9 (15,8%) из 57 случаев [9]. Средний срок обнаружения изолированной коарктации составил 22 нед, при этом 7 из 9 случаев было выявлено до 24 нед. При сочетании коарктации аорты с экстракардиальными пороками и хромосомными аномалиями точность ее пренатальной диагностики была существенно выше за счет выраженности гемодинамических нарушений и расширенного эхокардиографического исследования плода и составила 52%.
По данным института сердечно-сосудистой хирургии им. А.Н. Бакулева, точность диагностики не превышает 27%. Как правило, патология наиболее часто отмечается при сочетании коарктации аорты с другими кардиальными аномалиями [10].
Таким образом, обобщая статистические данные материала Центра, публикации ведущих специалистов России и зарубежных коллег, можно отметить очень низкий процент диагностики коарктации аорты у плода.
В чем же причина столь низкого процента выявления коарктации аорты антенатально?
Существует несколько факторов, затрудняющих диагностику коарктации аорты антенатально.
Первая причина не диагностированной коарктации аорты это морфогенез патологии и теория первичного нарушения развития дуги аорты. Теория была предложена в 1828 г. [11]. Автор считает, что данная патология связана с недостаточным соединением 4 и 6 дуги аорты с нисходящим ее отделом. Поэтому перешеек — это место, где наиболее часто локализуется участок сужения [12], так как оба отдела образуются из разных эмбриональных зачатков. В норме область перешейка аорты равна 2/3 диаметра восходящего отдела аорты (рис. 1).
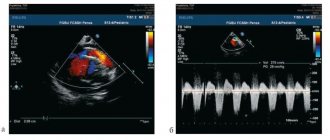
энергетического допплера, норма)»/>
Рис. 1.
Восходящий отдел, дуга и нисходящий отдел аорты плода в режиме энергетического допплера в норме.
Согласно «теории дуктальной ткани» коарктация аорты возникает в результате миграции гладких мышечных клеток протока в предуктальную аорту, с последующей констрикцией и сужением просвета аорты [4]. При формировании коарктации аорты в области перешейка сохраняется сужение различной протяженности и формы (рис. 2, 3). Наиболее часто это проявляется в виде локальной перетяжки, выше или ниже которой диаметр аорты сохраняется в норме.
Рис. 2.
Ультразвуковое исследование восходящего отдела, дуги и нисходящего отдела аорты. Стрелкой указано место сужения.
Рис. 3.
Трехмерное изображение сердца и аорты плода в 16 нед беременности. Стрелкой указано место сужения аорты. AO DESC — нисходящий отдел аорты, COR — сердце.
Следовательно, оценка сужения аорты в типичном месте как признак развивающейся патологии не всегда представляется возможной в ранние сроки беременности. Поскольку речь идет о предуктальной коарктации аорты (сужение аорты локализовано проксимальнее протока), то, очевидно, что в период внутриутробной жизни в более поздние сроки отмечается снижение кровотока через левые отделы сердца и перешеек аорты и развивается гипоплазия левого желудочка и аорты. Это и способствует более позднему проявлению патологии и возможности ее ультразвуковой диагностики.
Вторая причина, затрудняющая диагностику коарктации аорты — это теория постнатального развития. У плода перешеек аорты узкий и после рождения и закрытия артериального протока он должен в норме расшириться для обеспечения адекватного кровотока в нисходящий отдел аорты. Таким образом, имеющееся физиологическое сужение перешейка аорты не позволяет предположить формирование коарктации аорты после рождения.
Постдуктальная коарктация развивается уже после рождения и практически всегда представляет собой изолированный дефект. Эта аномалия, вероятнее всего, является результатом разрастания мышечной ткани артериального протока в аорту плода. Когда же проток после рождения сужается, эктопическая ткань внутри аорты также сжимается, перекрывая, как тампоном, просвет сосуда по всей его окружности. В отличие от предуктальной коарктации в данном случае гипоплазия аорты не развивается. Закрытие артериального протока у некоторых детей приводит к наличию сужения аорты и развитию коарктации через 2-3 нед после рождения [13].
Третья причина не диагностированной коарктации аорты состоит в особенностях внутрисердечной гемодинамики у плода. Кровообращение плода, так же, как и взрослого, подчиняется ряду основных закономерностей физического и биологического воздействия. Поток крови движется из зоны высокого давления в область низкого давления. При выраженном потоке размеры увеличиваются, при уменьшении объема потока уменьшаются. Так, гипоплазия левого желудочка и коарктация аорты часто сопутствуют порокам со сниженным выбросом крови в аорту (стеноз аорты, дефект межжелудочковой перегородки) и практически не встречаются при пороках с большим объемом потока через аорту (при тетраде Фалло).
Исходя из особенностей внутрисердечной гемодинамики плода, для диагностики коарктации аорты были предложены косвенные признаки патологии в антенатальном периоде: дилатация правого желудочка и его гипертрофия (см. рис. 3), дилатация легочной артерии [6, 7, 14]. Авторы считают, что это достоверные признаки и встречаются они достаточно часто (в 18 из 24 случаев верифицированных диагнозов коарктации аорты). Поэтому была предложена оценка индексов отношения полости правого желудочка к левому (в норме — 1,1) и легочной артерии к аорте (у здоровых — 1,2). Исходя из увеличения этих параметров, можно предположить наличие затрудненного выброса в аорту или гипоплазию дуги аорты. Тем не менее, по данным предложивших эти косвенные признаки авторов, такие изменения выявляются только в 30% наблюдений (рис. 4).
Рис. 4.
Диспропорция размеров желудочков сердца при коарктации аорты. RV — правый желудочек; LV — левый желудочек; AO DESC — поперечное сечение нисходящего отдела аорты.
Во второй половине 90-х гг. было опубликовано несколько работ, посвященных изучению диагностической ценности увеличения правого желудочка и уменьшения левого желудочка при коарктации аорты. Авторы, опубликовавшие эти результаты [2], считают, что чем раньше проводится исследование (от 14-16 до 25 нед гестации), тем оно информативнее для диагностики коарктации аорты. Доказательством могут служить данные, полученные D. Brown и соавт. [15]. В представленных исследованиях коарктация аорты отмечена у 8 (62%) из 13 плодов с диспропорцией размеров желудочков до 34 нед и только у 6 (21%) из 29 плодов после 34 нед беременности. Несмотря на то, что более половины случаев коарктации аорты сопровождается диспропорцией размеров желудочков, что достаточно легко выявляется при изучении четырехкамерного среза сердца плода, во многих исследованиях в Норвегии она не была диагностирована, даже при обязательном скрининговом изучении размеров сердца до 18 нед беременности [9].
Такие прoтиворечивые результаты можно объяснить гемодинамической теорией [16, 17]. Внутриутробно в восходящий отдел аорты поступает 50% суммарного выброса крови, в нисходящую — 65%, а через перешеек аорты всего лишь 25%. Исходя из уменьшенного объема кровотока возникает его физиологическое сужение, которое усугубляется лишь после рождения.
Допплеркардиография, позволяющая оценить кровоток, информативна лишь при выраженном сужении аорты [18]. При этом возникает обратная зависимость максимальной скорости кровотока в восходящем и нисходящем отделах аорты. В норме скорость в восходящем отделе немного преобладает над скоростью нисходящего отдела.
При перерыве дуги аорты отмечается ретроградный кровоток заполнения участка дуги аорты после перерыва через открытый артериальный проток и отсутствие прямого кровотока на уровне перерыва.
И, наконец, последняя причина не диагностированной коарктации аорты заключается в частоте сочетания с другими аномалиями сердца. Изолированная коарктация аорты составляет всего лишь 15-18%. По данным M. Campell и P. Polani [19], процент сочетания коарктации аорты с кардиальными аномалиями колеблется от 13 до 18%. Наиболее часто (85%) коарктация аорты сочетается с двустворчатым аортальным клапаном [20], нередко сочетается с фиброэластозом эндомиокарда, распространяющимся на выходной тракт левого желудочка и на межжелудочковую перегородку. Возможно, при коарктации аорты аномальное отхождение правой подключичной артерии или обеих подключичных артерий от нисходящей аорты, дистальней коарктации (5%).
Наличие сопутствующей кардиальной патологии может нивелировать типичные для коарктации гемодинамические изменения со стороны сердца плода, на которые обязательно обращает внимание специалист при ультразвуковом исследовании.
Существует еще и понятие как псевдокоарктация, или «кинкинг» аорты — деформация аорты, аналогичная классической коарктации, но препятствие кровотоку незначительное, так как имеется простое удлинение и извилистость аорты (рис. 5).
Рис. 5.
Кинкинг аорты у плода в 34 нед беременности. Исследование в энергетическом режиме.
Итак, становится очевидным, что практически ни один из ультразвуковых признаков в антенатальном периоде не имеет высокой степени диагностической точности.
Известно, что диагноз данного порока сердца опирается на прямой признак — визуализацию места сужения аорты, и, возможно, расширение проксимального отдела аорты. Однако четко визуализировать участок сужения аорты у плода достаточно трудно и удается только в единичных наблюдениях. Порок можно увидеть лишь тогда, когда имеется уменьшение диаметра перешейка аорты более чем на 1/3 по сравнению с нормой для каждого срока беременности (см. рис. 2, 3).
Ключом к пренатальной диагностике коарктации аорты является комплексный учет данных, получаемых как при изучении четырехкамерного среза сердца (дилатация правого желудочка, гипоплазия левого желудочка), так и при оценке самих главных артерий. При наличии коарктации диаметр аорты в среднем в 2 раза меньше диаметра дилатированной легочной артерии. Поэтому для диагностики коарктации аорты следует использовать визуализацию самой аорты, что наиболее целесообразно при скрининговой оценке среза через три сосуда. Помощь в диагностике может оказать измерение диаметра артериального протока, который при коарктации аорты широкий.
Окончательный диагноз коарктации аорты устанавливается при использовании среза через дугу аорты, так как чаще всего сужение аорты отмечается в области ее перешейка — на уровне впадения артериального протока. Следует отметить, что сужение может охватывать большой участок аорты вплоть до тубулярной гипоплазии. Нормальный переход дуги аорты в артериальный проток в норме гладкий и плавный. Кроме того, при исследовании аорты по длинной оси наиболее надежным признаком следует считать гипоплазию поперечной части дуги аорты. Как один из косвенных признаков коарктации аорты можно использовать извилистость дуги аорты при изучении ее по длинной оси [2].
Важное дополнительное значение имеет допплерэхокардиографическое исследование, которое при коарктации орты позволяет выявить ускорение и турбулентный характер кровотока в аорте. Однако в антенатальном периоде этот признак может не проявиться [2]. Более надежно выявление левоправого шунта через овальное окно. Предполагается, что этот шунт является компенсаторным механизмом, обеспечивающим уменьшение потока крови в левый желудочек и аорту. G. Sharland и соавт. [18] отметили левоправый шунт через овальное окно у 7 из 12 плодов с коарктацией аорты. У оставшихся 5 плодов обнаруживалось как левоправое, так и праволевое направления потоков крови через овальное окно.
В случаях резко выраженных анатомических изменений аорты и функции левого желудочка с увеличением постнагрузки может наблюдаться сердечная недостаточность [21]. Нарушения гемодинамики и сердечная недостаточность характеризуются антенатально наличием выпота в перикарде, уменьшением сердечного выброса с уменьшением размеров левого желудочка [22].
После рождения и закрытия артериального протока весь поток крови поступает в восходящий отдел аорты и перешеек расширяется до нормального уровня. После рождения, когда проток перекрывается, коарктация аорты приводит к серьезными клиническим проявлениям.
Итак, анализ возможностей и ошибок ультразвуковой диагностики коарктации аорты в пренатальном периоде показывает насколько проблематично поставить диагноз во всех случаях данного порока сердца у плода. К сожалению, все эхокардиографические антенатальные признаки патологии не обеспечивают высокий процент диагностики.
Хочется надеяться, что развитие новых технологий и накопление позитивного и анализ негативного опыта позволят в будущем повысить процент диагностики такого сложного порока сердца с высокой неонатальной смертностью.
Литература
- Bronshtein M., Zimmer E.Z. Sonographic diagnosis of fetal coarctation of aorta at 14-16 weeks of gestation // Ultrasound Obstetric Gynecologie. 1998. N 11. Р. 254-257.
- Allan L.D., Cook A.C., Huggon I.C. Fetal Echocardiographiy. A practical guide. Cambridge University Press. 2009. P. 258.
- Frederiksen T. Coarctation of the aorta. A genetic study // Acta genet.1963. V. 13. Р. 263.
- Банкл Г. Врожденные пороки сердца и крупных сосудов. М.: Медицина, 1980.
- Oztunc F., Eroglu A.G., Aksoy F. et al. Antenatal diagnosis of posductal coarctation of the aorta report // Turk journal Pediatr. 2001. V. 43. N 1. P. 67-69.
- Allan L.D., Crawford D.C., Tynan M. Evolution of coarctation of the aorta in intrauterine life // Br. Heart J. 1984. V. 52. P. 471.
- Allan L.D., Crawford D.C., Anderson R.H. et al. Echocardiography and anatomical correlations in fetal congenital heart disease // Br. Heart J. 1984. V. 52. P. 542.
- Franklin O., Burch M., Manning N. et al. Prenatal diagnosis of coarctation of the aorta improves survival and reduces morbility // Heart. 2002. V. 87. N 11. P. 67-69.
- Norbenger L.K., Sahn D.J., Kleimann C.S. et al. Antenatal diagnosis of coarctation of the aorta: a multicenter experience // J. Am. Coll. Cardiologie. 1994. V. 23. P. 417-423.
- Беспалова У.Д., Суратова О.Г., Тюменева А.И., Гасанова Р.М. Ультразвуковая диагностика врожденных пороков сердца у плода / Под ред. Бокерия Л.А. М., 2009.
- Rosenberg H. Coarctation of the aorta; Morphology and pathogenesis considerations. In: Perspectives in Pediatric Pathology. V. 1. Chicago, Year Book, 1974.
- Patten B.M. The changes in circulation after birth // Am. Heart J. 1930. V. 6. P. 192.
- Бураковский В.И., Бокерия Л.А. Сердечно-сосудистая хирургия. М.: Медицина, 1989.
- Allan L.D., Chita S.K, Anderson R.H, Fagg N., Crawford D.C., Tynan M.J. Coarctation of the aorta in prenatal life: and echocardiographic, anatomical and functional study // Brit. Heart J. 1988. V. 59. P. 356.
- Brown D.L., Durfee S.M., Hornberger L.K. Ventriculal disgrepancy as a sonographic sign of coarctation of the aorta: how reliable is it? // J. Ulytrasound Med. 1997. V. 16. N 2. P. 95-99.
- Rudolf A., Heyman M.A., Spitznas U. Hemodynamic consideratiоns in the developement of narrowing of the aorta // Am. J. Cardiolog. 1972. V. 30. P. 514.
- Palmer N.S., Berman M.A. Postnatal developement of obstruction in coarctation of the aorta; Role of the ductus arteriosus // Pediatrics. 1975. V. 56. P. 462.
- Sharland G.K., Chan K.Y., Allan L.D. Coarctation of the aorta:difficulties in prenatal diagnosis // Br. Heart J. 1994. V. 71. Р. 70-75.
- Campell M., Polani P.E. Etiology of coarctation of the aorta // Lancet. 1961. V. 1. P. 473.
- Edwards J.E., Burchell H.B. The pathologic anatomy of deficiency betwen the aortic rood and the heart including aortic sinus aneuvrysms // Thorax 1957. V. 12. P. 125.
- Rudolph A.M. Congenital Diseases of the Heart: Clinical-Physiologic Considerations in Diagnosis and Management. Chicago-Year Book. 1974.
- Kleimman C.S., Donnerstein R.L., De Vore G.R. et al. Fetal echocardiography for evaluation of in utero congestive heart failure: A technique for study of nonimmune fetal hydrops. N. Engl. J. Med. 1982.
УЗИ сканер HS60
Профессиональные диагностические инструменты.
Оценка эластичности тканей, расширенные возможности 3D/4D/5D сканирования, классификатор BI-RADS, опции для экспертных кардиологических исследований.
Причины возникновения
К врожденным причинам прежде всего относятся генетические заболевания соединительной ткани:
синдром Марфана;- синдром Элерса-Данлоса;
- болезнь Эрдхайма;
- врожденная недостаточность эластина.
Однако чаще всего данная патология имеет приобретенный характер – вследствие нарушения обмена веществ, инфекционных, воспалительных, аутоиммунных заболеваний или травм:
- атеросклероз;
- аортит вследствие бактериальных или грибковых заболеваний (сепсис, пневмония, туберкулез, сифилис, перикардит);
- аутоиммунные заболевания соединительной ткани (гранулематозВегенера, артериит Такаясу, гигантоклеточный артериит);
- механические повреждения (например, при ДТП или вследствие хирургического вмешательства).
Существует также немало факторов риска, которые значительно повышают риск появления данного заболевания:
- возраст (чаще пожилой, от 55-60 лет);
- пол (в 5 раз чаще у мужчин);
- артериальная гипертензия;
- злоупотребление алкоголем и курение;
- ожирение;
- гиподинамия;
- гиперхолестеринемия, гиперлипидемия.
Аневризма синусов Вальсальвы
Причины:
- Болезнь Марфана.
- Аортоартериит.
- Надклапанный стеноз аорты.
Правый коронарный синус повреждается в 69 % и обычно прорывается в правое предсердие или правый желудочек. Некоронарный синус повреждается в 26 % и обычно прорывается в правое предсердие. Левый коронарный синус повреждается в 5 % случаев.
ЭхоКГ критерии
Одномерная ЭхоКГ:
- Дилатация аорты на уровне синусов Вальсальвы (более 40 мм).
- Признаки сдавления левого предсердия.
- Увеличение дистанции от аортальных створок к подлежащей стенке во время систолы.
- Систолическое выбухание аортальной стенки.
- Гемодинамические проявления в зависимости от того какой синус Вальсальвы поврежден и имеет ли он прорыв. Наличие объемной перегрузки правого предсердия и желудочка, преждевременное открытие клапана легочной артерии характерно для прорыва синуса Вальсальвы в правое предсердие, объемная перегрузка левых отделов наблюдается при прорыве синуса в левый желудочек или предсердие.
Двухмерная ЭхоКГ:
- Выбухание одного или нескольких синусов в парастернальной проекции короткой оси на уровне аортального клапана.
- Непосредственная визуализация аневризмы синуса и места его прорыва.
Допплер-ЭхоКГ:
- Позволяет установить наличие прорыва синуса Вальсальвы в соответствующую камеру сердца и величину регургитантного сброса.
- Оценка систолической функции левого желудочка.
Типичные и нетипичные клинические проявления
В соответствии с характером течения выделяют следующие стадии:
Острая – возникает мгновенно за 2-3 дня как результат инфаркта или массивного воспалительного процесса. Очень быстро заканчивается разрывом, поэтому требует немедленного лечения;- Подострая – чаще всего бывает следствием принесенных сердечных заболеваний или операций в средостении, в результате которых образовываются рубцы. Развивается в течение нескольких месяцев;
- Хроническая – формируется на протяжении длительного периода времени и характеризуется высокой степенью компенсации, из-за чего клиника невыраженная.
Как показывает практика, на начальных этапах данное заболевание почти не проявляется, а его симптомы слишком неспецифичны, из-за чего их выявляют лишь в стадии предразрыва. Все это значительно усложняет раннее диагностирование.
Наиболее выраженными симптомами обладает расширение восходящего отдела, дуги и грудной аорты, что связано с их анатомическим расположением.
При этом выпячивания могут сдавливать органы средостения, что приводит к следующим проявлениям:
- сухой кашель и одышка (бронхи и трахея);
- утрудненное глотание (пищевод);
- брадикардия (блуждающий нерв);
- боль в грудной клетке (чувствительные нервы);
- частые пневмонии, отек (корень легких).
Нисходящий отдел грудной аорты может пережимать симпатическое сплетение, межреберные нервы, что приводит к развитию невралгий и парезов. При компрессии позвонков возникают их деформации, искривление позвоночника.
Нередко бывает так, что болезнь проявляется лишь во время расслоения и разрыва аорты. При этом могут возникать следующие симптомы и синдромы:
- двигательное беспокойство;
- слабость, одышка, потливость;
- цианоз;
- осиплость голоса;
- обморок.
При осмотре наблюдают ассиметрию пульса, давление падает (может вообще не определятся).
При расслоении также могут возникать следующие осложнения:
- геморрагический шок;
- острая сердечная недостаточность;
- гемоторакс;
- гемоперикард (тампонада сердца);
- инсульт.
Признаки и осложнения расширения аорты
В основе патогенеза расширения аорты лежат механический фактор и нарушения гемодинамики в месте дефекта сосуда. Расширению чаще всего подвергаются те участки, которые испытывают наибольшую функциональную нагрузку вследствие большой интенсивности тока крови и высокого давления. Постоянное травмирование внутренней оболочки сосуда ударами пульсовой волны, действие ферментов-протеаз способствуют разрушению эластических волокон и дегенерации аортальной стенки. В зоне аневризмы аорта удлинена, расширена, заполнена тромботическими массами.
Аневризматическое расширение постоянно увеличивается, при этом чем больше диаметр аневризмы, тем выше напряжение ее стенки. В самой аневризме кровь течет медленнее, возникают турбулентные токи и завихрения. В зону расширения поступает обычный объем крови, но в периферический кровоток уходит менее половины, поскольку жидкость распределяется по стенке аорты, а в центральной части ее ток ухудшается завихрениями и тромботическими наложениями. Пристеночный тромбоз несет высокий риск эмболических осложнений.
Аневризма дуги аорты составляет примерно пятую часть всех расширений сосуда, с такой же частотой она поражает нисходящую часть грудного отдела, треть случаев приходится на абдоминальную зону, имеющую большое число ответвлений сосудистых магистралей к органам живота и забрюшинного пространства.
Симптоматика аортальных расширений определяется местоположением и объемом аневризмы, ее длиной и причинами патологии. Нередко наблюдается бессимптомное течение заболевания, либо признаки малочисленны и неспецифичны. Главным симптомом аневризмы обычно становится болезненность, связанная с растяжением сосудистой стенки и давлением аневризматического мешка на соседние ткани.
Аневризма абдоминального отдела сопровождается:
- Периодическими или постоянными болезненными ощущениями в животе без четкой локализации;
- Диспепсическими нарушениями (отрыжка, тяжесть в эпигастральной области, тошнота и рвота, диарея или запоры);
- Снижением веса.
Признаки аневризмы могут возникать вследствие давления ее на желудок и кишечник, а также питающие их сосуды. В ряде случаев появляется сильная абдоминальная пульсация, которую замечает сам больной. При ощупывании в брюшной полости выявляется уплотненное, напряженное и болезненное образование, сокращающееся синхронно с пульсом.
Если аорта расширена в восходящем отделе, то среди признаков появляются загрудинная боль, неприятные ощущения в области сердца подобно тем, которые сопутствуют стенокардии. Эти признаки вызваны сдавлением коронарных сосудов и недостаточностью кровоснабжения миокарда.
При поражении аортального клапана, расширении корня аорты нарастает одышка, учащается пульс, появляются головокружения, возможны обмороки. Крупные расширения сдавливают верхнюю полую вену, что проявляется упорными цефалгиями, отеком лица и верхней части тела.
При расширении дуги аорты сдавливается пищевод с нарушением прохождения по нему пищевых масс, а пациенты предъявляют жалобы на чувство давления в горле, отрыжку, изжогу. Компрессия возвратного нерва провоцирует осиплость голоса, кашель, а вовлечение блуждающего нерва протекает с урежением частоты сердечных сокращений и склонностью к гипотонии.
1 – норма 2 – аневризма восходящей аорты 3 – дуги аорты 4 – нисходящей аорты 5 – брюшной аорты
Аневризмы корня аорты и восходящего сегмента могут сдавливать трахею и крупные бронхи, следствием чего становится одышка, сухой кашель, судорожное дыхание. При компрессии сосудов корня легкого развивается застой в легких и воспалительные изменения в легочной паренхиме.
Крупные расширения грудного отдела могут протекать с болью в левой руке, лопатке, ишемическими изменениями спинного мозга, парезами и параличами.
Пульсирующая аневризма большого диаметра давит на передние поверхности позвонков, вызывая их деструкцию, дегенеративные процессы и смещение с искривлением позвоночника. При сдавлении нервных корешков появляются боль, подобная радикулиту и межреберной невралгии.
Расширение аорты на уровне синусов Вальсальвы может сопровождаться аритмией, а опасным осложнением считается ее разрыв в одну из камер сердца, при котором нарастает одышка, появляются загрудинные боли, учащается пульс, падает артериальной давление и развивается острая сердечная недостаточность.
Расширение аорты может провоцировать серьезные последствия:
- разрыв аневризматического мешка с кровотечением и шоком;
- синдром верхней полой вены;
- истечение крови в полость перикарда, плевры;
- тромбоэмболический синдром с закупоркой сосудов ног, почек, головного мозга;
- флегмоны мягких тканей при инфицировании стенок аневризм.
Диагностика и дифференциация симптомов
Дальнейшее обследование включает в себя следующие методы:
рентген ОГК с контрастированием пищевода;- рентген органов брюшной полости;
- эхокардиография;
- ультразвуковая допплерография грудной аорты;
- КТ или МРТ;
- аортография.
Также очень важное значение имеет проведение дифференциальной диагностики, поскольку немало заболеваний проявляются схожей клиникой. Дифдиагноз аневризмы грудной аорты проводят с:
- опухолями средостения и легких;
- кистами и новообразования перикарда;
- врожденной извитостью аорты;
- интрамуральной гематомой.
Методы лечения
При небольших аневризмах (особенно врожденного происхождения) могут применять выжидательную тактику. Пациенту показано периодическое наблюдение у кардиолога и поддерживающая терапия, направленная на укрепление стенок сосудов. Назначают антикоагулянты, антигипертензивные средства и статины.
Однако чаще всего, ввиду высокой вероятности развития осложнений показано хирургическое лечение.
Показаниями к операции будут:
- диаметр дефекта более 5 см;
- быстрое увеличение размеров;
- расслоение аневризмы
- травматическая этиология.
Существует два основных варианта – открытая и эндоваскулярная операция.
Первая методика – резекция аневризмы аорты, применяется с использованием аппарата искусственного кровообращения на открытом сердце. При этом иссекаются поврежденные участки стенки сосуда и затем проводится ушивание. В некоторых случаях показано протезирование имплантатом.
Предпочтительнее использовать второй вариант как менее травматичный, однако он показан лишь при небольших размерах аневризмы в удобном для доступа месте.
Операцию выполняют следующим образом. Через бедренную артерию заводят катетер, в котором размещен зонд с сосудистым протезом. Как только он подходит к аневризматическому участку, его фиксируют чуть выше расширения и ниже его. При этом вся кровь начинает проходить через искусственную трубку.
После вмешательства больного переводят в отделение интенсивной терапии и назначают препараты для предупреждения тромбозов и инфекционных осложнений.