Кортикальная атрофия представляет собой процесс разрушительного характера, наблюдающийся в коре головного мозга. Наиболее часто нарушение встречается в достаточно преклонном возрасте, также оно может быть связано с изменениями патологического характера, происходящими в организме.
Отклонения, присущие данному заболеванию в большинстве случаев дислоцируются в лобных долях мозга, которые несут ответственность за процессы мышления, также благодаря ним осуществляется контроль за поведением и планированием.
В некоторых случаях процесс может затронуть и другие области мозга, но встречается это гораздо реже. Что характерно, к откровенному слабоумию может привести исключительно обширный процесс. Проявления очагового характера патологического воздействия на способности мозга не имеют.
Процесс атрофии наиболее опасен для людей старшего возраста (за 50 лет), так как именно в это время происходит его медленное прогрессирование. Процент женщин, подверженных данной проблеме гораздо больше, чем мужчин. В конечном итоге кортикальная атрофия ведёт к старческому слабоумию.
Случаи кортикальной атрофии встречаются и у только что рожденных малышей, но это отклонение связано с тяжёлой наследственностью.
Самым известным заболеванием, которое сопровождается разрушением коры головного мозга есть биполушарная кортикальная атрофия, также именуемая, как болезнь Альцгеймера.
Описание
Кортикальная атрофия 1 степени является по своей сути тканевой деструкцией коры головного мозга, обусловленной возрастными переменами структуры нервной ткани или с общими патологическими процессами, которые происходят в человеческом организме. Особенно часто подвергаются патологии лобные доли мозга, но не исключается втягивание и других структурных элементов.
Болезнь протекает с низкой скоростью, на протяжении нескольких лет. В то же время постепенно нарастает симптоматика, зачастую приводящая к возникновению слабоумия. Чаще всего процесс развивается у пожилых пациентов, после пятидесяти лет. Но атрофические явления также могут иметь врожденный характер, то есть появляться по причине наследственной предрасположенности.
Профилактика
Специфической профилактики не существует, но выполнение общепринятых рекомендаций по здоровому образу жизни в какой-то степени способно предупредить или уменьшить выраженность дегенеративных изменений в старости.
- Полноценный сон.
- Физическая активность. Достаточная активность в пожилом возрасте позитивно сказывается на функции головного мозга и замедляет возрастные изменения. У лиц с высокой активностью выявляется меньшая выраженность атрофии — меньше повреждения белого и больше объем серого вещества.
- Достаточная интеллектуальная активность.
- Соблюдение диеты, богатой антиоксидантами, витаминами и омега ПНЖК. Результаты подтверждают возможность эффективного применения рыбьего жира при снижении познавательной способности у пожилых и при болезни Альцгеймера. Часто когнитивные нарушения связаны с дефицитом в организме фолиевой кислоты и витамина B12.
- Отказ от употребления алкоголя и наркотических веществ.
- Устранение факторов риска (повышенное артериальное давление и уровень сахара в крови, нарушения липидного обмена, тревога, депрессия, нарушение сна).
- Своевременное лечение начальных цереброваскулярных расстройств.
- Предупреждение травм головы и инфекций нервной системы.
- Генетическое консультирование лиц, у которых в роду были случаи болезни Альцгеймера.
- Для предупреждения гидроцефалии у детей, которая вызывает атрофию мозга, важно своевременно выявить и пролечить инфекции у беременных.
Примеры патологии
Самые известные примеры такой болезни, как биполушарная кортикальная атрофия (задевающая оба полушария), — старческое слабоумие и болезнь Альцгеймера. К полному слабоумию при этом приводят только выраженные типы атрофии. Маленькие деструктивные очаги в подавляющем числе случаев не влияют на умственные способности.
Важно заметить, что под кортикальной атрофией 1 степени понимается исключительно разрушение нервной мозговой ткани после его нормального формирования. При изначально недоразвитой центральной нервной системе говорить о кортикальной атрофии нельзя.
Атрофия мозжечка
При этом недуге поражаются и о. Первые симптомы болезни проявляются в виде дискоординации движений, паралича и нарушения речи. При изменениях в коре мозжечка обычно развивается атеросклероз сосудов и опухоли ствола головного мозга, инфекционные недуги, авитаминоз и нарушение обмена веществ.
Атрофия мозжечка проявляется в виде:
- нарушения речи и мелкой моторики;
- головной боли;
- тошноты, рвоты;
- снижения остроты слуха;
- зрительных расстройств;
- уменьшения массы и объема мозжечка.
Лечение предполагает блокировку признаков недуга нейролептиками, восстановление обмена, применение цитостатиков при опухолях. Вероятно устранение образований с помощью хирургического метода.
Причины возникновения
Атрофические возрастные процессы головного мозга развиваются в силу влияния комплекса причин. Например, старческое слабоумие формируется из-за следующих факторов:
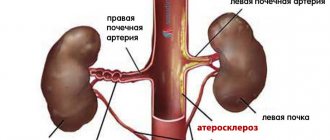
- дефекты снабжения кровью тканей мозга из-за сильного уменьшения пропускной способности сосудов, то есть атеросклероз;
- снижение насыщаемости кислородом крови, вследствие чего в нервной ткани возникают ишемические хронические явления;
- активация наследственных факторов;
- снижение регенеративных возможностей организма человека;
- значительное уменьшение умственной нагрузки.
Важно знать, что кроме сказанного выше, вероятность развития атрофии головного мозга у пожилых пациентов в некоторой степени определяется степенью развития их ума в молодом возрасте. Доказано, что те, кто обладает высоким уровнем интеллекта и владеет иностранными языками, занимается активной интеллектуальной деятельностью, меньше подвергаются развитию слабоумия в старости.
Врожденная церебральная кортикальная атрофия 1 степени является, по сути, гипоплазией органа, поскольку при этом не происходит первоначального правильного формирования, относительно чего развивается патология. Но в большей части случаев этот процесс тоже называется атрофическим.
Диагностические критерии и методы исследования
Кортикальная церебральная атрофия имеет рад симптомов, которые должны стать причиной похода к врачу и диагностирования дегенеративного процесса.
Симптомы:
- снижение способности анализировать и мыслить;
- нарушение моторики рук;
- нарушение памяти, вплоть до невозможности запомнить минимум информации;
- изменение особенностей речи: тона, темпа и т.п.
При поражении разных участков мозга проявляются и различные симптомы:
- при поражении мозжечка нарушается тонус мышц, координация движений;
- патология промежуточного мозга приводит к проблеме с обменом веществ, проблемы с терморегуляцией, гомеостаз;
- проблемы с передним мозгом приводят к утрате всех рефлексов;
- атрофия продолговатого мозга есть причиной нарушения дыхания, пищеварения, работы сердечно-сосудистой системы, защитных рефлексов; исчезает реакция на раздражители из вне из-за отмирания коры среднего мозга.
При посещении врача необходимо изложить симптомы, на основании которых назначаются дальнейшие исследования:
- рентгенологическое исследование (даёт возможность обнаружить новообразования, очаги со структурными изменениями);
- когнитивные тесты (определяется степень тяжести заболевания);
- допплерография сосудов шеи и мозга (для визуализации просветов сосудов);
- МРТ (даёт самый точный диагноз).
Провоцирующие факторы
Атрофические явления в некоторых случаях могут развиться и в молодом возрасте. Например, факторами возникновения кортикальной атрофии головного мозга 1 степени могут являться:
- Травмы, в особенности, сопровождающиеся появлением отека мозга, и при этом часто пережимаются кровеносные сосуды, происходит ишемия мозговых тканей и их атрофия.
- Кисты и опухоли, также вызывающие пережатие сосудов; чаще всего роль в возникновении атрофии имеют замершие новообразования, долго оказывающие негативное воздействие в умеренной степени; растущие опухоли не успевают вызвать атрофию.
- Токсическое влияние (хронический алкоголизм); метаболиты спиртных напитков разрушают нейроны в человеческом организме; пораженная нервная ткань не восстанавливается при продолжающейся интоксикации, из-за чего развивается атрофия.
- Причиной болезни в редких случаях может стать нейрохирургическая операция, которая есть в анамнезе.
Отмирание клеток головного мозга (атрофические изменения) — что это такое
Омертвение нервных и других клеток мозга с распадом связей между нейронами называется его атрофией. Процесс обнаруживается в зоне коры, подкорковой и других областях. Личность больного распадается полностью, явление приводит к невозможности реабилитации.
Серьезной патологии сопутствуют поражения нервной системы необратимого характера — это церебральная форма заболевания. При таком недуге наблюдается уменьшение мыслительного органа, который теряет способность выполнять все необходимые функции.
Состояния атрофии головного мозга чаще всего обнаруживаются у пожилых пациентов, особенно женщин.
Что такое атрофия головного мозга
Необратимый недуг, при котором последовательно отмирают клетки и нарушаются нейронные связи — это атрофия мозга. Начальная стадия недуга имеет лишь малозаметные симптомы, видимые только близким.
Это появление апатии, отсутствие целей у заболевшего, неустойчивость эмоциональных состояний, вялость. У некоторых отмечается безнравственность, либо повышенная активность сексуального характера.
Постепенное отмирание клеток в головном мозге приводит к угасанию умственных способностей.
Различаются стадии болезни, а также ее виды в зависимости от местоположения патологии. Так субатрофия влечет глобальную гибель нейронов.
Ведь этим термином называют частичные местные поражения, предопределяющие подобную деградацию.
Корковая и подкорковая разновидности также нуждаются в своевременном принятии мер, так как могут развиться в серьезные нарушения речи и мыслительных способностей.
Степени заболевания
Международная классификация выделяет различные степени атрофии мозга. Симптомы различаются в зависимости от этапа болезни.
Первую степень наблюдают при минимальных изменениях: нарушения памяти, затруднения при выполнении сложных умственных задач. Иногда бывают жалобы на головокружение, наблюдается эмоциональная неустойчивость.
Симптоматику принимают за переутомление, последствия стресса или возрастные факторы. При 1 степени пациент трудоспособен, но мозг атрофируется, состояние быстро прогрессирует. Своевременная диагностика весьма важна. Ведь развитие недуга можно остановить.
Иногда от этого зависит продолжительность жизни.
На второй стадии отмечается усугублением симптомов первой. При решении умственных задач требуются подсказки.
Неврология проявляется в виде двигательных расстройств, нарушении координации, отсутствии контроля к себе. Пример — генерализованная церебральная атрофия мозга 2 степени.
Третья стадия — неуправляемость с проявлениями психозов. Появляются немотивированные поступки, нравственность утрачивается. Это умеренные атрофические изменения заболевшего мозга — начало снижения трудоспособности, появление трудностей в социальной адаптации.
В дальнейшем личность полностью разрушается. Системы и функции жизнедеятельности отказывают: недержание мочи, расстройство рефлекса глотания. Способность к труду, самообслуживанию, контактам отсутствует. За пациентом нужен систематический контроль, его помещают в психиатрическое учреждение.
Важно Ноотропные капли в нос Семакс: инструкция по применению, отзывы, аналоги
Виды атрофии мозга
Атрофия мозга различается также относительно мест ее проявления и при поражениях конкретных участков нервной системы. Рассмотрим случаи локализованной патологии, связанные с ней расстройства умственных способностей, поведения, личности.
Церебральная атрофия лобных долей
Нейроны обрабатывают поступающую информацию, сохраняют ее и передают другим клеткам. Медленная их гибель, отмирание клеток головного мозга — это церебральная атрофия. Повреждения касаются корковых отделов и подкорковой части.
Нарушение функционирования лобных долей головного мозга приводит к изменению поведения, эмоций, моторики, ухудшению мыслительных процессов. Вызывает заболевание атрофией целый ряд причин.
Но обычно расстройство наблюдается у лиц пожилого возраста.
Симптомы патологии
Как проявляется кортикальная церебральная атрофия 1–2 степени? Комплекс симптомов, которые возникают при кортикальной атрофии, определяется напрямую степень поражения коры головного мозга либо глубоких его структур, от распространенности болезнетворного процесса. Например, умеренная кортикальная атрофия, в большинстве случаев являющаяся причиной первичного обращения больного к специалисту, развивается по такому алгоритму:
- Начальный этап заболевания (первая степень) характеризуется бессимптомным протеканием. Наличие тех или иных неврологических признаков в это время чаще всего обусловлено присутствием другой функциональной или органической патологии нервной системы.
- Вторая степень отличается заметным снижением мыслительных способностей пациента, его аналитических способностей. Уровень критического мышления, а также оценки собственных действий, снижается. Могут измениться привычки, речевые особенности, почерк.
- По мере прогрессирования заболевания (третья и четвертая степени) наблюдается ухудшение мелкой моторики пальцев рук, а также координация движений. Проявляются нарушения памяти. Больной утрачивает навыки использования повседневных предметов, например, пульта от телевизора и зубной щетки. Пациенты часто теряют способность самостоятельно принимать решения и копируют чье-либо поведение.
- Финальная стадия заболевания характеризуется социальной дезадаптацией пациента, неадекватностью, вследствие чего человек должен быть госпитализирован в неврологическую или психиатрическую клинику. У больных при этом чаще всего не возникает собственно неврологических симптомов.
Кортикальную атрофию 1 степени бывает выявить довольно сложно.
Симптомы каждой стадии разрушительного процесса
Кортикальная церебральная атрофия проходит пять степеней развития, на каждой из которых свои симптомы и проявления:
- Начальная стадия характеризуется полным отсутствием проявлений, но ее развитие происходит стремительно и быстро переходит в следующую стадию.
- На второй стадии общение с окружающими очень быстро ухудшается. Человек не может адекватно воспринимать критику, становится раздражителен, конфликты с его участием – нормальное явление, регулярно повторяющееся. Очень часто теряется нить разговора.
- Третья стадия – больной в несколько этапов теряет контроль над своим поведением, которое становится возмутительным. Часты проявления уныния или возникновение беспричинных вспышек гнева.
- Четвертая стадия: полностью теряется осознание сути событий. Пациент не может адекватно реагировать на требования окружающих.
- Пятая стадия – больной совершенно не поснимает происходящих событий, и, соответственно, это не вызывает у него никаких эмоций.
В зависимости от кого, какая именно доля мозга была затронута атрофией, возникают еще на первых этапах некоторые нарушения речи, появляется необоснованная эйфория или равнодушие, вялость, сексуальная гиперактивность, некоторые разновидности маний.
На последнем этапе человек часто становится опасным для жизни в обществе, что есть причиной для его помещения в психиатрическую лечебницу.
Лечение и особенности прогноза болезни
Важно знать о том, что возрастная кортикальная атрофия 1 степени мозговой коры не поддается полному излечению. В данном случае требуется поддерживающее лечение, которое направлено на замедление развития признаков заболевания. Атрофии, полученные в молодом возрасте, поддаются коррекции на начальном этапе при условии ликвидации этиологического фактора.
Лечение заболевания с помощью лекарств заключается в использовании следующих типов медикаментов:
- Препараты, которые улучшают метаболизм и кровообращение мозга (ноотропные средства). Особенно яркие представители этой фармакологической группы: «Церебролизин», «Пирацетам», «Цераксон», «Церепро». Их назначение значительно улучшает мыслительные способности человека.
- Антиоксиданты. Оказывают стимулирующее влияние на восстановительные процессы, снижают атрофию, способствуют усилению интенсивности вещественного обмена, противостоят свободным кислородным радикалам («Мексидол»).
- Лекарства, которые улучшают кровяную микроциркуляцию. Особенно часто выписывается «Пентоксифиллин» («Трентал»). Препарат отличается вазодилатирующим влиянием, увеличивает капиллярный просвет, улучшает газообмен через стенки сосудов и кровяную микроциркуляцию.
- В некоторых случаях кортикальная атрофия нуждается в проведении симптоматического лечения. При головных болях рекомендуют принимать противовоспалительные нестероидные препараты.
Кроме применения лекарств, нужно следить за психическим и нервным состоянием пациента. Желательна умеренная физическая нагрузка, прогулки на свежем воздухе каждый день, а также процедуры по самообслуживанию. Если у пациента неврастеническое состояние, используют несильные седативные препараты.
Анализы и диагностика
При осмотре больного используется психодиагностическое обследования — тесты, таблицы Шульте шкала оценки психического статуса MMSE, запоминание 10 слов и прочее.
- Также применяется МРТ-исследование мозга. МРТ более эффективна при обнаружении локальных изменений. Характерные признаки атрофии — расширение борозд (кортикальная атрофия) и увеличение желудочков. На основании этого рассчитывается церебро-вентрикулярный индекс (соотношение размеров желудочков к поперечному диаметру мозга). При этой патологии на МРТ выявляется: увеличение ЦВИ; расширение субарахноидальных пространств; дегенерация белого вещества; снижение плотности ткани; уменьшение долей в размерах. На основании исследования делают количественную оценку атрофии. При генерализованной кортикальной атрофии расширение борозд и желудочков оценивается в 13 различных областях. Для определенных заболеваний характерны те или иные изменения: при болезни Пика атрофия выражена в лобной и височной области. При болезни Хаттингтона изменения головок хвостатых ядер. Болезнь Паркинсона сопровождается генерализованная атрофией и атрофией черной субстанции, а при болезни Альцгеймера — атрофия гиппокампа.
- По шкале Fazekas оценивают количественное повреждение белого вещества. Оценка по этой шкале имеет прогностическое значение. Если набирается сумма баллов 3, то больной за год утрачивает способность к обслуживанию себя и самостоятельному существованию: 0 — лейкоареоз отсутствует; 1— множественные точечные поражения; 2 — умеренный лейкоареоз, имеющий тенденцию к слиянию; 3 — лейкоареоз тяжелой степени («сливной»).
- Ультразвуковая допплерография. Выявляет проходимость сосудов.
- Электроэнцефалография (изучает степени активности мозга).
- Реоэнцефалография (изучает состояние кровообращения мозга).
- Ангиография (рентгенография сосудов с контрастным веществом).
- Мониторирование давления и по показаниям мониторирование ЭКГ.
- Офтальмоскопия.
- Биохимическое исследование крови.
Роль позитивного настроя
Большинство специалистов сходятся в том, что спокойная атмосфера, правильный настрой и участие во всех повседневных делах положительно влияет на самочувствие человека. Родным пациента нужно позаботиться об отсутствии нарушений режима дня.
Положительный настрой, активная жизнь и отсутствие стрессов – это лучшие средства, которые позволяют приостановить заболевание.
Предотвратить дегенеративные явления помогают следующие факторы:
- здоровый образ жизни;
- здоровое питание;
- отказ от плохих привычек;
- постоянная умственная деятельность;
- контроль артериального давления.
Лечение кортикальной атрофии 1 степени должно быть своевременным.
До недавнего времени рассеянный склероз (РС) традиционно расценивался как первично демиелинизирующее заболевание. Однако в настоящее время общепринятым является мнение, что в его патогенезе участвуют как иммуно-воспалительные, так и нейродегенеративные компоненты, при этом именно баланс между активностью воспаления, прогрессирующей дегенерацией и репаративными механизмами и определяет клинические проявления РС на каждом конкретном этапе [1].
«Золотым стандартом» диагностики РС является магнитно-резонансная томография (МРТ). Однако если стандартные методики МРТ незаменимы в аспекте подтверждения характера, определения активности патологического процесса и мониторирования течения болезни, то в отношении корреляций между клиническими симптомами и нейровизуализационными параметрами их возможности крайне ограничены (так называемый клинико-радиологический парадокс). Обсуждаются различные причины этого феномена, включая особенности клинической оценки, отсутствие гистопатологической специфичности (особенно для аксональной гибели), недостаточное внимание к вовлечению спинного мозга, недооценка повреждения внешне не измененного вещества мозга — как белого (БВ), так и серого (СВ), а также маскирующие эффекты корковой адаптации [2]. На современном этапе МРТ-исследования осуществляются с использованием новых методик (МР-спектроскопия, функциональная МРТ, МРТ-морфометрия, SWI, DIR, MTC), которые направлены на уточнение патогенеза, патофизиологических механизмов формирования неврологического дефицита, разработку эффективных прогностических критериев и новых маркеров мониторирования течения не только иммуновоспалительного, но и нейродегенеративного, атрофического компонента [3].
Первоначально наличие атрофии головного мозга у пациентов с РС выявлялось качественно: описывалось расширение желудочков мозга и субарахноидальных пространств и уменьшение объема вещества мозга [4]. Следующим этапом явилась полуавтоматическая количественная оценка атрофии головного мозга без дифференцировки на СВ и БВ. В настоящее время в исследованиях используются различные МРТ-измерения для оценки как глобальной (головной мозг в целом), так и региональной атрофии. Одним из наиболее часто применяемых методов является оценка фракции паренхимы мозга (BPF), которая определяется соотношением вещества головного мозга к сумме вещества головного мозга и цереброспинальной жидкости (ЦСЖ). Достоинством этого метода является полностью автоматический подсчет объемов и возможность индивидуальной оценки параметров в каждом конкретном случае, но при этом сложно проводить продолженные исследования. Также широко используется измерение толщины коры головного мозга — применяется автоматизированная методика, которая включает этапы СВ и БВ и регистрации не объема как при морфометрии, а именно толщины коры, но ее недостатком является трудность в получении четких границ СВ из-за неоднородного магнитного поля.
Детальная количественная оценка стала возможной после внедрения воксельной МРТ-морфометрии — метода статистического анализа структурных МРТ-изображений с использованием компьютеризированной сегментации вещества мозга на СВ и БВ. Данные об этой методике впервые были опубликованы в 2000 г. [5]. Воксельная МРТ-морфометрия требует обработки данных, получаемых при проведении МРТ-исследования в режиме Т1-взвешенных изображений (ВИ) с толщиной среза 1 мм. Этот препроцессинг включает нормализацию, сегментацию и сглаживание [6]. Процесс нормализации заключается в межсубъектном сравнении объема мозга и приведении его к одному стереотаксическому пространству. Путем сегментации производится разделение основных мозговых и внемозговых структур (СВ, БВ и ЦСЖ). С помощью сглаживания достигается устранение особенностей СВ каждого отдельного индивидуума, что необходимо для дальнейшего группового анализа. МРТ-морфометрия используется не только для вычисления объемов СВ и БВ в целом, но и отдельных зон интереса при применении так называемых масок для каждой определенной области головного мозга. При морфометрии большое значение отводится выбору специальных приложений для персонального компьютера, с помощью которых производят обработку полученных МРТ-данных. Использование таких программ позволяет точно оценивать структуры головного мозга и избегать ошибок оператора. Существует несколько разновидностей таких программ, например статистическое параметрическое картирование (statistical parametric mapping — SPM) [7].
Обсуждая атрофию центральной нервной системы (ЦНС) и данные МРТ-морфометрии при РС, необходимо упомянуть, что помимо постепенно нарастающей потери вещества мозга при РС могут отмечаться и краткосрочные колебания объема. Так, воспаление и отек в результате формирования новых очагов приводят к временному увеличению объема мозга, и наоборот, прием кортикостероидов ведет к кратковременному его уменьшению — псевдоатрофии [8]. Механизм данного процесса не совсем ясен, но считается, что это происходит в результате уменьшения воспаления в ЦНС и связанного с ним отека.
Атрофия головного мозга начинается на самых ранних стадиях заболевания и развивается как при ремиттирующем, так и прогрессирующем типах течения РС. Причем у всех пациентов с РС (без разделения на типы течения) объем мозга уменьшается в среднем на 0,5-1,3% в год, что втрое превышает нормальное старение мозга (0,1-0,4%) [9]. Показана связь степени атрофии с типом течения, стадией заболевания, генетическими и токсическими факторами. Было выявлено, что у пациентов с различными типами течения РС и клинически изолированным синдромом (КИС) снижение объема головного мозга в целом на 5,7% больше по сравнению с контролем, причем у пациентов с вторично-прогрессирующим типом течения РС (ВПРС) оно значительно выше, чем при ремиттирующем РС (РРС).
У пациентов с аполипопротеином Е-е4 в генотипе ежегодное уменьшение объема мозга в 4 раза выше, чем у пациентов с его отсутствием. Однако согласно другим исследованиям, генотип с наличием аполипопротеина Е-е4 не влияет на степень атрофии [10]. Подверженность токсическому воздействию, например табачному дыму, также повышает степень атрофии.
В настоящее время доказано, что атрофические процессы в ЦНС при РС обусловлены не только потерей миелина, но и нейродегенеративным процессом с потерей аксонов, нейронов, что отражается в уменьшении объема коры и подкорковых структур. В связи с этим при оценке атрофического процесса у больных РС с помощью метода воксельной морфометрии выделяются следующие составляющие: атрофия БВ, коры головного мозга и подкорковых структур.
Атрофия БВ
Изначально при РС именно воспалительной демиелинизации БВ отдавалось ключевое значение и поэтому считалось, что именно оно подвергается атрофическим изменениям. Однако повреждение аксонов в рамках поражения БВ ведет к атрофии, которая, вероятнее всего, развивается двумя путями: потеря вещества в самих очагах демиелинизации и дальнейшая валлеровская дегенерация путей, связанных с очагом поражения. Атрофия БВ затрагивает определенные зоны головного мозга, включая оба полушария большого мозга, ствол мозга и мозжечок. У пациентов с РРС по сравнению с группой контроля наиболее выражена атрофия практически всех отделов БВ: мозолистого тела, поясных извилин с обеих сторон, некоторых отделов лобных долей (включая верхние отделы лучистого венца и верхние продольные пучки), височных и затылочных долей (свод, нижние и верхние продольные пучки, нижние лобно-затылочные тракты). У пациентов с РРС атрофия БВ (в отличие от атрофии СВ) также выражена в стволе мозга и мозжечке и в основном поражает кортико-спинальные тракты, верхние мозжечковые ножки (преимущественно правую), оба полушария мозжечка, дорсальные отделы варолиева моста и ростральные отделы продолговатого мозга [11, 12]. В некоторых исследованиях показано, что атрофия БВ менее заметна по сравнению с атрофией СВ из-за более выраженных воспалительных процессов, которые могут маскировать атрофию [13, 14].
Согласно результатам некоторых исследований, существует связь между степенью очагового повреждения БВ и общим объемом головного мозга, а также с атрофией коры и подкорковых структур [12]. Причем была выявлена связь с очагами, визуализируемыми в режиме Т2-ВИ, более низкая степень корреляции отмечалась с очагами в Т1-ВИ и полное ее отсутствие — с очагами, накапливающими контрастное вещество [15]. При проведении корреляций между количеством и локализацией очагов в Т2-ВИ и атрофией СВ были получены следующие результаты: у пациентов с РРС общий объем очагов в Т2-ВИ коррелировал с атрофией таламуса; у пациентов с доброкачественным типом течения РС (ДТРС) — с атрофией таламуса, тел хвостатых ядер и правой скорлупы; у пациентов с ВПРС объем очагов коррелировал с атрофией таламуса, хвостатых ядер, левой нижней теменной дольки, парагиппокампальных извилин и верхних и нижних холмиков. Также было выявлено, что у пациентов с ВПРС и первично-прогрессирующим типом течения РС (ППРС) атрофия коры соответствовала количеству очагов в соответствующих долях или каудальнее расположенных отделах БВ, а степень атрофии подкорковых структур коррелировала с количеством очагов во всех долях обоих полушарий большого мозга.
Однако согласно другим работам, соотношение между степенью очагового повреждения БВ и атрофией СВ довольно незначительна, так как к уменьшению его объема ведут и другие процессы.
Атрофия коры головного мозга
Проведены исследования как с измерением объема СВ, так и с оценкой истончения коры головного мозга. Согласно проведенным исследованиям in vivo, именно потеря СВ ускоряется по мере прогрессирования заболевания. Например, в исследовании E. Fisher и соавт. [16] у пациентов с переходом КИС в РРС было обнаружено 3,4-кратное увеличение степени атрофии СВ, а у пациентов с трансформацией РРС в ВПРС — 14-кратное увеличение. Однако до сих пор нет однозначного мнения, является ли атрофия СВ более значимой в развитии прогрессирования РС по сравнению с атрофией БВ.
У пациентов с РС (без разделения по типам течения) отмечается диффузная и локальная атрофия коры головного мозга. Средняя толщина коры у пациентов с РС составляет 2,3 мм по сравнению с 2,48 мм у здоровых людей. Выявляется преимущественная атрофия коры лобных (2,37 мм по сравнению с 2,73 мм в группе контроля) и теменных долей (2,65 по сравнению с 2,95 мм) даже на ранних стадиях заболевания. У пациентов с большой длительностью заболевания преимущественно атрофируется моторная кора (2,35 мм по сравнению с 2,74 мм в норме) [12].
В ходе метаанализа у пациентов с различными типами течения РС, без разделения на группы, была выявлена преимущественная атрофия коры пре- и постцентральных извилин (более выраженная в левом полушарии), левой средней лобной извилины, нижней теменной дольки правого полушария большого мозга, поясных извилин, преимущественно правой задней поясной и левой парагиппокампальной извилин [17].
Атрофия подкоркового СВ
Согласно последним данным, атрофия таламуса развивается раньше, чем атрофия коры, что было продемонстрировано в исследовании пациентов с РРС и ППРС при динамическом наблюдении [18, 19]. Атрофия таламуса отмечается при всех типах течения РС, в наибольшей степени при ВПРС, что, вероятно, связано с длительностью заболевания.
В работе A. Cifelli и соавт. [20] было показано, что по сравнению с группой контроля у пациентов с ВПРС объем таламуса уменьшился на 17%, а поперечный размер III желудочка возрос вдвое, причем была выявлена четкая обратно пропорциональная зависимость между их объемами. Вышеописанные МРТ-данные подтверждаются гистологическими исследованиями: выявлено сокращение числа нейронов в медиальном заднем таламическом ядре и уменьшение общего объема таламуса в среднем на 22%. В целом потеря нейронов головного мозга оценивалась в 30-35%. Сходные данные были получены у пациентов с РРС в ходе оценки концентрации N-ацетиласпартата (NAA) в таламусе, и именно его снижение коррелировало с атрофией таламуса и продолжительностью заболевания.
В ходе вышеупомянутого метаанализа у пациентов с РРС и КИС зона наибольшей атрофии была в правом таламусе, а также отмечалось билатеральное вовлечение подкорковых структур, включая левый таламус.
Согласно одним данным [21, 22], у пациентов с КИС не обнаруживалось зон значительного снижения объема СВ, в частности таламуса, по сравнению с контролем. Однако, согласно другим исследованиям с использованием воксельной МРТ-морфометрии [23, 24] и режима Т1-ВИ с применением импульса переноса намагниченности, отмечалась атрофия таламуса [25]. Расхождение данных может быть связано с тем, что режим Т1-ВИ с применением импульса переноса намагниченности обладает большей чувствительностью по отношению к изменениям СВ, которые предшествуют атрофии. Противоречивые результаты вышеописанных исследований могли быть получены также из-за различных методик, которые применялись для измерения атрофии. По данным метаанализа было выявлено, что у пациентов с РРС и КИС правый таламус является наиболее пораженной зоной. Когда из списка всех работ исключили исследования, в которых принимали участие пациенты с КИС, было выявлено незначительное изменение паттернов распределения атрофии СВ. Пик атрофии при этом сместился в левый таламус.
У пациентов с ВПРС по сравнению с РРС наблюдалось значительное снижение объема некоторых подкорковых структур (таламус, хвостатые ядра), верхних и нижних холмиков крыши четверохолмия. По сравнению с пациентами с ППРС, при ВПРС отмечалась более выраженная атрофия таламуса с обеих сторон и верхних, и нижних холмиков. При этом у пациентов с ППРС по отношению к ВПРС не было выявлено зон большей атрофии.
Выраженная атрофия таламуса при РС может иметь несколько механизмов: во-первых, из-за воспалительных изменений в самом таламусе и прямого нейродегенеративного процесса, а во-вторых, в результате непрямого поражения СВ (таламус является так называемым барометром диффузного нейродегенеративного процесса при РС, так как благодаря хорошо развитым реципрокным связям с корой и подкорковым СВ таламус чувствителен к их повреждению) [26]. Также наличие более выраженной атрофии подкорковых структур по сравнению с корой головного мозга, особенно у пациентов с КИС, говорит о вероятной атрофии глубоких отделов СВ в результате повреждения аксонов, нежели прямого воздействия [27]. Это также подтверждается тем, что при поражении зрительной лучистости отмечается атрофия латерального коленчатого тела [28].
Паттерны атрофии головного мозга при различных типах течения РС
При оценке глобальной атрофии головного мозга при прогрессирующих типах течения РС выявлено одновременное расширение желудочков мозга и субарахноидального пространства, тогда как при РРС в большей мере определяется расширение желудочковой системы головного мозга, преимущественно тел, передних и задних рогов боковых желудочков и III желудочка, что говорит об атрофии подкорковых структур [29]. Что касается атрофии коры головного мозга у пациентов с РРС по сравнению с больными с КИС и группой контроля, то была отмечена значительная атрофия правых пре- и постцентральных извилин при отсутствии выраженных изменений БВ. При ВПРС по сравнению с РРС выявлена наибольшая атрофия как БВ, так и СВ: коры всех долей больших полушарий мозга (преимущественно верхних лобных, постцентральных извилин, правых верхней и нижней теменных долек, парагиппокампальных извилин, клина в обоих полушариях, левой средней затылочной извилины), передних долек мозжечка, верхних и нижних холмиков и подкорковых структур [30]. По сравнению с ППРС при ВПРС отмечена атрофия коры постцентральных извилин (в основном — левой), средних затылочных извилин, левого клина, таламуса, передних долек мозжечка и холмиков крыши четверохолмия.
Отдельного внимания заслуживает ДТРС. Этот диагноз ставится ретроспективно при длительности заболевания 10 и более лет от дебюта РС при незначительной степени инвалидизации (не более 3 баллов по шкале EDSS). Согласно исследованию S. Mesaros и соавт. [31], у пациентов с ДТРС по сравнению с группой контроля не было выявлено изменений объема головного мозга в целом, но при этом отмечалось локальное снижение объема СВ: преимущественно подкорковых структур и в меньшей степени — коры лобной и теменной долей левого полушария большого мозга. У части пациентов были выраженные когнитивные нарушения. При сравнении пациентов с ВПРС и пациентов с ДТРС с когнитивным дефицитом не было выявлено различий в изменении объема структур головного мозга, тогда как при сравнении пациентов с ВПРС и пациентов с ДТРС без когнитивных изменений, у первых отмечалась выраженная атрофия коры мозжечка. Данные результаты подтверждают, что необратимое повреждение мозжечка может играть значительную роль в развитии двигательных нарушений [32, 33].
Атрофия спинного мозга
Клиническая картина РС чрезвычайно гетерогенна, а симптоматика, которая возникает в результате повреждения спинного мозга (СпМ), часто доминирует и на определенном этапе отмечается у 90% больных [34]. В СпМ выявляются как локальные, так и диффузные очаги демиелинизации. У пациентов с КИС и ДТРС количество очагов меньше, чем при РРС, ВПРС и ППРС, что, вероятно, обусловливает и более легкое течение заболевания. При этом в исследованиях показано [35, 36] отсутствие корреляции между количеством очагов, выявляющихся в режиме Т2-ВИ, и атрофией, что говорит об их небольшой роли в развитии атрофии СпМ.
Атрофические изменения наиболее часто выявляются в шейном отделе СпМ, причем в большей степени у пациентов с прогрессирующим типом течения РС. Существует связь между степенью атрофии СпМ и тяжестью клинической симптоматики [37, 38]. Учитывая небольшой размер СпМ и строение окружающих тканей, измерять его объем довольно сложно. Однако с применением МРТ-морфометрии это стало возможным. Выраженная атрофия СпМ отмечается у пациентов с ВПРС, ППРС и даже при ДТРС [34]. Это подтверждает то, что атрофия развивается при прогрессирующем и длительно текущем заболевании. При данных типах течения РС отмечается одинаковое уменьшение объема на всем протяжении шейного отдела СпМ, при этом на каждом отдельном уровне оно больше выражено в задних и латеральных отделах его поперечника. Это подтверждается также и с помощью других методов и режима Т1-ВИ с применением импульса переноса намагниченности. У пациентов с ДТРС отмечается меньшая степень атрофии в целом по сравнению с пациентами с ВПРС, что говорит о том, что чем меньше выражены дегенеративные процессы, тем доброкачественнее протекает РС. Это также подтверждается наличием корреляций между выраженностью атрофии СпМ при ППРС и ВПРС и степенью нетрудоспособности по функциональной шкале EDSS.
При ППРС наблюдается выраженная атрофия СпМ, особенно задних его отделов, по сравнению с пациентами с КИС, РРС и группой контроля, несмотря на небольшую длительность заболевания. Тем не менее атрофия СпМ при ППРС менее выражена, чем при ВПРС; хотя оба этих типа течения РС являются прогрессирующими, выявленные отличия подтверждают различные механизмы их развития.
Корреляции атрофических изменений и клинических симптомов
В настоящее время именно атрофия ЦНС (головного и спинного мозга) считается ответственной за неуклонное прогрессирование как очаговой неврологической симптоматики, так и когнитивных нарушений [8]. С помощью применения гистологических и нейровизуализационных методик доказана наибольшая корреляция ряда клинических симптомов с изменениями СВ по сравнению с БВ или головным мозгом в целом [39-41].
Корреляции атрофии головного мозга с развитием инвалидизации
Согласно ряду данных [42], существуют корреляции между баллом по шкале EDSS и общей толщиной коры головного мозга, коры левых пре- и постцентральных, правой парагиппокампальной и левой латеральной затылочной извилин, а также с объемом правого хвостатого ядра и правого прилежащего ядра (группа нейронов в вентральной части полосатого тела). В некоторых работах показано, что у пациентов со стойким прогрессированием нетрудоспособности по шкале EDSS отмечается значительно более высокая скорость атрофических процессов по сравнению с пациентами со стабильной неврологической симптоматикой. Также считается, что объем СВ по сравнению с объемом БВ является более чувствительным предиктором инвалидизации, оцениваемой по шкале EDSS [43]. Противоположные данные были получены в исследовании A. Ceccarelli [44], в котором у пациентов с РС не было выявлено связи между локальным поражением СВ и оценкой по шкале EDSS. У пациентов с ДТРС также не отмечено связи между атрофией СВ, продолжительностью заболевания и оценкой по EDSS [45]. Корреляций между изменением объема БВ и клинической симптоматикой также выявлено не было.
Исследование, которое позволило взглянуть по-новому на низкую степень корреляции между клинической картиной заболевания и МРТ-данными, было выполнено в 2009 г. [46]. В течение 6 лет у пациентов с разными типами течения РС проводилась оценка клинических проявлений по шкале EDSS и функциональной шкале РС — MSFC, включающей 3 теста. В итоге было выявлено, что прогрессирование по шкале MSFC коррелировало с объемом головного мозга в целом, объемами СВ и БВ, а отсутствие связи со шкалой EDSS подтвердилось. Эти результаты, по мнению авторов, связаны с относительно низким уровнем согласованности между способами измерения степени нетрудоспособности по этим двум шкалам (62%). Отсутствие корреляции между атрофией головного мозга и шкалой EDSS может быть связано со следующими факторами: нечувствительность шкалы EDSS в определении прогрессирования заболевания у пациентов с высокой степенью нетрудоспособности, а также ошибки в оценке прогрессирования заболевания у пациентов со стабильными значениями по шкале MSFC и низкими баллами по шкале EDSS. Также расхождения в результатах могут быть связаны с тем, что и другие факторы приводят к развитию нетрудоспособности, например такие как изменения в СпМ. При исследовании пациентов с ВПРС были получены аналогичные результаты, а именно наличие корреляций между атрофией всего головного мозга, СВ и СпМ со шкалой MSFC.
Корреляции атрофии головного мозга с когнитивными нарушениями
Когнитивные нарушения, включающие снижение памяти, внимания и скорости воспроизведения информации, отмечаются у 70% пациентов с РС, причем они возникают уже на ранних стадиях заболевания (в течение первых 3 лет). У пациентов с РРС с когнитивными нарушениями по сравнению с пациентами без таковых выявляется снижение объема головного мозга в целом, а также СВ коры головного мозга. Действительно, корковая атрофия является предиктором когнитивных нарушений, потому что даже легкие когнитивные изменения связаны со значительным истончением коры головного мозга [47]. Также значительная корреляция была обнаружена и с атрофией таламуса.
При разных типах течения РС с наличием когнитивных нарушений отмечены разные паттерны поражения СВ: у пациентов с РРС и когнитивными изменениями выявляется атрофия коры левой верхней височной извилины, левого островка, таламуса и правой средней затылочной извилины; у больных ВПРС отмечается атрофия коры передней поясной извилины, островка гиппокампа и правой верхней лобной извилины; а при ППРС — атрофия коры передней поясной извилины и правой верхней височной извилины.
Существуют данные о том, что атрофия головного мозга в меньшей степени влияет на когнитивные нарушения у пациентов с высоким «когнитивным резервом», который является результатом высокого уровня образования и интеллекта.
Корреляции атрофии головного мозга с утомляемостью
У пациентов с РС частым симптомом (до 80% случаев) является утомляемость. Она не связана с прогрессированием заболевания, степенью нетрудоспособности или локализацией очагов, но, вероятно, имеет связь с лобно-таламо-базальной сетью [48]. Исследования на данную тему немногочисленны. При сравнении пациентов с утомляемостью и без нее у первых была обнаружена атрофия вещества супратенториальных отделов головного мозга, включая кору, прилежащее БВ и головки хвостатых ядер, т.е. областей, которые функционально связаны с контролем внимания [49]. Авторы предполагают, что нарушение центральной моторной активации может быть связано с повреждением корково-подкорковых путей, включающих моторную кору. Так, 222 пациента с РРС с низкими баллами по шкале EDSS (не более 2) были разделены на две группы: пациенты с высокой степенью утомляемости (FSS не менее 5) и пациенты с низкой степенью утомляемости (FSS не более 4). В 1-й группе отмечались меньший объем СВ и БВ и наибольшее количество очагов в режимах Т2-ВИ и Т1-ВИ. Авторы предположили, что атрофия СВ и БВ может быть фактором риска появления утомляемости, которая при этом не связана со степенью нетрудоспособности.
Заключение
Таким образом, современные методики МРТ, в том числе воксельная МРТ-морфометрия, значительно расширяют наши представления о патогенезе РС. Многочисленные исследования показывают, что помимо атрофии БВ атрофия СВ при РС отмечается уже на ранних этапах развития заболевания и прогрессирует быстрее, чем у здоровых людей, являясь значимым МРТ-предиктором развития нетрудоспособности. Исследования, в которых показана атрофия разных зон головного мозга при различных типах течения РС, привносят новый вклад в понимание патофизиологических механизмов дегенеративного процесса. Однако последовательность развития атрофических процессов до конца не установлена. Дополнительная детализация закономерностей атрофии при РС с помощью МРТ-морфометрии будет играть важную роль в исследованиях при РС как в фундаментальном значении — уточнение патофизиологических механизмов, так и в практическом плане — разработка прогностических критериев течения болезни, мониторирование прогрессирования и оценка эффективности проводимой терапии в аспекте предупреждения/замедления нейродегенеративного процесса.
Лечение народными средствами
Посредством травяных сборов можно снизить интенсивность отрицательных проявлений кортикальной мозговой атрофии 1 степени.
Неплохие результаты будут получены благодаря таким рецептам:
- травяной чай – берутся в равных соотношениях пустырник, душица, хвощ и крапива, в термосе завариваются кипятком; отвар нужно настаивать ночью и пить три раза в день;
- звездчатка и рожь завариваются в термосе; он пьется в неограниченном количестве после приема пищи; в особенности хорошо такой чай помогает при терапии посттравматических участков;
- шиповник, калина и барбарис – ягоды данных растений следует залить кипятком и настоять на протяжении восьми часов; пить можно как чай в любых количествах; в случае необходимости разрешается добавить мед.