Мерцательная аритмия и фибрилляция предсердий в настоящее время являются равнозначными терминами. Они имеют сходные причины возникновения, клинические проявления и изменения на электрокардиограмме. Нередко могут трансформироваться друг в друга. Под мерцательной аритмией понимают нарушение ритма сердца, при котором предсердия и желудочки сокращаются в своем режиме, а не последовательно, поэтому частота сокращения предсердий и желудочков отличается.
Предрасполагающими факторами возникновения мерцательной аритмии являются: ишемическая болезнь сердца (ИБС), артериальная гипертензия, пороки сердца, структурные заболевания сердца, хроническая обструктивная болезнь легких, излишний вес, сахарный диабет, апноэ во время сна, хроническая болезнь почек, нарушение функции щитовидной железы.
Существует консервативный (антиаритмические препараты) и хирургические методы лечения мерцательной аритмии. О них подробнее в статье «мерцательная аритмия».
За последние 30 лет было разработано несколько видов оперативного лечения.
— хирургическая изоляция левого предсердия, — процедура «коридор», — операция «лабиринт» — метод хирургической аблации.
Самой эффективной среди них оказалась операция «лабиринт», которая впервые была выполнена в 1987 г. кардиохирургом Дж. Коксом (J. Cox) в Сент-Луисе.
За несколько лет данная операция претерпела три модификации — Maze-1, Maze-2 и Maze-3. Maze -1 была изменена вследствие того, что после ее выполнения выявлялась дисфункция синусного узла и задержку внутрипредсердной проводимости. От Maze-2 отказались в связи с чрезвычайной сложностью выполнения процедуры. А в 1992 г. Дж. Кокс разработал третий вариант (Maze-3), который сочетал в себе все преимущества предыдущих вариантов и был несложен в проведении. Стоит отметить, что данная операция является комбинированной и является в настоящее время «золотым стандартом» при коррекции порока митрального клапана в сочетании с фибрилляцией предсердий. В чистом виде «лабиринт» (метод хирургической аблации) выполняется крайне редко в связи с высокой травматичностью.
Чтобы понять суть операции «лабиринт», нужно понять причину возникновения мерцательной аритмии.
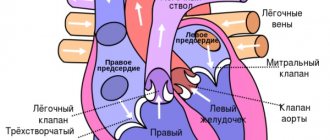
У человека сердце состоит из четырех камер, левое и правое предсердие и левый и правый желудочек. В норме нервный импульс должен идти от синусового узла, расположенного в стенке правого предсердия к атриовентрикулярному узлу в межпредсердной перегородке. В этом случае предсердия и желудочки сердца сокращаются правильно. При мерцательной аритмии нарушается правильный ход импульса. Часть импульсов, как и должно быть, идет к атриовентрикулярному узлу, а часть возвращается к синусовому узлу и вызывает внеочередное сокращение предсердий.
Суть операции «лабиринт» заключается в разрушении проводящих путей, которые отвечают за возникновение и поддержание аритмии. Достигается это хирургическим способом «разрез и шов» (синие прямые линии на схеме) через предсердия, путем иссечения задней стенки левого предсердия вместе с легочными венами и нанесением множественных небольших разрезов в правом и левом предсердии, формируя так называемый «лабиринт», который и не дает возможности нервному импульсу вернуться назад и вызвать внеочередное сокращение предсердия. Попросту говоря, импульс, который хочет вернуться к синусовому узлу, упирается в микроскопические разрезы на сердце и затухает. В результате импульс идет туда, куда и должен идти в норме, т.е. к атриовентрикулярному узлу, который приводит в сокращение желудочки сердца и способствует правильному сокращению сердца.
Схема
Методика «Лабиринт» не нашла широкого клинического применения в связи с длительным временем искусственного кровообращения, пережатия аорты, высокого риска кровотечения, отсутствие опыта в выполнении данной методики. Поэтому был предложен ряд модификаций данной операции с применением различных физических методов аблации стенок предсердий, заменяющих скальпель: радиочастотное, ирригационное радиочастотное, ультразвуковое, криогенное, лазерное и микроволновое воздействие.
Противопоказания
Противопоказаниями к операции «лабиринт» являются:
• Резко увеличенные размерами левого предсердия. • Высокое значение кардиоторакального индекса, с низкой амплитудой ƒ-волн на ЭКГ в отведениях V1. • Легочная гипертензия. • Почечная и печеночная недостаточность. • Низкая фракция выброса левого желудочка (менее 30%). • Длительно текущая хроническая форма ФП в анамнезе, т.к. в данном случае восстановление синусового ритма после операции практически не наблюдается. • Общие противопоказания перед оперативным вмешательством на сердце. Они зависят от основного заболевания сердца и рассматриваются кардиохирургом в каждом отдельном случае.
Материал и методы
В отделе кардиоторакальной хирургии ФГБУ «СЗФМИЦ им. В.А. Алмазова» с 2012 по 2016 г. с использованием модифицированной методики MAZE IV прооперированы 72 пациента с клапанными пороками сердца и сопутствующей персистирующей Ф.П. Средний возраст пациентов составил 55,7±10,2 года, соотношение мужчин и женщин — 39/61%, средний размер левого предсердия (ЛП) — 53,6±7,3 мм. Эффективность восстановления и удерживания синусового ритма оценивалась посредством суточного мониторирования ЭКГ в контрольных точках через 6 сут, 3, 6 и 12 мес после оперативного вмешательства.
Техника выполнения оперативного вмешательства
:
1 — доступ к сердцу осуществляется посредством срединной стернотомии;
2 — подключение аппарата искусственного кровообращения осуществляется по бикавальной методике, верхняя полая вена (ВПВ) канюлируется через переднюю стенку на расстоянии не менее 1 см от уровня ее впадения в правое предсердие (ПП). Для удобства канюляции ВПВ, а также для повышения ее мобильности производится выделение ВПВ экстраперикардиально до уровня впадения в нее безымянной вены;
3 — выделение и мобилизация нижней полой вены (НПВ) экстраперикардиально до уровня ее прохождения сквозь диафрагму;
4 — проведение турникетов вокруг ВПВ и НПВ. Уровень проведения турникетов вокруг ВПВ должен располагаться между уровнем канюляции и уровнем впадения безымянной вены для возможности беспрепятственного расположения браншей биполярного электрода при формировании линии РЧА воздействия от разреза ПП к ВПВ. На данном уровне в ВПВ впадает и непарная вена, что необходимо учитывать во избежание ее повреждения;
5 — антеградная кровяная изотермическая кардиоплегия через корень аорты до асистолии желудочков;
6 — поперечная атриотомия ПП по направлению от предсердно-желудочковой борозды к пограничному гребню с его пересечением. Расстояние от разреза ПП до уровня впадения ВПВ должно превышать расстояние до уровня впадения НПВ примерно в 3 раза;
7 — обшивание устья коронарного синуса кисетным швом (prolen 4/0—5/0), установка в коронарный синус канюли для ретроградной кардиоплегии под контролем зрения с последующей ее фиксацией кисетным швом. Данная манипуляция позволяет проводить сеансы ретроградной изотермической кровяной кардиоплегии с большой надежностью и контролем правильной доставки кардиоплегического раствора до миокарда. При этом после затягивания кисетного шва необходимо осуществить максимальную дислокацию канюли на себя с целью расположения самораздувающейся оливы непосредственно в устье коронарного синуса и адекватного распространения кардиоплегического раствора в те крупные вены сердца, которые впадают в коронарный синус наиболее дистально;
8 — ретроградная изотермическая кровяная кардиоплегия под контролем давления в коронарном синусе. Оптимальная скорость подачи кардиоплегического раствора 220—300 мл/мин при давлении в коронарном синусе 20—45 мм рт.ст. Минимальный объем вводимого кардиоплегического раствора — не менее 500 мл, максимальный межплегический интервал — 15 мин;
9 — отсепаровывание эпикардиальной клетчатки в области межпредсердной борозды Ватерстоуна, продольная атриотомия ЛП кпереди от устьев правых легочных вен (ЛВ);
10 — ревизия полости ЛП, в том числе ушка, во избежание выполнения манипуляций при наличии внутриполостных тромбов с риском их фрагментации и неконтролируемой дислокации;
11 — попарное выделение правых и левых ЛВ, проведение обтяжек вокруг них для удобства дальнейшего позиционирования инструментов для РЧА;
12 — изоляция устьев левых Л.В. Сердце рукой хирурга за верхушку смещается из полости перикарда кпереди. Одна из браншей биполярного электрода позиционируется позади, другая кпереди от пары левых ЛВ с использованием обтяжки, проведенной при выделении Л.В. Бранши биполярного электрода зажимаются с максимально возможным захватом стенки ЛП, при этом дуга инструмента должна быть выгнута также в сторону Л.П. Данные действия позволяют увеличить площадь изолируемой поверхности прилежащих к устьям ЛВ участков Л.П. После защелкивания бранша биполярного электрода осуществляется повторный визуальный контроль уровня зажима тканей. Важно проверить, вся ли линия предполагаемого воздействия находится между рабочих поверхностей электродов, не выходя за контур бранша. После этого производится подача РЧ энергии на ткани. После индикации прибора о трансмуральном повреждении тканей бранши разводятся. Как с эндокардиальной, так и с эпикардиальной поверхности стенки предсердия визуализируется сформированная линия блока проведения. Бранши электрода смещаются параллельно этой линии на 2—3 мм и процедура повторяется вновь. Оптимальная кратность повторения для стенок ЛП — 3;
13 — изоляция основания ушка ЛП;
14 — формирование линии блока проведения от ушка ЛП к верхней левой Л.В. Для этого стенка ушка ЛП рассекается на 5—6 мм в длину, через полученное отверстие заводится одна из браншей биполярного электрода, которая направляется в верхнюю левую Л.В. После защелкивания браншей важно проконтролировать, чтобы их рабочая поверхность обязательно пересекала линию изоляции основания ушка ЛП, и далее линию, сформированную при изоляции устьев левых Л.В. При этом для надежности замыкания линий блока проведения необходимо продвигать браншу электрода на 10—15 мм по длиннику легочной вены от ее устья (рис. 1);
Рис. 1. Формирование линии блока проведения от ушка ЛП к верхней левой Л.В. Интраоперационная фотография. Бранша биполярного электрода проведена через отверстие в верхушке ушка ЛП (а) и последовательно пересекает ранее сформированную линию блока проведения в основании ушка (б) и линию вокруг левых ЛВ (в), захватывает 10—15 мм длинника стенки ЛВ (г).
15 — ушивание отверстия в ушке ЛП;
16 — завершение изоляции устьев правых Л.В. Производится позиционирование браншей биполярного электрода и РЧА способом, аналогичным при выполнении изоляции левых Л.В. Особенностью является то, что в данном случае воздействие оказывается только на заднюю стенку ЛП в области устьев ЛВ, поскольку линией блока проведения по передней стенке служит атриотомический разрез;
17 — формирование линии блока проведения по крыше Л.П. Осуществляется путем проведения браншей биполярного электрода от верхнего угла атриотомического разреза ЛП до левой верхней ЛВ с последующей троекратной РЧА. Для упрощения проведения браншей предварительно может потребоваться дополнительное «тупое» или «острое» выделение крыши левого предсердия по направлению к левой верхней ЛВ, особенно в случаях наличия в данной зоне выраженной эпикардиальной клетчатки. Кроме того, для удобства позиционирования браншей и большей надежности замыкания линий блока проведения, атриотомический разрез ЛП должен быть существенно (до 2—3 см) продлен на крышу ЛП по сравнению с тем, который необходим при выполнении изолированного оперативного приема на митральном клапане. При больших размерах ЛП, без выполнения продления разреза, длины браншей может не хватить для достижения линии блока проведения, сформированной вокруг левых Л.В. Как и в случае формирования линии от ушка ЛП к верхней левой ЛВ, при выполнении данного воздействия, бранша биполярного электрода должна с 10—15 мм запасом пересекать линию блока проведения, сформированную вокруг левых ЛВ, т. е. фактически захватывать непосредственно стенку приустьевой части левой верхней ЛВ;
18 — формирование линии блока проведения от нижнего угла атриотомического разреза ЛП до устья нижней левой ЛВ с пересечением линии блока проведения сформированной вокруг левых Л.В. Осуществляется способом, аналогичным таковому при формировании линии блока проведения по крыше Л.П. Для удобства ее выполнения следует продлить атриотомический разрез на 2—3 см на заднюю стенку ЛП в направлении ушка в зависимости от размера ЛП;
19 — формирование линии блока проведения в области митрального истмуса. Данная манипуляция исполняется в 2 приема. Сначала формируется непротяженная (длиной около 2—2,5 см) незамкнутая линия блока проведения с применением биполярного РЧА электрода от нижнего края атриотомического разреза ЛП в направлении фиброзного кольца митрального клапана (рис. 2). Вторым приемом данная линия продлевается до фиброзного кольца митрального клапана на границе сегментов Р2 и Р3 задней створки с применением трансмурального разреза стенки предсердия (рис. 3, на цв. вклейке). Главными и принципиальными моментами данного разреза являются: рассечение всей толщи миокарда ЛП до визуально различимой эпикардиальной клетчатки (обладающей свойствами диэлектрика) или просвета коронарного синуса; замкнутость линии на фиброзное кольцо МК, с одной стороны, и линию, сформированную при первом приеме. Альтернативой данным манипуляциям можно считать непрерывный разрез на всю толщу стенки ЛП от нижнего угла атриотомического разреза ЛП до фиброзного кольца МК, однако это может создать большую сложность при ушивании ЛП и больший риск сложно устранимых кровотечений;
Рис. 2. Первый прием при формировании линии блока электрического проведения в зоне митрального истмуса.Интраоперационная фотография.
Рис. 3. Второй прием при формировании линии блока электрического проведения в зоне митрального истмуса. Визуализирована эпикардиальная клетчатка и стенка коронарного синуса. Интраоперационная фотография.
20 — ушивание разреза в области митрального истмуса двухрядным швом (prolen 5/0);
21 — ушивание ушка ЛП со стороны полости ЛП двухрядным швом (prolen 4/0);
22 — формирование линии блока проведения от середины атриотомического разреза ПП до верхушки ушка ПП;
23 — формирование линии блока проведения от латерального угла атриотомического разреза ПП до ВПВ. При этом замыкание рабочих поверхностей браншей биполярного электрода производится по максимально латеральной поверхности ПП для исключения воздействия на синусовый узел. С учетом меньшей толщины тканей стенки ПП кратность выполнения РЧ воздействия может быть уменьшена до 2. При этом бранши электрода должны быть проведены вплоть до уровня канюляции ВПВ, т. е. на расстояние не менее 1 см от ее впадения в полость ПП. В случаях, если расстояние от латерального угла атриотомического разреза ПП до ВПВ больше длины браншей электрода либо имеет место перепад толщины стенки ПП, не позволяющий осуществить плотный контакт стенки ПП с рабочей поверхностью электрода, формирование данной линии можно выполнять порционно, используя небольшой разрез стенки ПП в проекции предполагаемой линии воздействия. Линии блока проведения стенок ПП необходимо исполнять в процессе проведения сеансов ретроградной кардиоплегии для сокращения времени пережатия аорты;
24 — формирование линии блока проведения от латерального угла атриотомического разреза ПП до НПВ. Данная линия формируется аналогично предыдущей и, как правило, короче ее в 3 раза и более, что не требует дополнительных приемов;
25 — продление атриотомического разреза ПП от медиального угла до фиброзного кольца ТК на 1—2 ч (рис. 4). Способ формирования данного разреза идентичен по своим принципиальным моментам, свойственным таковому в области митрального истмуса. Разрез должен быть осуществлен на всю толщу стенки ПП до визуализируемой эпикардиальной клетчатки и быть четко замкнутым на фиброзное кольцо Т.К. Данный разрез ликвидирует возможность патологического вращения электрического импульса вокруг фиброзного кольца ТК при развитии типичного трепетания предсердий. В сумме с атриотомическим разрезом ПП и линией блока проведения, сформированной в направлении НПВ, он образует функциональный аналог линии блока проведения в области каватрикуспидального истмуса;
Рис. 4. Продление атриотомического разреза правого предсердия от медиального угла до фиброзного кольца трехстворчатого клапана на 1—2 ч. Крючком удерживается створка клапана, визуализирована эпикардиальная клетчатка. Интраоперационная фотография.
26 — ушивание аналога разреза каватрикуспидального истмуса двухрядным швом (prolen 5/0);
27 — выполнение коррекции клапанного аппарата сердца;
28 — ушивание атриотомических разрезов;
29 — обязательным этапом завершения процедуры является подшивание двух пар эпикардиальных электродов для осуществления возможности предсердно-желудочковой временной электрокардиостимуляции до момента полного восстановления собственного сердечного ритма.
Подготовка к операции со стороны пациента
Перед операцией больной должен выполнить ряд обследований в поликлинике по месту жительства:
• Осмотр лечащего врача • Лабораторные исследования (клинический и биохимический анализы крови, анализ мочи) • Электрокардиограмма в 12 отведениях (ЭКГ) • Эхокардиоскопия необходима для оценки структурных и функциональных изменений в сердце (состояние клапанов, сердечной мышцы, перикарда, диаметра легочной артерии, давления в легочной артерии, механические осложнения инфаркта миокарда, опухолей сердца и др.); • Рентгенограмма органов грудной клетки в 4-х проекциях; • Коронароангиография для оценки проходимости артерий, которые снабжают кровью сердечную мышцу; • Может потребоваться катетеризация сердца для определения давления в камерах сердца, выполнение чрезпищеводной эхокардиоскопии.
Очень важный вопрос перед оперативным лечением о замене антикоагулянтной терапии, в случае если это необходимо, накануне госпитализации отменяются антиагреганты, если пациент их получает.
Госпитализация осуществляется в кардиохирургическое отделение многопрофильной клиники.
За день до операции пациента консультирует анестезиолог. Уточняет рост, вес, наличие хронических заболеваний, аллергии на лекарственные препараты, выполняет осмотр пациента. Вечером пациенту отменяют ужин. Перед сном разрешают только пить. Утром перед операцией отменяют завтрак, пить также нельзя. Выполняется премедикация.
Операция глазами пациента
В операционной анастезиолог вводит пациента в наркоз, после введения препаратов возможно небольшое кратковременное головокружение, возможно ощущение озноба или может немного бросить в жар. В остальном пациент незаметно для себя засыпает и просыпается уже в отделении (палате) интенсивной терапии. Операция выполняется под общей анестезией, поэтому больной ничего не ощущает.
Операция «лабиринт» — это комбинированное оперативное вмешательство, т.е. выполняется в ходе другой операции на сердце (например АКШ, при коррекции пороков сердца), поэтому время проведения точно указать нельзя, оно в каждом конкретном случае разное, зависит от характера операции. В среднем продолжительность от 2 до 4 часов. В любом случае, по ощущениям для пациента это длится несколько секунд.
Прогноз
Прогноз благоприятный. По разным оценкам от 88% до 98% случаев восстанавливается синусовый ритм. Примерно у 2% пациентов возникает необходимость в послеоперационном применении антиаритмических препаратов. Летальный исход по данным различных авторов составляет от 1% до 16%, в среднем примерно 7,5% . В отдаленном прогнозе при исследовании были выявлены два основных осложнения:
• Развитие дисфункции синусового узла, что потребовало имплантации электрокардиостимулятора или, при более легких случаях, ограничение пациентов в физической нагрузке. • Послеоперационная дисфункция левого предсердия.
Мерцательная аритмия (или фибрилляция предсердий)
Что такое мерцательная аритмия?
Мерцательная аритмия (или фибрилляция предсердий) – наиболее распространенная разновидность нарушений сердечного ритма. При мерцательной аритмии предсердия сокращаются хаотично и часто, снижая сократительную способность сердца как насоса за счёт отсутствия скоординированной систолы предсердий, в итоге страдает кровоснабжение органов и тканей.
Каждый пятый человек на планете старше 40 лет сталкивался с фибрилляцией предсердий в той или иной степени. Чем старше пациент, тем больше вероятность попасть в группу риска.