Симптомы и клиника состояния
Течение данного заболевания может быть асимптомным, при выпячиваниях небольших размеров, или постепенно нарастать вследствие структурных изменений аневризматической стенки. Симптомы аневризмы сонной артерии включают в себя:
- Головокружение;
- постоянный звон в ушах;
- беспричинные головные боли;
- ощущение хронической усталости;
- нарушения сна.
Чем больше размеры аневризматического образования, тем ярче становятся проявления симптоматики: учащается и усиливается головная боль, появляются неприятные ощущения в грудной области, одышка, снижения остроты зрения. Также может возникать осиплость голоса, нарушение координации, ощущение сосудистой пульсации, проводимой в голову.
Симптоматика аневризматического выпячивания включает в себя картину мини-инсульта или транзиторной ишемической атаки (TИA). TИA — это эпизод нарушения кровообращения головного мозга с временными симптомами, подобными инсульту, которые могут включать незначительные нарушения мимики лица, чрезмерную усталость или сон, мышечную слабость на одной стороне тела, невнятную речь или затруднение речи и головокружение. TИA часто считается предупреждающим знаком о том, что истинный инсульт может произойти в будущем, если что-то не сделано для его предотвращения.
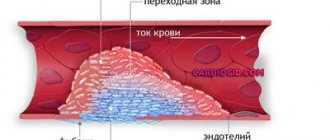
Каротидные аневризмы могут образовывать тромбы в артериях, которые блокируют кровообращение в мозге. Согласно исследованию, опубликованному Медицинским центром Университета Мэриленда (УГМК), тромбоз сонной артерии присутствовал в 6,2% от общего числа участников, прошедших скрининг. Тромбоз сонной артерии может привести к частым инсультам, которые вызывают паралич, повреждение головного мозга или смерть. Сгусток крови также может оторваться от аневризмы и двигаться в мозг, что в последствии приводит к блокированию мозговой артерии.
Сильная головная боль, которая начинается внезапно, является характерным признаком разрыва аневризмы в сонной артерии. Боль настолько сильная, что большинство людей описывают ее как «худшую боль, когда-либо ощущаемую». Чрезвычайно сильная головная боль обычно сопровождается тошнотой и рвотой, онемением шеи и в некоторых случаях временной потерей сознания.
Вторичные симптомы, вызванные аневризмой сонной артерии, возникают из-за её давления на окружающие структуры. При расширении аневризмы сжимаются нервы и вены, что приводит к таким симптомам, как отек лица и покалывание, онемение на лице или во рту, потеря голоса или охриплость, затруднение речи и затруднение при глотании.
Неразорвавшаяся аневризма сонной артерии может стать причиной проблем со зрением. Она может вызвать размытость или двоение в глазах, хронически расширенные зрачки, а также боль, иррадиирущую в лоб. В случае разрыва сонной артерии может также произойти временная потеря зрения.
Диагностика: как узнать и отличить болезнь?
Дифференцировать данное заболевание нужно со следующими патологиями: ишемическим инсультом, синдромом кавернозного синуса, кластерной головной болью, фибромышечной дисплазией, неврофиброматозом, шейной формой лимфогранулематоза.
Диагностической алгоритм аневризмы сонной артерии включает в себя:
анамнестические данные;- результаты физического осмотра (пальпируемая мешковидная опухоль в области шеи);
- УЗИ шеи. Это исследование служит для определения размера и расширения аневризмы;
- ангиографию – золотой стандарт диагностики аневризмы сонной артерии;
- контрастная КТ – обладает такими преимуществами, как легкая и быстрая применимость; является минимально инвазивным методом, который дает возможность увидеть изменения сосудистой стенки, объемом менее 1 мм;
- магнитно-резонансная ангиография – является неинвазивным методом, который может визуализировать сосудистые структуры без необходимости использования контрастной среды или рентгеновского излучения. МРА может показывать тромбированные части аневризмы и остаточные характеристики потока крови.
Материал и методы
В 2015 г. в отделении сосудистой нейрохирургии ФГБУ ФЦН Новосибирска выполнены 3 оперативных вмешательства у больных с диагнозом «Патологическая извитость ВСА с формированием мешотчатой аневризмы дистального отдела С1 сегмента». Все больные были в возрасте 62-63 года. Все они в анамнезе имели указание на нарушение мозгового кровообращения в бассейне СМА на стороне поражения ВСА: в 2 случаях — ишемический инсульт, в 1 — неоднократные ТИА. Больным была выполнена костно-пластическая краниотомия, создание высокопотокового экстраанатомического шунта между НСА и М2 сегментом СМА, проксимальное лигирование С1 сегмента ВСА.
При принятии решения о выборе метода хирургического вмешательства помимо общеклинических обследований учитывались данные дуплексного сканирования брахицефальных артерий (ДС БЦА), транскраниальной допплерографии (ТКДГ), мультиспиральной компьютерной томографической ангиографии (МСКТ-ангиографии) и магнитно-резонансной томографии (МРТ) головного мозга. По результатам ДС БЦА у всех пациентов выявлено нарушение хода ВСА в виде патологической извитости различной формы с ЛСК от 150 до 230 см/с. Аневризматическое расширение по данным УЗИ выявлено только в 1 случае. Более полная информация была получена по данным МСКТ-ангиографии экстра- и интракраниальных артерий, при которой во всех случаях выявлена патологическая извитость дистального отдела ВСА различной степени выраженности. В 2 случаях на уровне атланто-аксиального сочленения определялись мешотчатые аневризмы размером 8 и 12 мм, с частичным тромбированием аневризматического мешка (рис. 1). В 1 наблюдении выше аневризмы определялся участок надрыва интимы с фузиформным расширением дистального отдела ВСА.
Рис. 1. МСКТ-3D ангиография БЦА. Стрелкой указана дистально расположенная аневризма ВСА в сочетании с патологической извитостью артерии.
Операции проводились под общей анестезией. Первым этапом стандартным доступом выделялась бифуркация общей сонной артерии (ОСА). Параллельно производился забор лучевой артерии. Средняя длина шунта была 22,5 см. Диаметр в проксимальном отрезке составил от 2,5 до 3,4 мм, в дистальном отрезке — от 2,1 до 3,1 мм. После выполнения краниотомии выделялся М2 сегмент СМА, на него накладывались временные клипсы. Затем выполнялась продольная артериотомия М2 сегмента СМА, формировался дистальный анастомоз с дистальным отделом лучевой артерии по типу конец в бок (рис. 2). Клипсы с СМА снимались. Среднее время пережатия СМА составило от 35 до 44 мин. Шунт проводили в подкожном преаурикулярном тоннеле или под скуловой дугой в рану на шее.
Рис. 2. Формирование дистального анастомоза между М2 сегментом СМА и аутоартериальным шунтом.
После пережатия НСА формировался проксимальный анастомоз по типу конец в бок между начальным отделом НСА и графтом (рис. 3). После снятия зажимов проводился контроль кровотока по шунту и СМА с помощью допплерографии, флуометрии и видеоангиографии с индоцианиновым зеленым (ICG-VA) с временным пережатием ВСА в области устья (рис. 4). При сохранении адекватного кровотока по интракраниальным артериям выполняли лигирование ВСА в устье и ушивание операционных ран. В 1-е сутки после вмешательства всем больным выполняли контрольную МСКТ-ангиографию экстра- и интракраниальных сосудов (рис. 5). В ближайшие часы после операции ВСА в экстракраниальном отделе тромбировалась до уровня отхождения глазничной артерии без развития неврологической симптоматики (рис. 6).
Рис. 3. Формирование проксимального анастомоза между НСА и аутоартериальным шунтом.
Рис. 4. Интраоперационный контроль (ICG-VA). Стрелкой указан дистальный анастомоз.
Рис. 5. МСКТ-контроль дистального анастомоза. Стрелкой указан дистальный анастомоз между М2 сегментом СМА и аутоартериальным шунтом.
Рис. 6. МСКТ-контроль после операции. Отмечается отсутствие контрастирования ВСА в экстракраниальном отделе. Стрелкой указан высокопотоковый экстраанатомический шунт НСА-СМА (High-flow EC-IC bypass).
Осложнений оперативных вмешательств не отмечено. Пациенты выписаны в удовлетворительном состоянии на 8-10-е сутки после операции, им рекомендовано проведение антиагрегантной терапии. При контрольном осмотре через 3, 6 и 9 мес у всех больных состояние удовлетворительное, неврологический статус без отрицательной динамики. По данным контрольных ДС БЦА и МСКТ-ангиографии, проходимость шунта была сохранена во всех случаях.
Лечение и реабилитация пациента с аневризмой сонной артерии
Цель лечения аневризмы – уменьшить симптомы и снизить риск осложнений. Перед тем, как выбрать какой-либо метод, важно обсудить потенциальные выгоды, риски и побочные эффекты.
Если аневризма мала и не вызывает каких-либо симптомов, выбирается выжидающая тактика с тщательным контролем состояния, обследованием с помощью ультразвука, КТ или МРТ каждые шесть-двенадцать месяцев.
Если же есть риск осложнений — применяют хирургическое лечение. Оперативное вмешательство влечет за собой резекцию той части сонной артерии, которая связана с аневризмой, и замену удалённого участка трансплантатом.
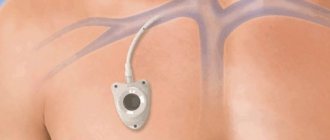
Еще одним вариантом хирургического лечения является постановка эндоваскулярного стента. Операция проводится в зависимости от размера аневризмы и ее местоположения относительно остальных ветвей сонной артерии. Хирург проходит через прокол в бедренной артерии, используя катетеры для направления и доставки стент-трансплантата в место аневризмы. Рентгеновское наведение используется для размещения трансплантата из искусственного материала в область выпячиваемой стенки сосуда. Затем стент расширяется внутри артерии и удерживается на месте металлическими крючками, а не швами. Преимущество данной методики лечения заключается в снижении операционного риска и сокращении сроков реабилитации пациента.
Реабилитация пациентов состоит из контроля за артериальном давлением, отказа от курения, соблюдением диеты (уменьшение в рационе жиров, углеводов), приема медикаментозных средств для разжижения крови, умеренных физических нагрузок.
Выводы
Итак, аневризма сонной артерии — действительно редкое заболевания, которое следует учитывать при проведении дифференциальной диагностики болезней с наличием пульсирующего образования в шее и неврологической симптоматики. У подобных пациентов могут быть такие жалобы, как дисфагия, головная боль, боль в шее, ощущение ретроорбитального давления, оталгии и симптомов сердечно-сосудистых заболеваний. Ранняя диагностика и лечение имеют большое значение, поскольку цереброваскулярные осложнения и смерть наблюдаются в 50-70 процентах случаев. А вот удовлетворительные результаты оперативного лечения убеждают в необходимости агрессивной терапии данного заболевания.
Обсуждение
Многие авторы указывают, что аневризмы экстракраниального отдела ВСА следует оперировать независимо от наличия симптомов [2, 17]. Наибольшие сложности возникают при оперативном лечении по поводу аневризм дистальных отделов ВСА в сочетании с патологической извитостью артерии. У больных нашей небольшой серии аневризмы имели близкое расположение к входу в череп. Опираясь на собственный опыт проведения эдоваскулярных и открытых хирургических вмешательств при аневризмах экстракраниального отдела ВСА [24], мы сочли рациональным отказаться от общепринятых операций и применить другую методику хирургического лечения. При обзоре литературы нам не встретились данные о выполнении операции формирования высокопотокового экстраанатомического шунта НСА-СМА (High-flow EC-IC bypass) у пациентов с дистально расположенными аневризмами ВСА в сочетании с патологической извитостью. Имеются упоминания о применении данной операции при лечении сложных аневризм головного мозга [23, 25]. Нами проведена экстраполяция хорошо зарекомендовавшей методики, используемой при лечении сложных интракраниальных аневризм, на группу больных с дистально расположенными аневризмами экстракраниального отдела ВСА. Мы считаем эту операцию менее травматичной и безопасной для пациента, поскольку не требуется выполнения сложного доступа к измененному участку артерии, включающего пересечение грудиноключично-сосцевидной мышцы, заднего брюшка двубрюшной мышцы, резекцию шиловидного отростка, смещение нижней челюсти. Описанные в литературе модификации доступа к дистальному отделу ВСА также весьма травматичны. Так, E. Rosset и соавт. [3] для доступа к аневризмам, расположенным у основания черепа, применяют вскрытие наружного слухового прохода, резекцию шиловидного отростка, резекцию сосцевидного отростка. U. Fish и соавт. [26] описали доступ к сифону ВСА путем субтотальной петрозэктомии, перемещения вперед лицевого нерва и облитерации полости среднего уха. Однако при этом наблюдается высокая частота осложнений, в первую очередь — повреждение черепно-мозговых нервов. Использованная нами методика хирургического лечения не является рутинной. Такую операцию должны выполнять хирурги, имеющие соответствующий опыт. Необходим также тщательный отбор больных с анализом возможностей альтернативных методов лечения. Как показал наш опыт, объемный кровоток по шунту (до 250 мл/мин по данным флуометрии) в достаточной мере обеспечивает адекватное кровоснабжение головного мозга после операции. Результаты проведенных нами операций, отсутствие неврологических и местных осложнений подтвердили правильность выбора хирургического способа лечения у данных пациентов.