Состав и форма выпуска
Лекарственное средство продается в аптеке в виде небольших таблеток для перорального введения. Внешне они белого оттенка с растворимой тонкой оболочкой. Фасуется в блистеры по 14 штук и вторичную картонную упаковку. В одной пачке содержится 1-2 ячейки по 14-28 таблеток и прилагается инструкция по применению.
Действующим компонентом средства выступает моксонидин. Его количество в 1 таблетке составляет 200 мкг.
Дополнительные вещества: масло касторки, целлюлоза, магния стеарат, твин 80, клуцел и аэросил.
Analysis of efficacy and safety of moxonidine in patients with hypertension and hypertensive crises
Артериальная гипертензия (АГ) является самым распространенным заболеванием в Российской Федерации. При этом в нашей стране сохраняется устойчивая тенденция неуклонного роста числа вызовов скорой медицинской помощи по поводу гипертонических кризов, являющихся наиболее серьезным осложнением АГ (1, 2, 3). Так, в целом по Российской Федерации за последние годы число вызовов бригад скорой медицинской помощи по поводу гипертонических кризов (ГК) увеличилось в среднем в 1,5 раза, составляя до 20% всех причин вызовов (4,5%), а общее число вызовов за год доходит до 50 млн (6,7).
Таким образом, оказание эффективной и, в то же время, безопасной неотложной терапии пациентам с гипертоническими кризами остается актуальной проблемой, требующей постоянного анализа и усовершенствования. В связи с появлением новых антигипертензивных препаратов и результатов рандомизированных многоцентровых исследований, внедрение их в практику, несомненно, будет способствовать улучшению прогноза и качества жизни пациентов с АГ.
К сожалению, ряд антигипертензивных препаратов, эффективно снижая АД, могут оказывать неблагоприятное метаболическое действие, нивелируя, тем самым, положительные качества препаратов. Так, бета-адреноблокаторы, успешно купирующие гиперактивность симпатической нервной системы, способны ухудшать углеводный обмен, провоцируя гипергликемии, (вплоть до развития гипергликемической комы у пациентов с сахарным диабетом (8). Провоцируя бронхоспазм бета-адреноблокаторы могут ухудшать течение бронхиальной астмы и хронических обструктивных заболеваний.
В связи с ведущей ролью симпатической гиперактивности в развитии артериальной гипертензии и гипертонических кризов в последнее время в клиническую практику активно внедряются симпатолитики нового поколения, такие как моксонидин и рилменидин.
Симпатолитики
Симпатолитики снижают АД, оказывая избирательное действие на вазомоторные центры продолговатого мозга, обеспечивающие регуляцию симпатического тонуса (11, 12, 13). Свое начало эта фармакологическая группа берет с метилдопы и клонидина, позднее были синтезированы моксонидин (физиотенз) и рилменидин. В связи с различиями точек приложения и фармакологических эффектов симпатомиметики принято разделять на препараты I поколения или «старые» и препараты II поколения или «новые».
Как видно из табл. 1 и рис. 1, метилдопа оказывает влияние исключительно на альфа2 — адренергические рецепторы, расположенные на нейронах ядер одиночного тракта продолговатого мозга. Клонидин является смешанным агонистом, так как наряду с альфа2 — адренорецепторами обладает также способностью к стимуляции I1— имидазолиновых рецепторов, расположенных в вентролатеральных отделах продолговатого мозга (14).
Таблица 1.
Точки приложения эффектов симпатолитиков
| Лекарственный препарат | Рецепторы в продолговатом мозге |
| Метилдопа | Альфа2-адренорецепторы |
| Клонидин | Альфа2-адренорецепторы+I1-имидазолиновые рецепторы |
| Моксонидин | I1-имидазолиновые рецепторы >>альфа2— адренорецепторы |
| Рилменидин | I1-имидазолиновые рецепторы >альфа2— адренорецепторы |
Рисунок 1. Точки приложения и антигипертензивное действие симпатолитиков
Препараты II поколения являются селективными агонистами I1-имидазолиновых рецепторов. В отличие от «старых» симпатомиметиков новые препараты, в особенности моксонидин, обладает низкой аффинностью к альфа2-адренорецепторам в стволе мозга (15, 16). Вследствие этого значительно снижается риск развития побочных эффектов, таких как седативное действие и сухость во рту.
Избирательность моксонидина к I1-имидазолиновым рецепторам примерно в 70 раз превосходит его избирательность по отношению к альфа2-адренорецепторам, в то время как рилменидин менее избирателен, а потому и менее эффективен (17). Известно также, что взаимодействие препаратов центрального действия с альфа2-адренорецепторами в зонах мозга, ответственно за проблемы, связанные с развитием побочных эффектов (седация, депрессия, сухость во рту и т.п.) характерно для «старых» симпатомиметиков (18, 19, 20). В терапевтических дозах моксонидин лишен побочных эффектов и вызывает дозозависимое снижение АД без развития синдрома отмены и с незначительным изменением частоты сердечных сокращений (21). Выявлено также снижение уровня ренина в плазме крови и усиление натрийуреза, что, вероятно, опосредовано стимуляцией имидазолиновых рецепторов почек (22).
Моксонидин снижает уровень ренина, ангиотензина II и альдостерона в плазме крови (22). Данные эффекты имеют особое значение, так как уменьшение активности ренин-ангиотензин-альдостероновой системы (РААС) предупреждает развитие и прогрессирование ремоделирования сердца и сосудов(23, 24, 25, 26).
Снижение гиперактивности симпатической нервной системы на фоне лечения моксонидином сопровождается повышением чувствительности тканей к инсулину, улучшением углеводного и липидного обмена, в частности, снижением уровня глюкозы плазмы крови и лептина сыворотки крови (27, 28). Положительное влияние моксонидина на углеводный и липидный обмены делает его препаратом выбора для лечения АГ у пациентов, страдающих сахарным диабетом и метаболическим синдромом.
По данным многочисленных двойных слепых рандомизированных исследований, моксонидин по антигипертензивной эффективности не уступал диуретикам, бета-адреноблокаторам, антагонистам кальция и ингибиторам АПФ, а по переносимости достоверно превосходит прежние препараты центрального действия (29-35).
Важно отметить стабильность антигипертензивного действия моксонидина — отношение остаточного снижения АД к максимальному снижению АД — этот показатель должен быть не менее 50%. У моксонидина он составляет 70%.
При применении моксонидина у пациентов с АГ наблюдается двойной механизм действия — препарат обеспечивает как краткосрочный (в основном за счет воздействия на симпатические центры головного мозга), так и долгосрочный контроль АД (за счет подавления выброса ренина и улучшения экскреторной функции почек). Так, разовая пероральная доза моксонидина (0,4 мг) вызвала статистически достоверное снижение АД у пациентов с АГ в среднем с 176/105 мм рт. ст. до 158/95 мм рт. ст. (36). При этом антигипертензивное действие препарата сопровождалось снижением исходно повышенного общего сосудистого сопротивления с 1695 до 1427 дин. сек/см5, в то время как сердечный выброс достоверно не изменялся (рис. 2).
Рисунок 2. Влияние моксонидина на сердечный выброс и общее сосудистое сопротивление (по V. Mitrovic и соавт., 1991)
Выявлена также интересная особенность моксонидина — у пациентов с АГ более высокий исходный уровень АД ассоциируется с более сильным его снижением. В связи с этим, перспективным направлением применения в клинической практике рассматривается возможность купирования моксонидином гипертонических кризов. Кроме того, отмечается эффективность и безопасность применения моксонидина при АГ и ряде сопутствующих заболеваний, таких как хроническая обструктивная болезнь легких (ХОБЛ), сахарный диабет, метаболический синдром и др.
Фармакокинетика моксонидина
При приеме внутрь абсорбция моксонидина из желудочно-кишечного тракта составляет 90% (37). Максимальная концентрация в плазме крови после однократного приема 0,2 мг препарата достигается через 60 мин. (36, 37). Биодоступность — 88%. Прием пищи не оказывает влияния на фармакокинетику моксонидина. Полупериод выведения моксонидина и метаболитов составляет 2,5 и 5 часов соответственно. В течение 24 часов более 90% препарата выводится почками (37). Моксонидин не кумулируется при длительном применении.
Многократное назначение моксонидина не приводит к кумуляции в организме больных, включая больных с почечной недостаточностью средней степени тяжести (39). На поздних стадиях у пациентов с терминальной почечной недостаточностью (клиренс креатинина менее 10 мг/мин), находящихся на гемодиализе, концентрация в плазме крови и конечный полупериод выведения в плазме крови (Т1/2), соответственно, в 6 и 4 раза оказываются выше, чем у пациентов с нормальной функцией почек. У таких пациентов дозу препарата следует подбирать индивидуально. Обнадеживающие результаты, подтверждающие ренопротективные свойства моксонидина были получены J. Radermacher и соавт. (40). У 601 пациента, перенесшего аллотрансплантацию почки, терапия моксонидином приводила к снижению риска недостаточного аллотрансплантата на 70%.
Применение моксонидина в клинической практике
В исследование TOPIC (Ttial of Physiotens in Combination), проведенном в Великобритании на 138 клинических базах (42), было включено 566 пациентов с АГ в возрасте 18-80 лет. При назначении моксонидина в дозе 0,2 мг или 0,4 мг в день надежный контроль при монотерапии был достигнут у 294 пациентов (52%), у остальных пациентов — при комбинированной терапии (в сочетании с амлодипином или эналаприлом). В ходе исследования препарат зарекомендовал себя эффективным и хорошо переносимым как в условиях монотерапии, так и комбинированной терапии.
Высокая антигипертензивная эффективность моксонидина подтверждена при лечении пациентов с неосложненным гипертоническим кризом. Так, при сублингвальном назначении моксонидина в дозе 0,4 мг эффективное снижение АД при хорошей переносимости препарата достигалась у 90% пациентов (5). Как видно на рис. 3, существенное снижение систолического АД и диастолического АД после однократного приема препарата отмечается уже через 20 мин и достигает максимума через 1,5 часа.
Рисунок 3. Изменения САД (а) и ДАД (б) при сублингвальном применении 0,4 мг моксонидина:до лечения (0); через 20 и 30 мин; через 1,5 и 3 ч после приема (по В. В. Руксину и О. В. Гришину, 2011)
САД — систолическое артериальное давление; ДАД — диастолическое артериальное давление
Важно отметить, что у обследованных пациентов отсутствовал синдром «рикошета» и динамический контроль уровня АД подтвердил устойчивый и длительный характер антигипертензивного действия моксонидина.
Выявлено положительное влияние моксонидина на течение АГ при лечении весьма трудной для антигипертензивной терапии пациентов, а именно — пациентов с ХОБЛ (43). Как правило, таким пациентам противопоказаны бета-адреноблокаторы, а также ингибиторы АПФ, способные провоцировать кашель и усиление бронхиальной обструкции. При исследовании 40 пациентов артериальной гипертензией на фоне ХОБЛ лечение моксонидином сопровождалось улучшением гемодинамики большого и малого круга кровообращения. Так, снижение систолического АД и диастолического АД составило 15,4 и 17,4% соответственно, достигая при этом нормальных значений. Частота пульса в процессе лечения оставалась в пределах нормы и существенно не изменялась.
Таким образом, селективный ингибитор I1-имидазолиновых рецепторов моксонидин (физиотенз) может применяться в качестве универсального антигипертензивного препарата, эффективного как для купирования гипертонических кризов, так и для длительного лечения артериальной гипертензии. В отличие от «старых» препаратов центрального действия, таких как клонидин, метилдопа, моксонидин не вызывает серьезных нежелательных явлений; отсутствуют также гипотензивные эффекты «первой дозы» и синдром рикошета. Моксонидин может рассматриваться препаратом выбора для лечения артериальной гипертензии и неосложненных гипертонических кризов у пациентов с сахарным диабетом, метаболическим синдромом и хроническими обструктивными заболеваниями легких.
С 2010 г. под эгидой секции ВНОК «Неотложная кардиология» проводится рандомизированное многоцентровое сравнительное исследование эффективности моксонидина у больных с неосложненным гипертоническим кризом. Исследование проводится в 14 клинических центрах в разных регионах Российской Федерации. В исследовании планируется участие 280 пациентов с неосложненным гипертоническим кризом, находящиеся в момент включения в исследование в стационаре. Пациенты рандомизированы на две группы: 1-я группа (n=140) получает однократно внутрь моксонидин в дозе 400 мкг, 2-я контрольная группа (n=140) — каптоприл в дозе 25 мг. Длительность наблюдения действия моксонидина и каптоприла составляет 24 часа. Результаты данного исследования будут опубликованы в этом году.
Н.И. Гапонова, В.Р. Абдрахманов, В.Л. Бараташвили, С.Н. Терещенко
Литература:
1. Терещенко С.Н. Гипертонические кризы: диагностика и лечение. В кн.: Руководство по артериальной гипертонии / под ред. Е.И. Чазова, И.Е. Чазовой. — Медиа Медика, 2005. — С. 677-689.
2. Руксин В.В. Экстренная помощь при артериальной гипертензии: краткое руководство для врачей. — М.: МЕДпресс-информ, 2009. — 48 с.
3. Гапонова Н.И., Плавунов Н.Ф., Терещенко С.Н. и др. Клинико-статистический анализ артериальной гипертензии, осложненной гипертоническим кризом, в Москве за 2005-2009гг. — Кардиология, 2011; 2: 40-44.
4. Голиков А.П. Кризы при гипертонической болезни: вчера и сегодня. — Артериальная гипертензия, 2004; 3: 23-27.
5. Руксин В.В., Гришин О.В. Неотложная помощь при повышении артериального давления, не угрожающем жизни. — Кардиология, 2011; 2: 45-51.
6. Здравоохранение в России 2005. — Стат. Сборник. — М.: Росстат, 2006. — 312 с.
7. Слепушенко И.А. Совершенствование организации скорой медицинской помощи в Российской Федерации. — Скорая помощь, 2007; 3: 3-6.
8. Диагностика и лечение в кардиологии / под ред. М.Х. Кроуфорда. — Пер. с англ. — М.: МЕДпресс-информ, 2007. — 800 с.
9. JNC VII — The Seventh Report of the Joint National Committee on Prevention, Detection, Evaluation and Treatment of High Blood Pressure. U.S. Department of Health and Human Servies. National Institutes of Health. National Heart, Ling and Blood Institute. National High Blood Pressure Education Program — NIH Publication № 03-5233, 2003.
10. Рекомендации по профилактике, диагностике и лечению артериальной гипертензии. — Артериальная гипертензия. — 2001. — 7 (Приложение), 1-16.
11. Wyss J.M. The role of the sympathetic nervous system in hypertension. Curr Opin Nephrol Hypertens, 1993; 2; 265-273.
12. Hamilton C.A. Chemistry, mode of action and experimental pharmacology of moxonidine. In: van Zwieten P.A. et al., editors. The I1-Imidazoline Receptor Agonist Moxonidine. 2 nd Edition London. Roy Soc Med. 1996; 7-30.
13. Кобалава Ж.Д., Котовская Ю.В. Артериальная гипертония 2000: ключевые аспекты диагностики, дифференциальной диагностики, профилактики, клиники и лечения. — М., 2001. — 208 с.
14. Van Zwieten P.A., Thoolen M.J., Timmermans P.B. The hypotensive activity and side effects of methyldopa, clonidine and guanfacine. Hypertension, 1984; 6 (2): 28-33.
15. Ziegler D., Haxhiu M.A., Kaan E.C. et al. Pharmacology of moxonidine, an I1-imidazoline receptor agonist. J. Cardiovasc. Pharmacol., 1996: 27 (suppl 3), S 26-S37.
16. Ernsberger P.R., Westbrooks K.L., Christen M.O. et al. A second generation of centrally acting antihypertensive agents act on putative I1-imidazoline receptors. J. Cardiovasc. Pharmacol. 1992; 20 (supll 4): S1-S10.
17. Schachter M., Mitchell G., Nizol C. et al. Antihipertensive efficacy of moxonidine in primary care: a «REAL-LIFE» study. Int J. Clin Pract., 2003; 57 (6): 479-482.
18. Planitz V. Crossover comparison of moxonidine and clonidine HCL in mild to moderate hypertension. Eur J. Clin Pharmacol., 1984; 27: 147-152.
19. Planitz V. Comparison of moxonidine and clonidine in treating patients with hypertension. J. Clin Pharmacol., 1987; 27: 46-51.
20. Schwarz W., Kandziora J. Long-term experiences with moxonidine, a new antihypertensive. Fortsch. Med., 1990; 32: 616-620.
21. Prichard BNC., Küster L.J., Hughes P.R. et al. Dose relation of blood pressure reduction with moxonidine findings from three placebo — and active — comntrolled randomized studies. J. Clin Basic Cardiol. 2003; 6: 49-51.
22. Sanjuliani A. E., Genelhu de Abreu V., Ueleres Braga J., Francischetti E.A. Effects of moxonidine on the sympathetic nervous system, blood pressure, plasma renin activity, plasma aldosterone, leptin and metabolic profile in obese hypertensive patients. J. Clin Basic Cardial., 2004; 7; 19-25.
23. Eichstädt H., Gatz G., Schröder R. et al. Left ventricular hypertrophy regression with moxonidine therapy. J. Pharmacol Ther. 1991; 1: 12-17.
24. Hüting J., Mitrovic V., Bahavar H. Comparison of the effects of moxonidine and nifedipine on left ventricular function during monotherapy of essential hypertension. Herz-Kreislauf. 1992; 24: 132-136.
25. Haczynski J., Spring A., Przewlocka-Kosmala M. et al. Effect of moxonidine on left ventricular hypertrophy in hypertensive patients. J. Clin Basic Cardiol., 2001; 4: 61-65.
26. Chazova I., Almazov V. A., Shlyakhto E. Moxonidine improves glycaemic control in mildly hypertensive, overweight patients: a comparison with metformin. Diabets, Obesity and Metabolism, 8, 2006, 456-465.
27. Julius S., Valentini M. Conseguences of the increased autonomic nervous drive in hypertension, heart failure and diabetes. Blood Press, 1998; 7 (3): 5-13.
28. Huggett R. J., Scott E. M., Gilbey S. G. et al. Impact of type 2 diabetes mellitus on sympathetic neural mechanisms in hypertension. Circulation, 2003; 108: 3097-3101.
29. Frei M., Küster l., Gardosch von Krosigk P-P., et al. Moxonidine and hydrochlorothiazide in combination: a synergistic antihypertensive effect. J. Cardiovasc Pharmacol 1994; 24: 25-28.
30. Prichard B.N.C, Simmons R., Rooks M.J., et al. A double-blind comparison of moxonidine and atenolol in the management of patients with mild — to moderate hypertension. J. Cardiovasc Pharmacol 1992; 20: 45-49.
31. Wolf R. The treatment of hypertensive patients with a calcium antagonist or moxonidine:a comparison. J. Cardiovasc Pharmacol 1992; 20: 42-44.
32. Lotti G., Gianrossi R. Moxonidin vs. captopril in mild to moderate hypertension (German). Fortschr Med 1993; 111 (27); 429-432.
33. Kraft K, Vetter H. Twenty — four— hour blood pressure profiles in patients with mild — to — moderate hypertension; moxonidine versus captopril. J. Cardiovasc Pharmacol 1994; 24 (suppl 1), S 29-S33.
34. Küppers H.E., Jäger B.A., Luszick J.H. et al. Placebo-controlled comparison of the efficacy and tolerability of once — daily moxonidine and enalapril in mild — to moderate essential hypertension. J., Hypertens 1997; 15: 93-97.
35. Prichard B.N.C., Kuster L.J., Hughes P. R. et al. Dose relation of blood pressure reduction with moxonidine: findings from three placebo — and active — controlled randomized studies. J. Clin Basic Cardiol 2003; 6: 49-51.
36. Mitrovic V., Patyna W., Hütting J. et al. Hemodinamic and neurohumoral effecte of moxonidine in patients with essential hypertension. Cardiovase Drugs Ther. 1991; 5: 967-972.
37. Theodor R., Weimann H.J., Weber W. et al. Absolute bio-availability of moxonidine. Eur. J. Drug Metab Pharmacokinet 1991; 16 (2): 153-159.
38. Weimann H.J., Rudolph M. Clinical pharmacokinetics of moxonidine, J. Cardiovasc. Pharmacol., 1992; 20 (suppl 4), S537-S541.
39. Kirch W., Hutt H., J., Plänitz V. The influence of renal function on clinical pharmacokinetics of moxonidine. Clin Pharmacokinet, 1988; 15: 245-253.
40. Radermacher J., Mengel M., Ellis S. et al. The renal arterial resistance index and renal allograft survival. New Engl. J. Med., 2003; 349: 115-124.
41. Vonend O., Marsalex P., Russ H. et al. Moxonidine treatment of hypertensive patients with advanced renal failure. J.Hypertens. 2003; 21: 1709-1707.
42. Waters J., Ashford J., Jager B.A. et al. Use of moxonidine as unitial therapy and in combination in the treatment of essential hypertension: results of the TOPIC (Trial of Physiotens in Combination) study. J. Clin Basic Cardiol., 1999; 2: 219-224.
43. Адашева Т.В., Задионченко В.С., Мациевич М.В. и др. Артериальная гипертония и ХОБЛ — рациональный выбор терапии. РМЖ, 2006; 10: 795-800.
Фармакологическое действие
Препарат относится к группе антигипертензивных средств. Является прямым агонистом рецепторов имидазолинов. При однократно применении помогает одновременно восстанавливать уровень диастолического и систолического давления. При этом не изменяет деятельность сердца и не влияет на частоту сердечных сокращений.
Лекарственное средство обладает высокой усвояемостью вне зависимости от времени приема пищи. Биологическая доступность препарата не менее 88%. Наивысшая концентрация препарата в красном русле отмечается через 30 минут или максимум 3 часа.
Моксонидин (Moxonidine)
Всасывание
После приема внутрь моксонидин быстро и почти полностью абсорбируется в верхних отделах желудочно-кишечного тракта (около 90%). Абсолютная биодоступность составляет приблизительно 88 %, что указывает на отсутствие значительного эффекта «первого прохождения». Время достижения максимальной концентрации — около 1 часа. Прием пищи не оказывает влияния на фармакокинетику препарата.
Распределение
Связь с белками плазмы крови составляет 7,2%.
Метаболизм
Основной метаболит — дегидрированный моксонидин. Фармакодинамическая активность дегидрированного моксонидина — около 10% по сравнению с моксонидином.
Выведение
Период полувыведения (Т1/2) моксонидина и его метаболита составляет 2,5 и 5 часов, соответственно. В течение 24 часов почками выводится свыше 90% моксонидина (около 78% — в неизменном виде, 13% — в виде дегидрированного моксонидина, другие метаболиты в моче не превышают 8% от принятой дозы). Менее 1% дозы выводится через кишечник.
Фармакокинетика у пациентов с артериальной гипертензией
По сравнению со здоровыми добровольцами у пациентов с артериальной гипертензией не отмечается изменений фармакокинетики моксонидина.
Фармакокинетика в пожилом возрасте
Отмечены клинически незначимые изменения фармакокинетических показателей моксонидина у пожилых пациентов, вероятно обусловленные снижением интенсивности его метаболизма и/или несколько более высокой биодоступностью.
Фармакокинетика у детей
Моксонидин не рекомендуется для использования у лиц моложе 18 лет, в связи с чем в этой группе фармакокинетические исследования не проводились.
Фармакокинетика при почечной недостаточности
Выведение моксонидина в значительной степени коррелирует с клиренсом креатинина (КК). У пациентов с умеренной почечной недостаточностью (КК в интервале 30-60 мл/мин) равновесные концентрации в плазме крови и конечный Т1/2 приблизительно в 2 и 1,5 раза соответственно выше, чем у лиц с нормальной функцией почек (КК более 90 мл/мин).
У пациентов с тяжелой почечной недостаточностью (КК менее 30 мл/мин), равновесные концентрации в плазме крови и конечный Т1/2 в 3 раза выше, чем у пациентов с нормальной функцией почек.
Назначение многократных доз моксонидина приводит к предсказуемой кумуляции в организме пациентов с умеренной и тяжелой почечной недостаточностью.
У пациентов с терминальной почечной недостаточностью (КК менее 10 мл/мин), находящихся на гемодиализе, равновесные концентрации в плазме крови и конечный Т1/2 соответственно в 6 и 4 раза выше, чем у пациентов с нормальной функцией почек.
У пациентов с умеренной почечной недостаточностью максимальная концентрация моксонидина в плазме крови выше в 1,5-2 раза. У пациентов с нарушениями функции почек дозировка должна подбираться индивидуально. Моксонидин в незначительной степени выводится при проведении гемодиализа.
Противопоказания
Запрещено принимать лекарство при следующих состояниях:
- Индивидуальная непереносимость действующего или вспомогательного компонентов.
- Острая форма брадикардии.
- Тяжелое течение аритмии.
- Глаукома.
- Психические расстройства.
- Недостаточность сердечной деятельности.
- Перенесенный ранее отек Квинке.
- Период вынашивания ребенка и грудного вскармливания.
- Дети до 18 лет.
- Нарушение работы печени и почек.
- Стенокардия.
- Недостаточность лактозы или ее непереносимость.
- Различные патологии кровеносной системы.
Побочные эффекты
В результате лечения Моксонидином, у пациентов могут возникнуть следующие побочные реакции:
- Высокая утомляемость, недомогание.
- Мигрень.
- Расстройство сна — бессонница или сонливость.
- Головокружение, головная боль.
- Диспептические проявления — сухость в ротовой полости, дискомфортные ощущения в эпигастрии, тошнота, рвота, нарушение стула.
- Повышенная нервозность и раздражительность.
- Отечность периферических тканей.
- Резкое понижение пульса и давления.
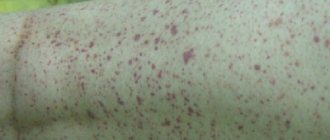
- Аллергические признаки — кожная сыпь и сильный зуд.
Препарат центрального действия моксонидин в лечении артериальной гипертензии
По данным эпидемиологических исследований, распространенность артериальной гипертензии (АГ) среди взрослого населения в развитых странах мира колеблется от 20% до 40% и увеличивается с возрастом [3]. Повышенное АД обнаруживается более чем у 50% мужчин и женщин старше 60 лет [4]. Актуальность проблемы поддерживается возрастающими процессами урбанизации общества, создающими предпосылки для возникновения факторов риска, таких как стресс, гиподинамия, ожирение, вредные привычки и нарушенная экология. Повышенное АД является одним из главных факторов риска развития мозгового инсульта, ишемической болезни сердца (ИБС) и других сердечно-сосудистых заболеваний атеросклеротического происхождения, с которыми связано более 50% всех случаев смерти [5]. Согласно современным национальным рекомендациям [6], рекомендациям Европейского общества по артериальной гипертонии и Европейского общества кардиологов [7], тактика лечения эссенциальной АГ зависит от уровня АД и степени риска кардиоваскулярных осложнений. Основной целью лечения является максимальное снижение риска развития сердечно-сосудистых осложнений и смерти от них. Основными задачами – нормализация уровня АД с целью предупреждения осложнений при отсутствии или минимальном уровне нежелательных лекарственных реакций, коррекция всех модифицируемых факторов риска (курение, дислипидемия, гипергликемия, ожирение), предупреждение, замедление темпа прогрессирования и/или уменьшение поражения органов-мишеней, а также лечение ассоциированных и сопутствующих заболеваний – ИБС, сахарного диабета (СД) и т. д. [6, 7]. При лечении больных АГ величина АД должна быть менее 140/90 мм рт. ст., что является ее целевым уровнем. При хорошей переносимости назначенной терапии целесообразно снижение АД до более низких значений. У пациентов с высоким и очень высоким риском сердечно-сосудистых осложнений необходимо снизить АД до 140/90 мм рт. ст. и менее в течение 4 нед. В дальнейшем, при условии хорошей переносимости, рекомендуется снижение АД до 130/80 мм рт. ст. и менее. У больных ИБС уровень АД необходимо снижать до целевого значения 130/85 мм рт. ст. У больных с СД и/или заболеванием почек целевой уровень АД должен составлять менее 130/85 мм рт. ст. [6]. Единых рекомендаций относительно того, с каких именно средств следует начинать лечение больного, нет. Выбор лекарственного средства зависит от многих факторов, в т. ч. от возраста, пола и наличия сопутствующих заболеваний. В настоящее время для лечения АГ рекомендованы 5 основных классов антигипертензивных препаратов: ингибиторы ангиотензинпревращающего фермента (иАПФ), блокаторы рецепторов AT1 (БРА), антагонисты кальция (АК), β-адреноблокаторы (БАБ), диуретики. В качестве дополнительных классов для комбинированной гипотензивной терапии могут использоваться α-адреноблокаторы, агонисты имидазолиновых I1-рецепторов и прямые ингибиторы ренина [6, 7].
Агонисты имидазолиновых рецепторов (моксонидин, рилменидин) являются современными лекарственными средствами с центральным механизмом действия – снижают активность сосудодвигательного центра продолговатого мозга. Также к гипотензивным средствам центрального действия относят клонидин, гуанфацин, метилдопу [1, 2]. Моксонидин (Моксарел, ЗАО «Вертекс», Россия) – высокоселективный агонист имидазолиновых I1-рецепторов, расположенных в ростральном вентролатеральном отделе продолговатого мозга. Стимуляция этих рецепторов снижает симпатический поток и, соответственно, АД путем уменьшения резистентности сосудов. Кроме того, снижается активность сосудодвигательного центра, уменьшаются сердечный выброс, периферическая симпатическая активность. Прием моксонидина приводит к снижению системного сосудистого сопротивления и АД. Моксонидин снижает уровень ренина, ангиотензина II и альдостерона в плазме крови [20]. После приема внутрь пиковая концентрация достигается в пределах 1 ч. Период полувыведения в плазме составляет 2 ч и увеличивается при почечной недостаточности. Несмотря на относительно короткий период полувыведения, АД эффективно регулируется однократным приемом препарата в сутки. Антигипертензивный эффект длится значительно дольше, что связано с задержкой препарата в центральной нервной системе. Симпатоингибирующий эффект моксонидина, вероятно, опосредуется практически полностью его влиянием на I-рецепторы. Моксонидин отличается от других симпатолитических гипотензивных средств более низким сродством к центральным α2-адренорецепторам, что объясняет меньшую вероятность развития седативного эффекта и сухости во рту, по сравнению с клонидином. Антигипертензивная эффективность моксонидина при эссенциальной АГ доказана в масштабных двойных слепых плацебо-контролируемых рандомизированных исследованиях и сравнима с таковой большинства других антигипертензивных препаратов [8].
Прием пищи не оказывает влияния на фармакокинетику препарата. Препарат хорошо всасывается из желудочно-кишечного тракта и почти полностью абсорбируется в его верхних отделах. Абсолютная биодоступность составляет приблизительно 88%. Максимальная концентрация в крови регистрируется через 0,5–3 ч. Связь с белками плазмы крови составляет 7,2%. 90% препарата выводится почками, в основном (70%) в неизмененном виде. Период полувыведения (Т1/2) моксонидина и метаболита составляет 2,5 и 5 ч соответственно. Несмотря на короткий период полужизни (около 3 ч), он контролирует АД в течение суток [9]. Моксонидин эффективен при монотерапии АГ, однако оптимально его назначение в составе комбинированной терапии, например, с иАПФ, сартанами (БРА), тиазидными диуретиками и другими основными гипотензивными средствами. Сочетание моксонидина с другими гипотензивными средствами усиливает их антигипертензивный эффект. Моксонидин при добавлении к терапии БРА II (эпросартан) нормализует АД и симпатическую гиперактивность у гипертензивных нормоволемических пациентов с хронической почечной недостаточностью. Моксонидин по антигипертензивной эффективности не уступает диуретикам, БАБ, АК и иАПФ, а по переносимости достоверно превосходит прежние препараты центрального действия. Он более безопасен, чем клонидин, пропранолол, каптоприл, нифедипин. Моксонидин улучшает на 21% индекс чувствительности к инсулину (в сравнении с плацебо) у пациентов с ожирением, инсулинорезистентностью и умеренной степенью АГ. Седативный эффект выражен значительно меньше, чем у других препаратов центрального действия. Препарат потенцирует эффекты средств, угнетающих ЦНС, – этанола, транквилизаторов, барбитуратов. Моксонидин способен умеренно улучшать ослабленные когнитивные функции у пациентов, получающих лоразепам. Назначение моксонидина совместно с бензодиазепинами может сопровождаться усилением седативного эффекта последних [1, 6, 8–10, 13–19].
В исследование TOPIC (Trial Of Physiotens In Combination), проведенное в Великобритании на 138 клинических базах, были включены 566 пациентов с АГ в возрасте 18–80 лет. При назначении моксонидина в дозе 0,2 или 0,4 мг/сут надежный контроль при монотерапии был достигнут у 294 (52%) пациентов, у остальных – при комбинированной терапии (в сочетании с амлодипином или эналаприлом). В ходе исследования препарат зарекомендовал себя как эффективный и хорошо переносимый и в условиях монотерапии, и комбинированной терапии [10, 11]. При применении моксонидина у пациентов с АГ наблюдается двойной механизм действия – препарат обеспечивает как краткосрочный (в основном за счет воздействия на симпатические центры головного мозга), так и долгосрочный (за счет подавления выброса ренина и улучшения экскреторной функции почек) контроль АД. Так, разовая пероральная доза моксонидина (0,4 мг) вызвала статистически достоверное снижение АД у пациентов с АГ в среднем со 176/105 мм рт. ст. до 158/95 мм рт. ст. [10, 11].
Для лечения больных с мягкой и умеренной АГ рекомендована начальная доза Моксарела (моксонидина) 0,2 мг/сут. Если реакция на лечение неудовлетворительная, через 2 нед. дозу удваивают. Дозы 0,2–0,4 мг/сут в большинстве случаев было достаточно для поддержания АД на удовлетворительном уровне. Высокая антигипертензивная эффективность моксонидина подтверждена при лечении пациентов с неосложненным гипертоническим кризом. Так, при сублингвальном назначении моксонидина в дозе 0,4 мг эффективное снижение АД при хорошей переносимости препарата достигалось у 90% пациентов. Существенное снижение систолического АД и диастолического АД после однократного приема препарата отмечается уже через 20 мин и достигает максимума через 1,5 ч [1, 2, 10, 12]. Моксарел (моксонидин) занимает особое место в терапии АГ, сочетающейся с ожирением. За счет активации имидазолиновых I1-рецепторов он способствует снижению гидролиза жиров, уменьшению свободных жирных кислот, усилению метаболизма глюкозы и повышению чувствительности к инсулину, снижению уровня триглицеридов, повышению липопротеидов высокой плотности и снижению уровня ингибитора активатора плазминогена-1. В исследованиях получены данные о влиянии моксонидина на уменьшение инсулинорезистентности у пациентов с избыточным весом и нарушением толерантности к глюкозе. Так, в сравнительном исследовании ALMAZ была проведена оценка влияния моксонидина и метформина на гликемический контроль у пациентов с избыточным весом, мягкой АГ, инсулинорезистентностью и нарушением толерантности к глюкозе. Критериями включения пациентов в исследование были: возраст старше 40 лет, индекс массы тела (ИМТ) >27 кг/м2, глюкоза натощак >6,1 ммоль/л. Исследование ALMAZ показало, что моксонидин понижал уровень глюкозы натощак, снижал вес пациентов, повышал скорость утилизации глюкозы, снижал инсулинорезистентность. На фоне моксонидина уровень глюкозы натощак снижался менее выраженно, чем на фоне метформина, но достоверно снижался уровень инсулина, в то время как метформин на него не влиял, а ИМТ снижался равнозначно на фоне обоих препаратов. Оба препарата статистически достоверно повышают чувствительность к инсулину после нагрузки глюкозой. Моксонидин оказывает влияние на уровень инсулина в крови, метформин регулирует уровень глюкозы, что сопровождается снижением гликозилированного гемоглобина. Оба препарата статистически достоверно снижают массу тела, оставаясь метаболически нейтральными к липидам [21–26].
Длительная терапия моксонидином пожилых больных с АГ 1–2 степени обеспечивает оптимальное снижение АД в дневное и ночное время при хорошей переносимости препарата (низкая частота и незначительная выраженность побочных эффектов), приводит к достоверному уменьшению гипертрофии левого желудочка, снижению индекса массы миокарда левого желудочка. Монотерапия моксонидином в течение 24 нед. оказывает положительное влияние на когнитивные функции (память и мышление), что свидетельствует об улучшении функционирования лобных долей головного мозга. В области интеллектуальной деятельности наблюдалась положительная динамика – повысились возможности больных в выполнении действий, требующих более высокого уровня обобщения в наглядно-образной и зрительно-логической сферах. Кроме того, на фоне лечения выявлены положительные изменения памяти – возросла продуктивность запоминания [27]. Для пациентов с метаболическим синдромом важно также отметить нефропротективный эффект моксонидина. Длительное применение моксонидина вызывает достоверное снижение микроальбуминурии, концентраций свободного тромбомодулина и ингибитора активатора плазминогена в крови. По результатам постмаркетингового обзорного исследования, моксонидин эффективно снижает АД у больных c метаболическим синдромом и одновременно способствует уменьшению массы тела у пациентов с ожирением. После 8 нед. лечения у пациентов было зарегистрировано снижение массы тела в среднем на 1,4 кг, при этом наиболее выраженное снижение было отмечено у больных с ожирением. Частота использования комбинированной антигипертензивной терапии составила 81,1% среди больных с метаболическим синдромом и 63,3% – по группе в целом. Было выявлено значительное снижение систолического (26,9±15,1 мм рт. ст., 95% ДИ 26,4–27,3) и диастолического (13,2±9,5 мм рт. ст., 95% ДИ 12,9–13,5) АД. Высокая эффективность моксонидина (снижение диастолического артериального давления до уровня <90 мм рт. ст. и/или снижение диастолического артериального давления >10 мм рт. ст.) была зарегистрирована у 94% пациентов. Сходным образом положительный эффект наблюдался у большого числа пациентов с метаболическим синдромом – 94%, ожирением – 93%, СД – 94% и получавших монотерапию – 95% [28–31].
Выводы. Моксарел (моксонидин) является препаратом выбора из гипотензивных средств с центральным механизмом действия и характеризуется высокой антигипертензивной эффективностью и переносимостью у пациентов с избыточной массой тела, ожирением, метаболическим синдромом или без него, а также обладает дополнительными метаболическими свойствами и оказывает благоприятное действие на массу тела. Моксонидин хорошо переносится, мало взаимодействует с другими препаратами и у большинства пациентов может использоваться однократно в сутки. Моксарел (моксонидин) показан для лечения больных мягкой и умеренной АГ, и в особенности в качестве дополнительного лекарственного средства, – при лечении пациентов с метаболическим синдромом.
Литература 1. Клиническая фармакология и фармакотерапия / Под ред. В.Г. Кукеса, А.К. Стародубцева. М.: ГЭОТАР-Медиа, 2012. 832 с. 2. Клиническая фармакология: национальное руководство (Серия «Национальные руководства»). М.: ГЭОТАР-Медиа, 2014. 976 с. 3. Оганов Р.Г., Тимофеева Т.Н., Колтунов И.Е. и др. Эпидемиология артериальной гипертонии в России. Результаты федерального мониторинга 2003–2010 гг. // Кардиоваскулярная терапия и профилактика. 2011. № 1. С. 9–13. 4. ABC Of Hypertension / Ed. by D. Gareth Beevers, Gregory H. Lip and Eoin O’Brien. 5th ed. Malden, Mass.: BMJ Books, 2007. P. 88. 5. Ezzati M., Lopez A.D., Rodgers A. et al. Selected major risk factors and global and regional burden of disease // Lancet. 2002. Vol.360(9343). P.1347–1360. 6. Диагностика и лечение артериальной гипертензии. Рекомендации Российского медицинского общества по артериальной гипертонии и Всероссийского научного общества кардиологов. Четвертый пересмотр // Системные гипертензии. 2010. № 3. С. 5–26. 7. ESH-ESC Guidelines Committee. 2013 guidelines for the management of arterial hypertension // J. Hypertens. 2013. Vol. 31. P. 1281–1357. 8. Neumann J., Ligtenberg G., Oey L. et al. Моксонидин нормализует симпатическую гиперактивность у пациентов с ХПН, получающих эпросартан // J. Amer. Soc. Nephrol. 2004. Vol.15. P. 2902–2907. 9. Инструкция (ТКФС) препарата Моксарел. 10. Гапонова Н.И., Абдрахманов В.Р., Бараташвили В.Л., Терещенко С.Н. Анализ эффективности и безопасности применения моксонидина у пациентов с артериальной гипертензией и гипертоническими кризами // Практическая медицина. Кардиология. 2011. 04. 11. Waters J., Ashford J., Jager B.A. et al. Use of moxonidine as unitial therapy and in combination in the treatment of essential hypertension: results of the TOPIC (Trial of Physiotens in Combination) study // J. Clin Basic Cardiol. 1999. Vol. 2. P. 219–224. 12. Руксин В.В., Гришин О.В. Неотложная помощь при повышении артериального давления, не угрожающем жизни // Кардиология. 2011. № 2. С. 45–51. 13. Frei M., Küster l., Gardosch von Krosigk P-P. et al. Moxonidine and hydrochlorothiazide in combination: a synergistic antihypertensive effect // J. Cardiovasc. Pharmacol. 1994. Vol. 24. P. 25–28. 14. Prichard B.N.C, Simmons R., Rooks M.J. et al. A double-blind comparison of moxonidine and atenolol in the management of patients with mild – to moderate hypertension // J. Cardiovasc. Pharmacol.1992. Vol. 20. P. 45–49. 15. Wolf R. The treatment of hypertensive patients with a calcium antagonist or moxonidine: a comparison // J. Cardiovasc. Pharmacol. 1992. Vol. 20. P. 42–44. 16. Lotti G., Gianrossi R. Moxonidin vs. captopril in mild to moderate hypertension (German) // Fortschr. Med. 1993. Vol. 111 (27). P. 429–432. 17. Kraft K., Vetter H. Twenty – four – hour blood pressure profiles in patients with mild – to – moderate hypertension; moxonidine versus captopril // J. Cardiovasc. Pharmacol. 1994. Vol. 24 (Suppl. 1). S. 29–S33. 18. Küppers H.E., Jäger B.A., Luszick J.H. et al. Placebo-controlled comparison of the efficacy and tolerability of once – daily moxonidine and enalapril in mild – to moderate essential hypertension // J. Hypertens. 1997. Vol.15. P. 93–97. 19. Prichard B.N.C., Kuster L.J., Hughes P.R. et al. Dose relation of blood pressure reduction with moxonidine: findings from three placebo – and active – controlled randomized studies // J. Clin. Basic. Cardiol. 2003. Vol. 6. P. 49–51. 20. Sanjuliani A.E., Genelhu de Abreu V., Ueleres Braga J., Francischetti E.A. Effects of moxonidine on the sympathetic nervous system, blood pressure, plasma renin activity, plasma aldosterone, leptin and metabolic profile in obese hypertensive patients // J. Clin Basic Cardial. 2004. Vol. 7. P. 19–25. 21. Метаболический синдром. М.: «МЕДпрес-информ», 2007. 22. Мкртумян А.М., Бирюкова Е.В. Основной подход к фармакотерапии метаболического синдрома // Consilium medicum. 2006. Т. 8, № 5. C.54–57. 23. Мычка В.Б., Чазова И.Е. Метаболический синдром. Возможности диагностики и лечения. (Подготовлено на основе рекомендаций экспертов ВНОКпо диагностике и лечению метаболического синдрома), 2008. C. 1–16. 24. Чазова И.Е., Алмазов В.А., Шляхто Е.В. Моксонидин улучшает гликемический контроль у пацинтов с артериальной гипертонией и избыточной массой тела в сравнении с метформином: исследование ALMAZ // Diabetes, Obesity and Metabolism. 2006. Vol. 8. P. 456–465. 25. Scarpello J.H., Howlett H.C. Metformin therapy and clinical uses // Diab. Vase. Dis. Res. 2008. Vol. 5. P. 157–167. 26. Шилов А.М., Авшалумов А.Ш., Синицина Е.Н., Еремина И.В. Коррекция факторов риска у пациентов с избыточной массой тела, сочетающейся с инсулинорезистентностью и артериальной гипертонией // РМЖ. 2011. Т. 19, № 2. С.1–7. 27. Мартынов А.И., Остроумова О.Д., Корсакова Н.К. и др. Влияние препарата моксонидин (физиотенз) на состояние сердечно-сосудистой системы и головного мозга у пожилых больных с артериальной гипертонией // Российский кардиологический журнал. 2002. № 4. 28. Hausberg M., Tokmak F., Pavenstadt H. Et al. Effects of moxonidine on sympathetic nerve activity in patients with end-stage renal disease // J. Hypertens. 2010. Jul 14. 29. Krespi P.G., Makris T.K., Hatzizacharias A.N. et al. Moxonidine effect on microalbuminuria, thrombomodulin, and plasminogen activator inhibitor-1 levels in patients with essential hypertension // Cardiovasc. Drugs Ther. 1998.Vol.12(5). P. 463–467. 30. Алексанян Л.А., Полосьянц О.Б. Моксонидин в современном лечении кардиоваскулярных заболеваний // РМЖ. 2010. № 18. 31. Sharma A.M., Wagner T., Marsalek P. Моксонидин в лечении больных с избыточной массой тела и ожирением, страдающих метаболическим синдромом: результаты постмаркетингового обзорного исследования (CAMUS) // Обзоры клинической кардиологии. 2007. № 10.
Передозировка лекарства
При несоблюдении врачебных рекомендаций и превышении максимального объема лекарственного средства, может развиться передозировка. Состояние определяется выраженными симптомами:
- Интенсивная головная боль и головокружение.
- Тошнота с последующей рвотой.
- Болезненные ощущения в области желудка.
- Слабость и сильное недомогание.
- Обширное снижение давления.
- Сухость в ротовой полости.
При возникновении выше перечисленных признаков, стоит обязательно обратиться к врачу. Лечение предполагает купирование симптомов. Назначают прием лекарств, промывание полости желудка, парентеральное введение физиологического раствора. Для подавления симптомов брадикардии показано использование Атропина.
Особые указания
Использование гипотензивного препарата в терапевтических целях требует постоянного контроля давления, работы сердца и частоты сердечных сокращений.
Во время курса лечения стоит полностью исключить алкогольные напитки. Рекомендуется не водить транспортные средства и не заниматься деятельностью, которая требует концентрации внимания, памяти и высокой мыслительной активности.
Прекращать прием препарата нужно постепенно, понемногу понижая дозу до полной отмены.
Если применение Моксонидина было совмещено с бета-адреноблокаторами и необходимо отменить оба препарата, вначале убирают последние. Через некоторое время отменяют гипотензивное средство.
Моксонидин, снижая симпатикотонию, не приводит к лучшему контролю уровня артериального давления
Изучение эффектов центральных регуляторов симпатической нервной системы, блокаторов ренин-ангиотензин-альдостероновой системы и диуретиков на функцию эндотелия и уровень артериального давления при метаболическом синдроме.
Проведено рандомизированное, двойное-слепое, перекрестное исследование у 31 пациента с ожирением и нелеченной артериальной гипертензией. Целью послужило определение влияния на эндотелиальную функцию и уровень артериального давления у тучных различных классов препаратов: центральных ингибиторов симпатической нервной системы (моксонидин 0,4мг), блокаторов ренин-ангиотензин-альдостероновой системы (алискирен 300мг), диуретиков (гидрохлортиазид 25мг) и плацебо. Контроль осуществлялся с помощью измерения поток-опосредованной эндотелий-зависимой вазодилатации* и суточного мониторирования уровня артериального давления (АД).
При приеме плацебо поток-опосредованная эндотелий-зависимая вазодилатация составила 4,0% и существенно увеличилась при приеме алискирена на 0,81% (95% ДИ 0,02%-1,79%), чего не произошло при приеме моксонидина 0,20%(95% ДИ -0,46%-1,03%) и гидрохлортиазида 0,39% (95% ДИ -0,31%-1,26%). Подобным образом, результаты 24-часового мониторирования уровня АД показали лучшее снижение на фоне приема алискирена (-9,8/-6,3 мм рт. ст.) по сравнению с плацебо и меньший эффект при приеме гидрохлортиазида (-5,9/-2,6 мм рт.ст.). Важно, что моксонидин, несмотря на свое центральное действие по ингибированию прессорного действия симпатической нервной системы, не показал статистически-достоверного влияния на уровень АД. Инсулинорезистентность ухудшалась на фоне приема гидрохлортиазида. Таким образом, ингибиторы ренина улучшают эндотелиальную функцию и приводят к лучшему контролю за уровнем артериального давления. Авторы выдвигают гипотезу о том, что ингибиторы ренин-ангиотензин-альдостероновой системы в противовес моксонидину, являются эффективной первой ступенью в лечении артериальной гипертензии у лиц с метаболическим синдромом.
Источник: Dorresteijn JA et al. Differential effects of renin-angiotensin-aldosterone system inhibition, sympathoinhibition and diuretic therapy on endothelial function and blood pressure in obesity-related hypertension: a double-blind, placebo-controlled cross-over trial. J Hypertens. 2012 Dec 11.
Комментарий
Ввиду последних данных о досрочном прекращении исследования ALTITUDE по причине увеличения частоты развития побочных эффектов в группе алискирена по сравнению с группой плацебо в отсутствие клинических преимуществ среди пациентов с СД 2типа, говорить об алискирене как о препарате 1 ряда в лечении артериальной гипертензии у лиц с метаболическим синдромом мы не можем. Однако, результаты в отношении неэффективности моксонидина в небольшой когорте пациентов по сравнению с гидрохлортиазидом и алискиреном, полученные авторами обсуждаемого исследования, «наводят тень» на препарат и делают вопрос его применения сомнительным. Разумеется, для создания рекомендаций по тактике лечения больных, необходимо проведение крупных хорошо организованных рандомизированных клинических исследований.
Подробные результаты рандомизированного клинического исследования ALTITUDE приведены на нашем сайте в разделе «Совет эксперта» (Aliskiren Trial in Type 2 Diabetes Using Cardiorenal Endpoints).
* Суть пробы D.S. Celermajer (поток-опосредованная эндотелий-зависимая вазодилатация) состоит в измерении диаметра плечевой артерии ультразвуковым методом. Сначала в состоянии покоя определяется исходный диаметр плечевой артерии. Затем на плечо накладывается манжета сфигмоманометра и накачивается до уровня, на 50 мм рт.ст. превышающего систолическое артериальное давление. Следующие измерения диаметра плечевой артерии определяется на 30, 60, 90 секундах после удаления воздуха из манжеты. Изменение диаметра сосуда на 60 секунде оценивается в процентном отношении к исходной величине. В норме диаметр плечевой артерии увеличивается более чем на 10% от исходного уровня.
Связанные материалы:
- Опубликованы результаты рандомизированного, двойного слепого, перекрестного исследования у 31 пациента с ожирением и нелеченной артериальной гипертензией
- Роль антиадренергических средств в лечении артериальной гипертонии и хронической сердечной недостаточности