Общие сведения
Под гипокалиемией подразумевается снижение в сыворотке содержания калия до показателя ниже 3,5 ммоль/л, дефицит которого может быть обусловлен как уменьшением его запасов в организме, так и патологическим перемещением в клетки. Большая часть калия (120–160 ммоль/л) в норме находится во внутриклеточном пространстве (около 90%), а оставшаяся часть содержится в крови/костной ткани. Нормой содержания калия в организме является его концентрация в сыворотке от 3,5 до 5,5 ммоль/л. Концентрация калия в крови относительно постоянная, что регулируется процессами поступления его в клетки/выведения почками. Процесс перемещения калия из крови через клеточные мембраны определяется концентрацией калия вне клетки, состоянием мембран и клеточным метаболизмом. Связывание калия внутри клетки происходит при образовании белка и гликогена: установлено, что на 1 г гликогена поступает в клетки 1 г азота белка и 0,3 ммоль ионов калия.
Калий поступает в организм с пищей в среднем в количестве 2-3 г/сутки и абсорбируется в ЖКТ (тонком кишечнике); выводится с мочой (2-5 г), в меньшей степени с калом (менее 10 ммоль). Объем/скорость выделения калия определяется множеством факторов: концентрацией калия в крови, осмолярностью, состоянием кислотно-основного равновесия, влиянием гормонов вазопрессина/альдостерона, скоростью обновления клеток.
Суточная потребность в калии организма взрослого человека варьирует в пределах 40–100 ммоль/л. Повышает эффективность усвоения калия витамин В6, в то время как алкоголь негативно влияет на его баланс в организме. Следует учитывать, что калий из пищи плохо усваивается при дефиците магния. Поэтому часто недостаток калия и магния в организме взаимосвязаны. В норме баланс калия постоянно поддерживается процессом его выделения и поступления с пищей. При этом, содержание в организме калия обратно пропорционально содержанию натрия, то есть, чем больше калия, тем меньше натрия, и наоборот.
Калий принимает активное участие в передаче нервных импульсов, формировании клеточных потенциалов, сокращении гладких/скелетных мышечных волокон, кардиомиоцитов. Макроэлемент повышает стрессоустойчивость/физическую выносливость, координирует сердечный ритм, ответственен за нормализацию АД, способствует выведению из организма аллергенов/токсинов. Нехватка калия в организме у женщин и недостаток калия у мужчин являются опасным состоянием, поскольку его функции в организме чрезвычайно широкие: калий поддерживает биоэлектрическую активность клеток, кислотно-щелочное равновесие/водно-солевой баланс; способствует стабилизации сердечного ритма, уровня кровяного давления, поддержанию уровня рН.
Достоверных статистических данных распространенности гипокалиемии в общей популяции людей нет. Важно понимать, что и манифестная и особенно субклиническая гипокалиемия очень распространены в клинической практике, но зачастую остаются нераспознанными. Однако, дефицит калия выявляется у 3-20% пациентов гастроэнтерологического/кардиологического отделений. Причиной затруднений распознавания гипокалиемии служит вариабельность/динамичность и многообразие ее клинических проявлений, в связи с чем гипокалиемия имитирует различную органную/системную патологию.
Симптомы острого состояния
Хроническая легкая гипокалиемия протекает бессимптомно. При снижении уровня калия до 2,5 ммоль/л появляется выраженная мышечная слабость. При остром состоянии возникают такие клинические проявления:
- ослабление или затруднение дыхания;
- длительная боль в сердце, ощущение давления, сжимания, не облегчается при приеме Нитроглицерина;
- тахикардия при нагрузке и в покое;
- артериальная гипотония, обморочное состояние при переходе из горизонтального в вертикальное положение;
- головокружение, апатия, трудность концентрации внимания;
- потеря аппетита, тошнота, вздутие живота, запор;
- усталость, выраженная слабость мышц, покалывание и онемение конечностей, мышечные спазмы, внезапное нарушение двигательной активности – вялый паралич;
- дрожание рук, потливость.
Артериальная гипотензия — симптом острой гипокалиемии
Если на этой стадии не восстановлен баланс электролитов, то нарушается сократимость миокарда, величина выброса крови из желудочков. Нарушения ритма становятся угрожающими для жизни (фибрилляция желудочков, прекращение сокращений), а сердечная недостаточность нарастает.
Снижается двигательная активность желудка и кишечника, что по мере прогрессирования патологии приводит к паралитической непроходимости.
Патогенез
Патогенез гипокалиемии многообразен и определяется ее формой. Основную роль в поддержании калиевого гомеостаза играют почки. Уровень калийурии определяется совокупностью нескольких процессов, а именно: фильтрацией калия, секрецией и его реабсорбции. Поскольку калий в плазме крови находится в свободном состоянии, он в почечных клубочках полностью фильтруется, ионы калия прошедшие через фильтр почти в полном объеме реабсорбируются в дистальных/проксимальных канальцах.
Процесс выделение почками калия находится под гуморальным контролем, основная роль в котором принадлежит минералокортикоидам (альдостерону), который как увеличивает проникновения ионов калия в клетки дистального канальца, так и повышает проницаемость клеточной мембраны для калия, способствуя секреции калия. Кроме альдостерона, в процессах регуляции выделения калия почками принимает участие и инсулин, который уменьшает выделение калия почками. Существенное влияние на калийурию оказывает состояние кислотно-щелочного равновесия. Так, при алкалозе в результате перехода калия, находящегося в плазме крови в клетки, развивается гипокалиемия. Калиевый дефицит отмечается при усиленном/ускоренном распаде белков в организме, что способствует форсированию выделение калия.
Как восполнить недостаток калия?
Как правило, назначается хлорид калия. Реже — бикарбонат калия или цитрат калия. Преимущественно препараты назначают в таблетированной или капсульной форме, но при очень тяжелых формах заболевания используют инъекции и капельницы. В случае неправильного перераспределения калия в организме вводить препарат внутривенно нельзя.
Для пополнения запаса калия в крови применяются калиесодержащие препараты. Как правило, назначается хлорид калия. Реже — бикарбонат калия или цитрат калия. Преимущественно препараты назначают в таблетированной или капсульной форме, но при очень тяжелых формах заболевания используют инъекции и капельницы. В случае неправильного перераспределения калия в организме вводить препарат внутривенно нельзя.
Важно. Очень важным фактором как для лечения дефицита калия, так и для его профилактики является правильный рацион.
Давайте разберемся, как восполнить недостаток калия в организме человека. Старайтесь употреблять как можно больше растительной пищи, откажитесь от высококалорийных продуктов, фаст-фуда, полуфабрикатов, приучите себя к вкусным и полезным овощным супам и отварам. Вместо обжаривания запекайте овощи и мясные продукты.Суточная потребность в калии составляет от 3 до 5 грамм. Для людей с большими физическими нагрузками, детей и подростков, а также для больных, постоянно принимающих мочегонные препараты норма немного выше.
Причины
Причины гипокалиемии достаточно разнообразные к основным из которых можно отнести:
- Недостаточное поступление калия с пищей (нерациональное питание/строгие диеты) однообразное питание.
- Избыточное потребление сахара, кофесодержащих напитков, алкоголя.
- Избыточное поступление натрия, цезия, таллия и рубидия в организм.
- Потери калия при различных заболевания органов ЖКТ (язвенный колит/панкреатит), различных кишечных инфекциях, которые манифестируют многократной диареей/рвотой.
- Первичный/вторичный гиперальдостеронизм. Под влиянием альдостерона стимулируется процесс выделения калиевых ионов почками.
- Эндокринные заболевания (тиреотоксикоз, болезнь/синдром/Иценко-Кушинга, генетически обусловленная дисфункция коры надпочечников).
- Болезни почек (нефрит интерстициальный/почечный канальцевый ацидоз), протекающие с канальцевой дисфункцией, что приводит к усиленной калиевой экскреции.
- Перераспределение (изменения соотношения) калия между интерстицием и клеткой — переход из внеклеточного пространства К+ внутрь клеток. Встречается при алкалозе (смещении pH в щелочную сторону).
- Нервно-психические перегрузки, чрезмерные стрессорные факторы.
- Применение в высоких дозах глюкокортикоидов.
- Прием некоторых медикаментов. Ниже в таблице приведены основные лекарственные препараты, являющиеся индукторами гипокалиемии и механизмы ее развития.
- Другие причины — ожоги большой площади, гипомагниемия, синдром Бартера-Гиттельмана.
Гипокалиемия: лечение
Главная цель терапии – прекратить потери организмом калия. Для этого необходимо устранить причину гипокалиемии. Одновременно проводят коррекцию дефицита.
Лечение гипокалиемии препаратами калия является обязательным. При легких патологических процессах обычно назначают лекарства в форме таблеток, например, Аспаркам или Панангин. В тяжелых случаях требуется внутривенное введение растворов, содержащих хлорид калия или бикарбонат калия. Однако внутривенные инфузии противопоказаны пациентам, у которых проблема обусловлена нарушением перераспределения калия (за исключением семейного гипокалиемического периодического паралича), поскольку высок риск развития рикошетной гиперкалиемии.
В некоторых случаях для устранения аритмии требуется применение антиаритмических препаратов – пропафенона или амиодарона. При фибрилляции желудочков необходима дефибрилляция.
Симптомы
Симптомы гипокалиемии зависят от уровня содержания калия в организме, однако, следует учитывать, что показатели концентрации калия в плазме отражают состояние калиевого баланса неточно. Симптомы и жалобы пациентов, сопровождающие снижение в организме концентрации калия, неспецифичны и достаточно разнообразны, поэтому в большинстве случаев речь идет не о клинической картине, а о различных клинических масках гипокалиемии.
Основные признаки дефицита калия наблюдаются при снижении его общего количества в диапазоне 10-30%, снижение содержания калия ниже 1,5 ммоль/л вызывает паралич дыхательных мышц. Симптомы недостатка калия в организме у женщин и нехватка калия в организме у мужчин манифестируют одной и той же симптоматикой.
Первые признаки нехватки калия связаны с нарушением нервно-мышечной возбудимости, что обусловлено нарушением поляризации/деполяризации клеточных мембран и проявляется астенией/мышечной слабостью, повышенной усталостью, парестезиями/спазмами мышц, снижением сухожильных рефлексов. При хронической гипокалиемии появляются функциональные расстройства и структурные повреждения как периферической, так и центральной нервной системы, что реализуется расстройствами психоэмоциональной сферы в виде ипохондрического, астенического или тревожно-депрессивного синдромов.
Сенсорные нарушения манифестируют легкими парестезиями конечностей/лица или утратой тактильной/болевой чувствительности или выраженной гиперестезией. Двигательные нарушения коррелируют с выраженностью/длительностью гипокалиемии, варьируя от легкой слабости мышц верхних и нижних конечностей, снижения сухожильных рефлексов до паралича, в том числе дыхательных мышц. Проявлением гипокалиемии могут быть и симптомы/изменения со стороны органов пищеварения (парез кишечника, метеоризм, рвота, кишечная непроходимость паралитическая, запоры), а также мочеполовой системы (полиурия, атония мочевого пузыря, некроз в почках).
Одним из наиболее частых проявлений гипокалиемии являются расстройства сердечно-сосудистой деятельности, для которых характерно расширение полостей сердца, снижение сократительной функции миокарда, наличие систолического шума на верхушке сердца, снижение артериального давления.
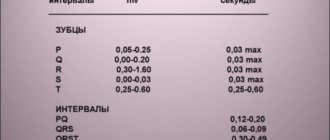
Повреждающее действие недостаточности ионов калия в организме хорошо отражается на ЭКГ, что позволяет ее использовать в качестве своеобразного индикатора скрытой гипокалиемии. К характерным ЭКГ-признакам гипокалиемии относятся желудочковые экстрасистолы, депрессия/инверсия зубца Т, пролонгация QRS, выраженный зубец U, снижение сегмента ST (рис. ниже).
Как правило, при дефиците калия отмечается снижение психической/умственной деятельности, проявляющееся в заторможенности, апатии, а при значительном дефиците, возможно развитие коматозного состояния.
Симптомы гипокалиемии
У некоторых пациентов гипокалиемия может протекать без каких-либо симптомов. Клиническая картина, ее выраженность определяются в большей мере не концентрацией К+, а скоростью ее снижения. Мышечная слабость является одним из первых симптомов. Иногда возникают мышечные подергивания (фасцикуляции), тетанические судороги (спазмы). Угнетение возбудимости нейронов ЦНС приводит к развитию симптомов психастении (сонливости, апатии, ухудшения концентрации внимания).
Из-за замедленной моторики ЖКТ во время приема пищи очень быстро наступает чувство насыщения, беспокоит тяжесть в эпигастрии. Характерны запоры. Особенно чувствительна к снижению К+ проводящая система сердца — появляется тахикардия, перебои в работе сердца. Вследствие гипотонии начинается головокружение. При первичном гиперальдостеронизме, напротив, всегда наблюдаются симптомы артериальной гипертензии (тяжесть и боли в затылке, шум в ушах). Также больных беспокоит увеличение диуреза и постоянное чувство жажды.
Анализы и диагностика
В основе диагносте лежат лабораторно-инструментальные методы обследования пациента:
- Лабораторные исследования. Проводится определение КОС крови и концентрации калия, магния, натрия. В биохимическом анализе крови определяется концентрация мочевины, креатинина; в анализе мочи — наличие хлора/относительная плотность.
- Анализы на гормоны. Определяется уровень альдостерона/ренин, вычисляется ренин-альдостероновое соотношение. По показаниям проводятся анализы на 17-ОН-прогестерон, кортизол, тиреотропный гормон.
- Электрокардиография. На ЭКГ ищут характерные признаки ЭКГ гипокалиемии (удлинение интервала QT, депрессия сегмента ST, наличие зубца U).
- Инструментальные исследования. УЗИ/КТ надпочечников, УЗИ почек с допплерографией. По показаниям — эхокардиография.
- Кроме определения содержания калия важна и диагностика причин гипокалиемии, алгоритм которой приведен на рисунке ниже.
Введение
В статье будут рассматриваться как известные, так и новые клинические аспекты дефицита магния в организме человека. Выделяют два типа дефицита магния: острая гипомагниемия и хронический дефицит магния [1]. Острая гипомагниемия представляет собой внеклеточное снижение уровня магния в организме с развитием тяжелых судорог, нистагма, устойчивой к лечению гипокалиемии и гипокальциемии или эклампсии, а также аритмий. В таких случаях обычно отмечается быстрая ответная реакция на внутривенное введение магния. Хронический дефицит магния отражает снижение уровня магния в клетках и костях, причем часто сопровождается нормальной концентрацией магния в крови, что нередко становится причиной ложного суждения об отсутствии дефицита магния [1]. В то же время имеются данные о том, что распространенность патологических изменений концентрации магния в крови даже при обычной оценке может достигать 12,5—20% [2].
В данном обзоре будут рассмотрены современные представления именно о хроническом дефиците магния и так называемом субклиническом дефиците магния, т. е. таком дефиците, который приводит к бессимптомному снижению физиологических или биохимических показателей, а также ухудшению функции клеток.
Прежде чем приступить к обсуждению таких аспектов, целесообразно вкратце остановиться на причинах развития дефицита магния, а также механизмах развития дефицита магния и/или гипомагниемии.
Причины и механизмы развития дефицита магния
Рекомендуемое суточное потребление магния для женщин и мужчин составляет 320 и 420 мг соответственно [3]. Нормальной считается концентрация магния в крови в диапазоне 0,75—0,95 ммоль/л [4]. Концентрация магния в крови менее 0,82 ммоль/л при экскреции магния с мочой в диапазоне 40—80 мг/сут позволяет предположить о высокой вероятности дефицита магния [4]. Концентрация магния в крови более 0,95 ммоль/л может указывать на гипермагнемию.
Причем следует отметить, что дефицит магния может иметь место несмотря на нормальную его концентрацию в крови, так как имеется лишь умеренная связь между вне- и внутриклеточным содержанием магния [5]. Для установления дефицита магния при нормальной его концентрации в крови считается полезным выполнение внутривенного теста на толерантность к магнию. Такой тест включает внутривенное введение 360—480 мг магния в течение 1 ч с последующим сбором мочи для оценки экскреции магния в течение 16 ч. Выполнение такого теста считается в наибольшей степени обоснованным в отсутствие повышенных потерь магния и/или нарушения функции почек. Результаты теста свидетельствуют о дефиците магния в организме, если с мочой в течение 16 ч выделяется менее 70% введенного магния.
Магний абсорбируется в основном за счет парацеллюлярного пассивного поступления в тонком и толстом кишечнике, который обусловлен различиями в концентрации, и в меньшей степени за счет активного трансцеллюлярного транспорта в толстом кишечнике через рецепторы временного потенциала меластатина 6- и 7-го типов [3]. При низком потреблении магния его абсорбция в кишечнике увеличивается с 40 до 80%, в то время как фракционная экскреция магния с мочой снижается до 0,5%. Регуляция гомеостаза магния может нарушаться при заболеваниях или применении лекарственных препаратов, которые влияют на абсорбцию магния в кишечнике и/или почках. Причем некоторые препараты, например, ингибиторы рецепторов эпидермального фактора роста цетуксибам и цисплатин снижают регуляцию экспрессии генов, регулирующих формирование ионных каналов TRPM6 (меластатиновый рецептор временного потенциала 6-го типа), которые участвуют в транспорте магния. Часто применяемые ингибиторы протонного насоса нередко становятся причиной дефицита магния [6]. Увеличению распространенности гипомагниемии в популяции и особенно у лиц с сопутствующими заболеваниями могут способствовать широкое потребление рафинированных продуктов, а также сниженное потребление зеленых листовых овощей и продуктов из цельного зерна [7, 8].
В последние годы были описаны различные варианты врожденных факторов, обусловливающих развитие дефицита магния. Такие варианты представляют собой моногенные и в большинстве случаев редкие генетические нарушения, обусловленные дисфункциональными мутациями генов, ответственных за синтез белков-транспортеров, участвующих в транспорте магния [3, 9].
Частой причиной гипомагниемии (однако в большинстве случаев слабовыраженной) становится сахарный диабет, при котором установлена связь между выраженностью дефицита магния и уровнем глюкозы в крови [10]. Увеличение концентрации магния в крови было отмечено после начала применения большинства гипогликемических препаратов. Установлено, что за счет действия инсулина снижается экспрессия TRPM6 в дистальных извитых канальцах почек, чем можно объяснить потери магния через почки при сахарном диабете 2-го типа [11]. Улучшение чувствительности к инсулину за счет существенного снижения массы тела после бариатрических операций не только приводит к снижению уровня глюкозы в крови, но и увеличению концентрации магния в крови [12].
Следует отметить двунаправленную связь между уровнем магния и глюкозы в крови. Установлено, что как гипомагниемия, так и полиморфизм одного нуклеотида в генах, включенных в обмен магния и влияющих на его концентрацию, были прогностическими факторами развития сахарного диабета или преддиабета в общей популяции [11]. Сходная двунаправленная связь была отмечена между концентрацией магния в крови и выраженностью свободнорадикального окисления [13]. Следует отметить, что применение программ интенсивных тренировок и занятия спортом, которые, с одной стороны, могут улучшить чувствительность к инсулину, может быть неэффективно для коррекции гипомагниемии у больных с сахарным диабетом за счет усиления потерей магния из-за повышенного потоотделения и повышенной экскреции магния с мочой [14].
Дефицит магния может вызвать усиление воспаления. Механизмы такого усиления включают активацию фагоцитов, открытие кальциевых каналов, активацию рецепторов N-метил-D-аспартата, активацию ядерного фактора κB. Кроме того, дефицит магния может приводить к развитию системного стресса за счет нейроэндокринных механизмов [15]. Воспалительные реакции, вызванные дефицитом магния, могут приводить к проатерогенным изменениям в метаболизме липопротеинов, а также к ухудшению функции эндотелия и повышению А.Д. Имеются данные о вовлечении дефицита магния в патофизиологические звенья развития таких заболеваний, связанных с воспалением, как сахарный диабет, бронхиальная астма, преэклампсия, атеросклероз, а также повреждение миокарда.
Причины гипомагниемии, которые обусловлены заболеваниями желудочно-кишечного тракта, включают недостаточно эффективно компенсированное потребление магния или кишечную мальабсорбцию магния. Разграничение между причинами развития гипомагниемии, обусловленными заболеванием желудочно-кишечного тракта, и потерей магния через почки у лиц с нормальной функцией почек предпочтительно проводить с помощью измерения фракционной экскреции магния почками с помощью анализа только утренней порции мочи (соответственно более или менее 2%), а не анализа мочи, собранной в течение 24 ч (в таком случае на чрезмерную потерю магния будет указывать экскреция более 24 мг, или 1 ммоль в сутки) [16].
Данные о связи между дефицитом магния и риском развития определенных заболеваний
Магий оказывает различные эффекты на проводящую систему. Он представляет собой важный ко-фактор Na-K-AТФ насоса, который регулирует движение ионов натрия и калия через мембраны [17], что и обусловливает влияние концентрации ионов магния на возбудимость миоцитов. При умеренном дефиците магния описаны увеличение продолжительности комплекса QRS и увеличение амплитуды зубца Т, а при тяжелом дефиците — удлинение интервала P—R, прогрессирующее увеличение продолжительности комплекса QRS и уменьшение амплитуды зубца Т [18].
Несмотря на возможность оценки уровня магния в крови, его измерение не включено в стандартный перечень исследуемых электролитов в крови, что затрудняет установление диагноза дефицита магния. Потери магния, обусловленные широко применяемыми петлевыми диуретиками (кстати, не всегда обоснованными, в частности использование торасемида у больных с артериальной гипертонией), способствуют увеличению числа пациентов с дефицитом магния и гипомагниемией. Угрожающие жизни аритмии и судороги относят к наиболее опасным клиническим проявлениями гипомагниемии и дефицита магния [19]. В случае отсутствия ответной реакции на лечение рецидивирующей желудочковой тахикардии и/или фибрилляции желудочков у пациентов с острым инфарктом миокарда, идиопатической дилатационной кардиомиопатией или застойной сердечной недостаточностью следует учитывать возможность внутривенного введения магния [20].
Результаты обсервационных эпидемиологических исследований свидетельствуют об обратной связи между содержанием Mg2+ в питьевой воде и смертностью от болезней сердца и частотой развития осложнений заболеваний сердца и инсульта [21—23].
В ходе выполнения анализа данных о 14 290 участниках одного из крупных обсервационных исследований ARIC — Atherosclerosis Risk in Communities (средний возраст 54 года, медиана продолжительности наблюдения 20,6 года) была установлена статистически значимая связь между более низкой концентрацией магния в крови и развитием фибрилляции предсердий [24]. Так, по сравнению с участниками, у которых уровень магния в крови соответствовал 3-му квинтелю (0,80—0,83 ммоль/л), у лиц с уровнем магния, соответствовавшим нижнему квартилю (менее 0,78 ммоль/л), по данным многофакторного анализа отмечалось увеличение риска развития фибрилляции предсердий на 34% (отношение риска 1,34 при 95% ДИ 1,16—1,54). Причем не было отмечено связи между количеством потребляемого с пищей магния и риском развития фибрилляции предсердий. Сходные данные были получены и в ходе выполнения Фремингемского исследования [25]. Результаты этого исследования свидетельствовали о том, что у лиц без сердечно-сосудистых заболеваний (ССЗ) и уровнем магния в крови, который соответствовал нижнему квартилю, по сравнению с лицами, у которых такой уровень соответствовал верхнему квартилю, на 50% увеличивалась вероятность развития фибрилляции предсердий.
Установлено, что низкая концентрация магния в крови сопровождается увеличением риска развития аритмий у больных с острым инфарктом миокарда (ОИМ) [26], но восполнение дефицита магния в такой ситуации обусловливает снижение частоты развития аритмий [27]. Роль введения магния изучалась в ходе выполнения 3 крупных проспективных исследований: исследовании LIMIT-2 (Leicester Intravenous Mg Intervention Trial) [28], ISIS-4 (Fourth International Study of Infarct Survival Trial) [29] и MAGIC Magnesium in Coronaries [30]. В целом результаты исследований не подтвердили гипотезу о том, что внутривенное введение магния приводит к снижению смертности больных с ОИМ. Однако следует учитывать определенные методологические недостатки указанных исследований, в частности, введение сульфата магния в исследовании ISIS-4, самом крупном из указанных РКИ, в относительно отсроченный период после развития клинических проявлений ОИМ. Таким образом, введение сульфата магния не стало стандартным подходом к лечению больных с ОИМ, но его использование можно учитывать у пациентов с ОИМ в определенных клинических ситуациях.
О роли дефицита магния в развитии аритмий, а также о положительном влиянии восполнения такого дефицита с помощью пищевой добавки, содержащей магний, свидетельствуют результаты дойного слепого плацебо-контролируемого исследования [31]. В это исследование были включены 22 женщины, находившиеся в периоде постменопаузы. В группе низкого потребления магния (прием плацебо к пищевой добавке магния) по сравнению с группой потребления 320 мг магния в сутки отмечалась более высокая частота развития аритмий по данным мониторирования электрокардиограммы в течение около 21 ч: от общего числа сердечных сокращений число суправентрикулярных аритмий составляло в среднем 0,074 и 0,042% соответственно; число желудочковых экстрасистол в среднем 0,125 и 0,073%, а в целом любых экстрасистол 0,274 и 0,160% соответственно; причем для суправентрикулярных экстрасистол и экстрасистол в целом различие между низким и высоким потреблением магния достигало уровня статистической значимости p
<0,020 и
p
<0,015 соответственно. Таким образом, восполнение субклинического дефицита магния приводило к уменьшению числа экстрасистол почти в 2 раза. Авторы данного исследования считают, что у лиц, проживающих в регионах с мягкой водой или применяющих диуретики, а также предрасположенных к развитию экстрасистол, может быть больше оснований для увеличения потребления магния [31].
В ходе выполнения другого исследования [32], также включавшего 14 женщин, находящихся в периоде постменопаузы в возрасте от 47 до 75 лет, проверяли гипотезу о том, что ограничение потребления магния примерно до 33% от количества магния от рекомендуемого экспертами приведет к изменению концентрации глюкозы, холестерина и электролитов в крови, которые могут приводить к патологическим последствиям. В ходе выполнения исследования, продолжительность которого достигала 136 дней, участники придерживались обычной западной диеты, включавшей потребление 101 мг магния на каждые 2000 ккал в течение первых 78 дней, а затем потребление магния с пищей на 58 дней было увеличено до 200 мг в сутки (в виде глюконата магния). В период потребления ограниченного количества магния аритмии развились у 5 женщин, что стало причиной досрочного увеличения потребления магния (в период между 42 и 64 днями начального 78-дневного периода). Причем у 3 женщин отмечалось развитие фибрилляции или трепетания предсердий, которые быстро купировались после увеличения количества потребляемого магния. Кроме того, ограничение потребления магния сопровождалось увеличением концентрации глюкозы в крови.
Результаты исследования, включавшего 430 пациентов с различными заболеваниями [33], свидетельствовали о том, что у больных с сахарным диабетом и аритмиями была менее высокая концентрация ионизированного магния в крови. Кроме того, применение диуретиков и дигоксина также вызывает снижение уровня магния в организме, что обусловливает предрасположенность к развитию аритмий [34].
Гипомагниемия может приводить к развитию двунаправленной веретенообразной желудочковой тахикардии (типа «torsades de pointes») [35].
Имеются данные об эффективности введения магния при устойчивой к лечению желудочковой тахикардии, мультифокальной предсердной тахикардии, фибрилляции предсердий и суправентрикулярной тахикардии [36].
Результаты метаанализа 19 РКИ по оценке эффективности применения оротата магния, в которые в целом были включены 1190 участников, свидетельствовали о статистически значимом снижении частоты развития пролапса митрального клапана 1-й степени, митральной регургитации 1-й степени, числа суправентрикулярных и желудочковых экстрасистол, а также частоты развития пароксизмальной суправентрикулярной тахикардии [37]. Следует отметить, что большинство из исследований, включенных в метаанализ, были опубликованы на русском языке.
Возможные механизмы отрицательного влияния дефицита магния на сердечно-сосудистую систему представлены в таблице.
Отрицательное влияние дефицита магния на сердечно-сосудистую систему и его механизмы Примечание. ДВЖТ — двунаправленная веретенообразная желудочковая тахикардия; ХС — холестерин.
Дефицит магния приводит к уменьшению активности Na-K-АТФазы, что обусловливает повышение концентрации натрия и кальция в клетках, а также снижение уровня магния и калия в сердце [19]. Вследствие таких изменений повышается склонность коронарных артерий к спазму, что может способствовать развитию инфаркта миокарда и аритмий [38]. Учитывая, что примерно 25% всех инфарктов миокарда развивается в отсутствие разрыва атеросклеротической бляшки, спазм коронарных артерий, вызванный дефицитом магния, может, по крайней мере отчасти, объяснить причину развития некоторых из таких случаев.
Следует также отметить, что гипомагниемия может увеличить предрасположенность к развитию ССЗ за счет влияния на функцию эндотелия и изменения функции микрососудов [39].
Известно о связи между злоупотреблением алкоголем и риском развития гипомагниемии. Считается, что у 30% лиц, страдающих алкоголизмом, может выявляться гипомагниемия [40]. Считается, что механизм развития гипомагнемии в таких случаях обусловлен вызванной алкоголем кальциевой дисфункцией, что приводит к чрезмерной экскреции магния с мочой [21, 41]. Увеличение продолжительности интервала QT, обусловленное гипомагниемией, приводит к увеличению риска развития двунаправленной веретенообразной желудочковой тахикардии (типа «torsades de pointes»). Несмотря на частое спонтанное прекращение желудочковой тахикардии такого типа, нередко отмечается ее рецидивирование, причем в таких случаях может быть развитие фибрилляции желудочков и/или внезапная смерть от осложнений заболевания сердца [42, 43].
Описано развитие тяжелой гипомагниемии у пациента, злоупотребляющего алкоголем, которая сопровождалась эпизодами потери сознания, обусловленными полиморфной двунаправленной веретенообразной желудочковой тахикардией [44]. В ходе наблюдения были выявлены снижение концентрации магния в крови до 0,6 мг/дл и увеличение продолжительности корригированного интервала QTc до 688 мс. После введения электролитов продолжительность интервала QTc уменьшилась до 532 мс.
Согласно результатам исследований, применение диеты (например, диеты DASH — Dietary Approaches to Stop Hypertension), включающей большое количество фруктов и овощей, а также молочных продуктов с низким содержанием жира и продуктов с высоким содержанием калия, магния и кальция, и потребление небольшого общего количества насыщенных жиров приводит к более выраженному снижению САД (систолическое АД) и ДАД (диастолическое АД) на 11,4 и 5,5 мм рт.ст. соответственно по сравнению с контрольной группой, в которой участники соблюдали стандартную диету [45].
Более того, результаты метаанализа 34 РКИ [46] по оценке эффектов применения пищевой добавки, содержащей магний, у лиц с нормальным и повышенным артериальным давлением (АД), в который были в целом включены данные о 2028 участниках, свидетельствуют о том, что применение пищевой добавки, содержащей магний, медиана дозы которого составляла 368 мг/сут в течение периода, медиана продолжительности — 3 мес, приводило к статистически значимому снижению САД в среднем на 2 мм рт.ст. (при 95% ДИ 0,43—3,58) и ДАД в среднем на 1,78 мм рт.ст. (при 95% ДИ 0,73—2,82); такое снижение АД сопровождалось увеличением концентрации магния в крови на 0,05 ммоль/л (при 95% ДИ 0,03—0,07). По мнению авторов метаанализа, полученные результаты позволяют предположить о том, что применение препаратов магния у взрослых лиц приводит к снижению А.Д. Однако очевидно, что для уточнения оптимальных режимов применения таких препаратов с целью снижения АД необходимы дополнительные исследования.
Образование камней в почках у населения всех стран мира становится важной проблемой здравоохранения. Причем недавно в ходе выполнения метаанализа 8 когортных исследований были получены данные, подтверждающие статистически значимую связь между мочекаменной болезнью и риском развития ишемической болезни сердца и инсульта [47]. В связи с этим целесообразно остановиться на результатах исследования, в котором была установлена связь между дефицитом магния и риском образования камней в почках.
В ходе выполнения обсервационного исследования, результаты которого недавно были опубликованы, впервые были получены данные о связи между гипомагниемией и риском образования конкрементов в почках [48]. В целом в исследование были включены 6228 участников 18 лет и старше. Учитывали конкременты, диаметр которых достигал 4 мм и более. Концентрацию магния в крови измеряли с помощью хемилюминесцентного метода. В целом распространенность конкрементов в почках достигала 6,1% (у 7,5% мужчин и 4,2% женщин).
По сравнению с участниками исследования, концентрация магния у которых соответствовала нижнему квартилю, у участников с уровнем магния в крови, соответствующим верхнему квартилю, отношение шансов наличия конкрементов в почках составляло 0,62 (при 95% ДИ 0,46—0,85; p
=0,038 для тенденции). Причем сходные результаты для мужчин и женщин. Таким образом, результаты исследования свидетельствовали о том, что у лиц с относительно невысокой концентрацией магния в крови, даже находящейся в нормальном диапазоне, отмечается зависимое от степени снижения уровня магния в крови увеличение распространенности выявления конкрементов в почках. Такие данные позволяют предположить роль ионов магния в профилактике или лечении мочекаменной болезни.
В целом роль магния в образовании конкрементов в почках изучена недостаточно [49]. Предполагается 2 механизма, за счет которых концентрация магния в крови может влиять на образование камней в почках. Во-первых, магний может влиять на образование конкрементов за счет уменьшения кристаллизации оксалата кальция. В ходе выполнения нескольких исследований были получены данные о том, что магний может уменьшать образование камней за счет прямого подавления образования центров кристаллизации и роста кристаллов оксалатов кальция или за счет соединения с оксалатами в моче с образованием более растворимого по сравнению с оксалатом кальция комплекса [50—52]; во-вторых, магний может уменьшать абсорбцию оксалатов в кишечнике [53]. Предполагается, что магний уменьшает абсорбцию в кишечнике мочевых оксалатов за счет связывания оксалата в кишечнике с образованием нерастворимого комплекса [54].
Связь полифармакотерапии с гипомагниемией у пожилых пациентов
Предполагается, что сопутствующая лекарственная терапия может быть одним из факторов риска снижения концентрации магния в крови. Особенно такая связь может становиться клинически значимой у пациентов пожилого возраста, учитывая, что у них выше вероятность применения полифармакотерапии. Так, результаты недавно выполненного в США и Нидерландах одномоментного обсервационного исследования [55] свидетельствовали об увеличении в целом распространенности полифармакотерапии в течение последних 15 лет с 3,1 до 8% (p
<0,001 для тенденции). Причем наиболее высокая распространенность полифармакотерапии отмечалась у лиц 65 лет и старше.
Результаты недавно выполненного в Нидерландах обсервационного исследования [56], включавшего 343 пациента пожилого возраста, свидетельствовали о высокой распространенности гипомагниемии, которая достигала 22,2 или 12.2% при использовании точки разделения для уровня магния в крови и указывала на гипомагниемию менее 0,75 или 0,70 ммоль/л соответственно. Причем 67,6% участников принимали 5 лекарственных препаратов и более, что указывало на полифармакотерапию. Была установлена статистически значимая (p
<0,01) обратная линейная связь между числом применяемых препаратов, относящихся к разным классам, и концентрацией магния в крови. Результаты регрессионного анализа Кокса с учетом многих потенциально вмешивающихся факторов указывали на статистически значимую связь между полифармакотерапией и гипомагниемией (для концентрации магния в крови менее 0,75 ммоль/л коэффициент распространенности — КР=1,81 при 95% ДИ 1,08—3,14), а также между гипомагниемией и приемом ингибиторов протонного насоса (КР=1,80 при 95% ДИ 1,20—2,72) и приемом метформина (КР=2,34 при 95% ДИ 1,56—3,50). Более того, по данным стратификационного анализа была отмечена связь между развитием гипомагниемии и применением препаратов кальция (КР=226 при 95% ДИ 1,20—4,26), инсулина (КР=3,88 при 95% ДИ 2,19—6,86), антагонистов витамина К (КР=2,01 при 95% ДИ 1,05—3,85), статинов (КР=2,44 при 95% ДИ 1,31—4,56) и бифосфонатов (КР=2,97 при 95% ДИ 1,65—5,36) у пациентов моложе 80 лет, а также селективных b-блокаторов (КР=2,01 при 95% ДИ 1,19—3,40) у лиц с индексом массы тела менее 27 кг/м2 и ингаляционных агонистов b-адренорецепторов у мужчин (КР=3,62 при 95% ДИ 1,73—7,56). На основании полученных данных авторы исследования сделали вывод о том, что, поскольку имеется связь как между развитием гипомагниемии и полифармакотерапии в целом, так и применением определенных лекарственных препаратов, необходимо обращать большее внимание на концентрацию магния в крови, особенно у пациентов с сахарным диабетом, ССЗ и побочными эффектами ингибиторов протонного насоса и препаратов кальция.
Обоснованность применения магния в виде оротата магния
Имеется лишь небольшое число исследований по оценке биодоступности разных солей магния [57]. Результаты экспериментального исследования на крысах свидетельствовали о несколько более высокой биодоступности органических солей магния [58]. В ходе выполнения нескольких клинических исследований также были получены данные, позволяющие предположить о более высокой биодоступности органических солей магния в стандартизованных условиях [59, 60].
По мнению О.А. Громовой и соавт. [61], препараты на основе солей магния с органическими кислотами, в которых анион кислоты служит переносчиком магния внутрь клеток, характеризуются высокой биоусвояемостью. Анион-переносчик характеризуется самостоятельными эффектами, влияющими на поддержание систем организма. Оротат-анион (анион оротовой кислоты) представляет собой именно такой анион, который оказывает также дополнительное фармакологическое действие. Следует напомнить, что оротовая кислота, или витамин В13, представляет собой предшественник пиримидиновых оснований, стимулирующий рост животных, растений и микроорганизмов. Соли оротовой кислоты повышают биодоступность ионов различных металлов, содержащихся в минеральных пищевых добавках и препаратах на основе минералов. Оротовая кислота содержится в молоке (коровьем, козьем), молочных продуктах, а также в моркови и свекле. Потребность взрослого человека в оротовой кислоте около 500—1500 мг в сутки. У кормящих матерей этот показатель достигает 3000 мг/сут, у интенсивно тренирующихся спортсменов — 3000—5000 мг/сут [62, 63].
Диета
Специальной диеты нет, однако коррекция рациона питания с включением продуктов богатых калием является важнейшей составляющей коррекции гипокалиемии. С этой целью рекомендуется включать в рацион питания молочные продукты (молоко, творог и сметана), бобовые культуры, овсяную/гречневую крупы, грибы, картофель, хлеб с отрубями, томат, морскую рыбу (ставрида, минтай, лосось, тунец, килька), капусту (цветную/белокочанную/брокколи), морковь, огурцы, зелень (петрушка, шпинат), морскую капусту, свежие фрукты (персики, бананы, киви, авокадо, абрикосы), орехи, сухофрукты (чернослив, курага, изюм), компоты, черный чай, какао, томатный сок, свежевыжатые соки (виноградный, апельсиновый, морковный), шоколад.
Ограничению/полному исключению из рациона питания подлежат ненатуральные сахарсодержащие напитки (лимонады, «кока-кола», «фанта», «пепси»). Ограничению подлежит и употребление соли, но при этом, бессолевая диета не допускается. Важно учитывать, что большая часть калия при тепловой обработке растворяется в воде, поэтому отваривать продукты нужно в минимальном количестве воды.
Лечение гипомагниемии
В подавляющем большинстве случаев пациенты могут проходить лечение амбулаторно. Необходимость в госпитализации возникает редко. Параллельно с устранением гипомагниемии проводится терапия основного заболевания и коррекция гипокалиемии, гипокальциемии. Если гипомагниемия вызвана приемом лекарственного препарата, то решение о его отмене должно приниматься лечащим врачом строго индивидуально, в зависимости от степени дефицита Mg и потребности больного в этом препарате.
В первую очередь назначается диета с включением в пищевой рацион продуктов, богатых магнием – бананов, орехов, фасоли. Иногда этого бывает достаточно для нормализации показателей Mg в крови. Если этого не произошло, используются следующие препараты:
- Пероральные формы.
При умеренной гипомагниемии применяются таблетированные формы – магния лактат, оротат, глюконат. Следует учитывать, что частым побочным явлением данных медикаментов является диарея, поэтому они не рекомендуются пациентам с заболеваниями кишечника и мальабсорбцией. - Парентеральные формы.
При тяжелой гипомагниемии внутривенно вводится магния сульфат вначале однократно, затем инфузионно, предварительно разведя на физиологическом растворе NaCl (0,9%). При нарушении выделительной функцией почек необходимо применять меньшие дозы и снижать скорость введения для избежания гипермагниемии. При появлении у больного внезапной тошноты и ослабления сухожильных рефлексов введение препарата стоит немедленно прекратить.
Профилактика
Профилактические мероприятия сводятся к:
- Рациональному питанию с достаточным количеством калийсодержащих продуктов без нарушения правил термической обработки.
- Исключению низкокалорийных диет, отказ от вредных привычек.
- Оптимизации сна/бодрствования.
- Ограничение психических и нервных перегрузок.
- Замене (по возможности) мочегонных средств и других лечебных препаратов, способствующих выведению калия из организма. При невозможности их замены необходимо регулярно проходить лабораторное обследование на концентрацию калия в сыворотке.
- Ограничению потребления поваренной соли.
- Периодическому приему для профилактической коррекции гипокалиемии Панангина (1 табл. 3 раза в день) на протяжении 3 недель.
Осложнения
Серьезные осложнения, угрожающие жизни, при гипомагниемии развиваются нечасто. Наиболее опасным является фибрилляция предсердий, которая может значительно улучшить гемодинамику и способствовать формированию тромбов в сердечных камерах. Кроме того, гипомагниемия увеличивает токсическое действие сердечных гликозидов на проводящую систему миокарда.
Из-за повышения тонуса бронхов и сосудов дефицит магния может ухудшать течение гипертонической болезни, бронхиальной астмы, а также усиливать выраженность мигренозных головных болей. При беременности грубая недостаточность магния способна спровоцировать преждевременные роды и самопроизвольный выкидыш. При длительном течении гипомагниемии у детей наблюдается задержка роста.
Последствия и осложнения
Наиболее существенным осложнением гипокалиемии является нарушение ритма сердца (фибрилляция желудочков/желудочковая тахикардия), что при отсутствии своевременной квалифицированной медицинской помощи может привести к летальному исходу. В ряде случаев может развиваться дыхательная недостаточность из-за слабости межреберной мускулатуры/диафрагмы. Гипокалиемия усиливает чувствительность к сердечным гликозидам, что сопровождается риском гликозидной интоксикации. Более редкими осложнениями являются кишечная непроходимость и развитие хронической почечной недостаточности.
Прогноз и профилактика
Гипокалиемия – это серьезная патология, которая без своевременного лечения может закончиться летальным исходом. Самой частой причиной смерти выступают аритмии (ПЖТ, ФЖ). Реже пациенты умирают от паралича диафрагмы, острой почечной недостаточности вследствие массивного рабдомиолиза. Профилактика сводится к лечению заболеваний, на фоне которых снижается уровень К+ в крови, добавлению к обычным мочегонным препаратам калийсбергающих диуретиков, употреблению продуктов, богатых калием (бананы, сухофрукты, овощи).
Список источников
- Нацименто Л. Гиперкалиемия и гипокалиемия//Трудный диагноз: В 2-х томах/ Под ред. Р.Б. Тейлора, т. 1. М., Медицина, 1992, с. 302-322.
- Руководство по клинической лабораторной диагностике. Ч.3: Клиническая биохимия/Под ред. проф. М.А. Базарновой, проф. В.Т. Морозовой. К., Вища школа, 1986, с. 216-223.
- Соковец Т.Г., Богданов Э.И. Гипокалиемические миоплегии//Казанский медицинский журнал. 2013. С.933–938.
- Молашенко Н.В., Платонова Н.М., Юкина М.Ю. и др. Первичный альдостеронизм. Сборник методических рекомендаций. Под ред. Е.А. Трошиной. Тверь: Триада; 2022.
- Хейтц У. Водно-электролитный и кислотно-основной баланс. Пер. с англ. М.: Бином; 2009.
К чему приводит нехватка калия в организме
Даже при незначительных отклонениях от нормы калия в организме последствия могут быть печальными:
- сахарный диабета на фоне истощения инсулинового аппарата;
- гипокалиемия, вызывающая тяжёлую аритмию, миалгию, усиление тонуса мышечных волокон;
- гликозидная интоксикация, спровоцированная большим объёмом сердечных гликозидов, плохо перерабатываемых почками;
- нарушение кислотно-щелочного баланса;
- патологические видоизменения в миокарде вплоть до внезапной остановки сердца, наступления коронарной смерти.
Проявления заболевания и диагностические методы
Клинические симптомы патологического процесса выявляются обычно при тяжелой степени заболевания, когда анализ крови на калий показывает содержание выше 7 ммоль/л. На этой стадии больные отмечают слабость в мышцах конечностей, невозможность полноценно передвигаться. Наблюдается покалывание, онемение, ползание мурашек (парастезии) в пальцах рук и ног.
Со стороны нервной системы отмечают заторможенность, нарушение реакции на внешние раздражители, ухудшение ментальной деятельности. В тяжелых случаях возникает нарушение сознания. Патологическое изменение работы сердца проявляется повышением или понижением артериального давления, чувством сердцебиения и нехватки воздуха. Часто формируются нарушения сердечного ритма, такие как пароксизмальная желудочковая тахикардия, асистолия, фибрилляция желудочков. Эти патологические состояние нередко приводит к летальному исходу.
Изменение зубца Т и желудочкового комплекса при проведении ЭКГ
К диагностическим методам выявления заболевания относится:
- содержание калия в сыворотке крови – норма – 3,3-5,3 ммоль/л, при гиперкалиемии катион повышен;
- концентрация калия в моче – показатели катиона ниже 30 ммоль/л;
- электрокардиография (ЭКГ) – увеличение амплитуды зубца Т, удлинение желудочкового комплекса, слияние комплексов и зубцов с образованием синусоиды на пленке.
При выявлении тяжелого нарушения ритма проводят экспресс-тест на определение катиона в сыворотке крови и приступают к лечебным мероприятиям по результатам анализа.